氯替泼诺联合玻璃酸钠滴眼液对干眼症患者眼表功能及NEI-VFQ-25评分的影响
张萌,李军琪,延新年
1.咸阳市第一人民医院综合眼病中心,陕西 咸阳712000;2.西安市第五医院眼科,陕西 西安710082
干眼症是指因高龄、睡眠不足、环境干燥等原因导致泪膜稳定性下降,并表现出角结膜干燥的一类慢性炎症反应[1]。患者临床表现为眼部异物感、泪液不足、对外界环境敏感等,若不及时治疗,随病情进展可导致角结膜病变,从而影响视力及生活质量[2]。目前,临床治疗干眼症尚无统一标准,玻璃酸钠滴眼液作为人工泪液的一种,临床应用较为广泛,作为一种高分子多糖体生物材料,具有理想的稳定泪膜效果[3]。随着研究的不断深入,临床发现炎症参与干眼症的发病与进展,联合抗炎药物治疗可有效提高临床疗效,减轻病损[4]。氯替泼诺是一类新型脂类皮质激素,可在短时间内发挥高强度的抗炎效果,且滴入眼睛后可迅速代谢,安全性较高[5]。本研究旨在探究氯替泼诺联合玻璃酸钠滴眼液对干眼症患者眼表功能及生活质量的影响。
1 资料与方法
1.1 一般资料采用随机数表法将2018 年5 月至2020 年6 月咸阳市第一人民医院综合眼病中心收治且符合以下纳入和排除标准的76 例干眼症患者分为观察组和对照组,每组38例。纳入标准:符合《中国干眼症临床诊疗专家共识》[6]中重度干眼症标准;入院前1 个月未曾接受相关治疗;泪膜破裂时间(break-up time,BUT)≤5 s;双眼病变程度无差异。排除标准:过敏体质;既往具有眼部手术史;合并重度感染性结膜炎;合并恶性肿瘤;服药依从性差;合并急性感染、慢性感染、慢性阻塞性肺等与炎症因子参与的全身性疾病。本研究已获得医院伦理会员会批准且患者均自愿签署知情同意书。两组患者的基线资料比较差异均无统计学意义(P>0.05),具有可比性,见表1。
表1 两组患者的基线资料比较[±s,例(%)]
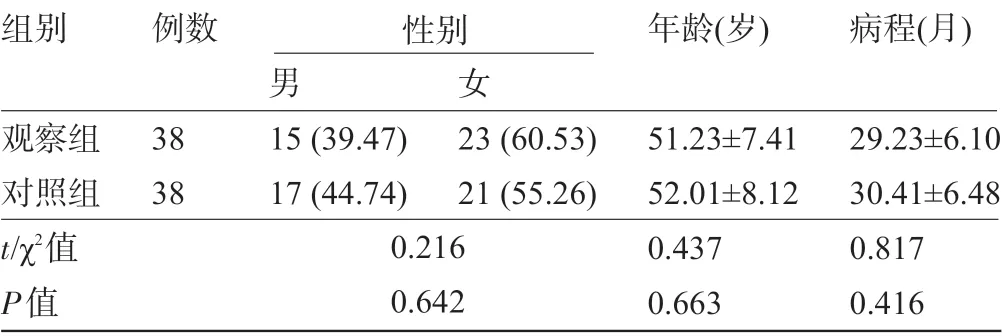
表1 两组患者的基线资料比较[±s,例(%)]
组别观察组对照组t/χ2值P值例数38 38男15 (39.47)17 (44.74)女23 (60.53)21 (55.26)0.216 0.642年龄(岁)51.23±7.41 52.01±8.12 0.437 0.663病程(月)29.23±6.10 30.41±6.48 0.817 0.416性别
1.2 治疗方法
1.2.1 对照组使用玻璃酸钠滴眼液(URSAPHARM Arzneimittel GmbH,国药准字H20150150,浓度为0.1%,规格为10 mL/支/盒),1 滴/次,3 次/d,根据患者病情严重程度给予剂量调整。两周为一个疗程,治疗4个疗程。
1.2.2 观察组玻璃酸钠滴眼液使用方法同对照组,在滴眼液治疗后30 min,使用氯替泼诺混悬滴眼液( 山东博士伦福瑞达制药有限公司,国药准字H20070003,1 mL:5 mg),摇匀后1~2滴/次,4次/d。两周为一个疗程,治疗4个疗程。
1.3 观察指标与评价方法
1.3.1 自觉症状评分治疗前后采用眼表疾病指数(ocular surface disease index,OSDI)[7]评估,该量表包括对患者眼部不适、视力及环境3维度的评价,共12条目,总分=实际得分×25/回答题数,0~12分为正常、13~22 分为轻度干眼,23~32 分为中度干眼,33~100 分为重度干眼。
1.3.2 眼表功能治疗前后检测泪液分泌量、BUT、角膜荧光素染色评分(corneal fluorescence staining,FL),仪器选择德国欧科路Keratograph 眼表综合分析仪(上海涵飞医疗器械有限公司)。其中泪液分泌量通过基础泪液分泌试验评估,在无风、背光、适宜温湿度条件下,折叠定量滤纸在结膜囊外1/3 处放置后记录5 min 滤纸湿长;BUT 指的是将适量荧光素钠滴入结膜囊,在裂隙灯钴蓝光下最后一次瞬目后睁眼至角膜出现第一个黑斑的时间;FL 指的是将1%的荧光素滴入结膜囊后的着色情况,评分0~12 分,得分越高表示其着色程度越高。
1.3.3 炎症因子治疗前后常规提取血清处理后保存待测,采用酶联免疫法测定白细胞介素-6 (interleukin-6,IL-6),试剂盒来自上海康朗生物科技有限公司;采用酶联免疫法测定白细胞介素-1β (interleukin-1β,IL-1β),试剂盒来自滁州仕诺达生物科技有限公司;采用乳胶增强免疫比浊法测定超敏C反应蛋白(highsensitivity C-reactive protein,hs-CRP),试剂盒来自上海信裕生物技术有限公司。
1.3.4 生活质量治疗前后采用美国国家眼科研究所视觉相关生命质量量表(25-item National Eye Institute Visual Function Questionnaire,NEI-VFQ-25)[8]评估,该量表包括一般健康、活动障碍及视力情况3个维度,共25项,每项均按照0~4分计分,得分越高表示其生活质量越好。
1.3.5 不良反应观察并记录两组治疗期间不良反应发生情况。
1.4 临床疗效参考《中医病证诊断疗效标准》[9],显效:眼部异物感、烧灼感等症状基本消失,泪液分泌量>10 mm/5 min,荧光染色阴性,BUT>10 s;有效:症状体征明显改善,泪液分泌量为5~10 mm/5 min,荧光染色阳性,BUT为5~10 s;无效:未达到上述标准,总有效率=(总例数-无效例数)/总例数×100%。
1.5 统计学方法应用SPSS20.0 软件进行数据统计分析,计数资料比较采用χ2检验,等级资料比较采用秩和检验,计量资料符合正态分布,以均数±标准差(±s)表示,组间比较采用独立t检验,组内比较采用配对t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗前后的自觉症状评分比较治疗前,两组患者的OSDI 评分比较差异无统计学意义(P>0.05);治疗后,两组患者的OSDI 评分明显低于治疗前,且观察组的OSDI评分明显低于对照组,差异均有统计学意义(P<0.05),见表2。
表2 两组患者治疗前后的自觉症状评分比较(±s,分)

表2 两组患者治疗前后的自觉症状评分比较(±s,分)
组别观察组对照组t值P值例数38 38治疗前25.71±5.23 25.84±5.64 0.104 0.917治疗后17.41±4.25 21.02±4.51 3.591 0.001 t值10.794 5.855 P值0.001 0.001
2.2 两组患者治疗前后的眼表功能比较治疗前,两组患者的泪液分泌量、BUT、FL比较差异均无统计学意义(P>0.05);治疗后,两组患者的泪液分泌量、BUT 明显高于治疗前,FL 明显低于治疗前,且观察组的泪液分泌量、BUT 明显高于对照组,FL 明显低于对照组,差异均有统计学意义(P<0.05),见表3。
表3 两组患者治疗前后的眼表功能比较(±s)
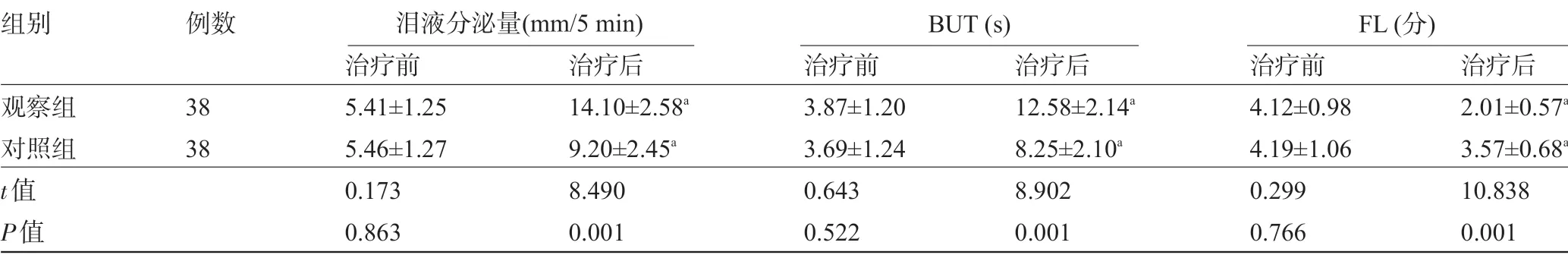
表3 两组患者治疗前后的眼表功能比较(±s)
注:与本组治疗前比较,aP<0.05。
组别观察组对照组t值P值例数38 38治疗前5.41±1.25 5.46±1.27 0.173 0.863治疗后14.10±2.58a 9.20±2.45a 8.490 0.001治疗前3.87±1.20 3.69±1.24 0.643 0.522治疗后12.58±2.14a 8.25±2.10a 8.902 0.001治疗前4.12±0.98 4.19±1.06 0.299 0.766治疗后2.01±0.57a 3.57±0.68a 10.838 0.001泪液分泌量(mm/5 min) BUT (s) FL (分)
2.3 两组患者治疗前后的炎症因子比较治疗前,两组患者的IL-6、IL-1β、hs-CRP 水平比较差异均无统计学意义(P>0.05);治疗后,两组患者的IL-6、IL-1β、hs-CRP 明显低于治疗前,且观察组的IL-6、IL-1β、hs-CRP明显低于对照组,差异均有统计学意义(P<0.05),见表4。
表4 两组患者治疗前后的炎症因子比较(±s)
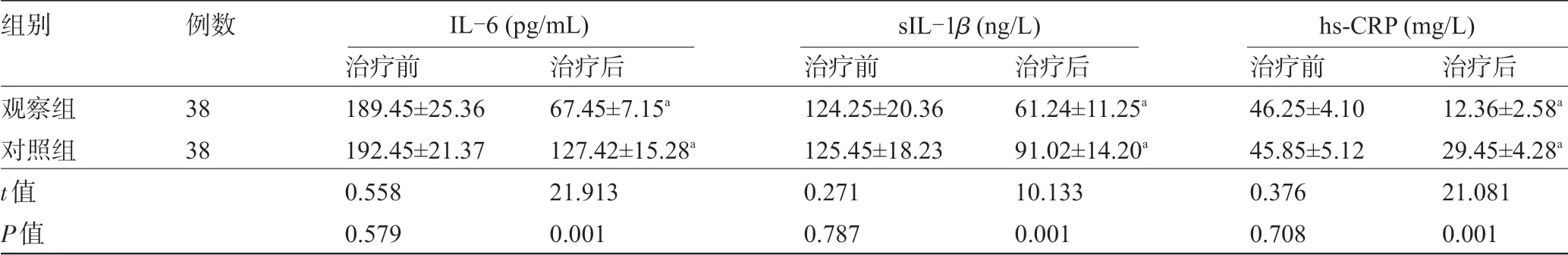
表4 两组患者治疗前后的炎症因子比较(±s)
注:与本组治疗前比较,aP<0.05。
组别观察组对照组t值P值例数38 38治疗前189.45±25.36 192.45±21.37 0.558 0.579治疗后67.45±7.15a 127.42±15.28a 21.913 0.001治疗前124.25±20.36 125.45±18.23 0.271 0.787治疗后61.24±11.25a 91.02±14.20a 10.133 0.001治疗前46.25±4.10 45.85±5.12 0.376 0.708治疗后12.36±2.58a 29.45±4.28a 21.081 0.001 IL-6 (pg/mL) sIL-1β (ng/L) hs-CRP (mg/L)
2.4 两组患者治疗前后的生活质量比较治疗前,两组患者的NEI-VFQ-25 各维度评分比较差异均无统计学意义(P>0.05);治疗后,两组患者的NEI-VFQ-25 各维度评分明显高于治疗前,且观察组NEI-VFQ-25 各维度评分明显高于对照组,差异均有统计学意义(P<0.05),见表5。
表5 两组患者治疗前后的生活质量比较(±s,分)

表5 两组患者治疗前后的生活质量比较(±s,分)
注:与本组治疗前比较,aP<0.05。
组别观察组对照组t值P值例数38 38治疗前51.24±4.23 50.47±4.21 0.795 0.429治疗后65.23±6.01a 58.42±5.13a 5.313 0.001治疗前75.24±5.12 76.58±5.41 1.109 0.271治疗后95.01±7.23a 86.12±6.57a 5.610 0.001治疗前85.42±5.48 84.58±5.10 0.692 0.491治疗后95.24±6.21a 89.23±5.47a 4.477 0.001一般健康 活动障碍 视力情况
2.5 两组患者的临床疗效比较观察组患者的治疗总有效率为92.11%,明显高于对照组的73.68%,差异有统计学意义(P<0.05),见表6。

表6 两组患者的临床疗效比较[例(%)]
2.6 两组患者的不良反应比较治疗过程中,对照组出现1 例眼压升高(治疗后3 d),1 例瘙痒(治疗后4 d),不良反应发生率为5.26%;观察组出现2 例眼压升高(治疗后2 d),1 例结膜充血(治疗后2 d),1 例眼部 不适(治疗后1 d),不良反应发生率为10.53%,两组患者的不良反应发生率比较差异无统计学意义(χ2=0.181,P=0.671)。两组患者的不良反应经休息及对症处理后,均立即恢复并完成后续治疗。
3 讨论
国际泪膜与眼表协会在2017年发表的《干眼专家共识》中提出国内外干眼症患病率为6.5%~39.2%,需引起重视[10]。现代医学认为,干眼症发病是因为外眼的自然生理功能及保护机制异常,并使得泪液分泌减少,无法有效滋润眼表引起,可导致视力下降[11]。目前,临床治疗干眼症主要以补充人工泪液为主,但单独使用效果不佳,无法根治,建议联合其他作用途径的药物发挥协同作用,以提高疗效[12]。
随着医疗技术的不断发展,人工泪液产品种类也不断增多,优质的人工泪液可在一定程度上改善患者干眼症状,其中玻璃酸钠滴眼液属于临床常用人工泪液的一种,应用于干眼症的治疗效果已得到认可。柯峰等[13]认为,玻璃酸钠滴眼液较传统人工泪液羟糖苷而言更能促进患者泪膜稳定的恢复,改善其眼表功能。高鹏等[14]对比分析不同人工泪液治疗干眼的疗效,发现玻璃酸钠滴眼液较聚乙二醇滴眼液、聚丙烯酸眼胶疗效更优。玻璃酸钠由N-乙酰葡萄糖醛酸交替形成,具有高度可塑性及保水特性,且还可修复角膜上皮组织,阻止视力下降。但考虑干眼症患者泪液中的免疫物质缺乏可导致炎症因子大量释放,并诱发角膜溃疡,严重者可导致失明,临床建议联合抗炎药物协同治疗。本研究采用氯替泼诺及玻璃酸钠滴眼液治疗,结果发现观察组治疗后的自觉症状评分及FL低于对照组,而泪液分泌量、BUT明显高于对照组,提示联合治疗较单纯人工泪液补充更有利于患者眼表功能的恢复。分析是因为,人工泪液可在一定程度上营养及润滑角结膜,但无法彻底根治,而氯替泼诺具有较高脂溶性,可快速通过角膜诱导磷脂酶A2抑制蛋白起到抗炎作用,综合改善眼表功能,且该药物抗炎效果较传统糖皮质激素更强,疗效更佳。与杜婧等[15]研究上述两者药物联合治疗中重度干眼症可改善其眼表功能的结果相似。
2007 年国际肝炎病专题研究会明确提出干眼症是一种眼表炎症性疾病,泪液分泌及排除系统功能异常可促进炎症反应的发生,并伴随乳铁蛋白等抗炎因子含量的下降及hs-CRP 等促炎因子含量的上升[16]。早期相关细胞因子被激活后可起到一定的抵抗作用,但随泪液渗透压的升高及眼表感染的加重,导致炎症介质不断释放,并阻碍神经调控的泪液分泌,加重病情发展,形成恶性循环。抗炎治疗已成为现临床干眼症治疗方案的关注重点[17]。本研究结果显示,观察组治疗后的IL-6、IL-1β、hs-CRP 水平明显低于对照组,且生活质量得到显著改善。另外,综合分析得出观察组治疗有效率可高达92.11%,提示氯替泼诺联合玻璃酸钠滴眼液治疗效果理想,而两组不良反应发生率相当,则提示联合治疗方案亦具有一定安全性。分析原因为,玻璃酸钠具有保护角膜内皮细胞的作用,而在此基础上氯替泼诺具有理想的抗炎效果,且代谢部位在角膜,可避免药物在房水部位聚集后影响结构改变,降低系统毒性及眼压升高风险。
综上所述,氯替泼诺联合玻璃酸钠滴眼液疗效理想,可改善干眼症患者眼表功能,降低IL-6、IL-1β、hs-CRP 炎症因子的释放,改善其生活质量,值得临床推广应用。但考虑本研究为单中心小样本随机研究,无法避免选择偏移的情况,对结果是否存在影响与后期考察。

