血清miR-150表达水平与脓毒症患儿疾病严重程度及预后的相关性分析*
赵晓敏,江晓宇,单凯莉,单铁英,王洪新,张 倩,刘秀珍
河北省邯郸市中心医院儿科,河北邯郸 056000
脓毒症是由感染引起宿主反应失调的全身炎症反应综合征,失控时可进一步进展至脓毒性休克、多器官功能障碍综合征,可影响患儿的临床预后[1]。住院患儿由于机体脏器功能发育不全,抵抗感染和减轻炎性反应的能力下降,持续的全身炎性反应可加重患儿的原发疾病病情,容易进展至脓毒症休克和多器官功能障碍,增加住院患儿病死率及延长住院时间,导致临床预后不良[2]。目前脓毒症的诊断主要依赖于生命体征的变化及血清炎症因子和血气分析检查,通过以上方式早期评估脓毒症患儿的疾病严重程度和炎性反应,可尽早避免疾病进展至多器官功能障碍,降低患儿病死率。微小RNA(miRNA) 是新近发现的一类在转录后水平上对基因的表达进行调控的非编码RNA,参与炎症、肾脏疾病、心血管疾病、肿瘤等多种疾病调节过程,因此近年来逐渐被认识并广泛深入研究[3]。在脓毒症患儿中,多种miRNA参与疾病的发生、发展及调控过程,例如miR-125b[4]、miR-146[5]、MIR223[6]等。然而,目前miR-150在脓毒症患者尤其是患儿中的表达情况尚不明确,其与疾病的严重程度、炎性反应及死亡风险等关系值得更加深入地探讨。因此,本研究拟探讨血清miR-150在脓毒症患儿的表达情况,分析血清miR-150表达水平与疾病严重程度、炎性反应及28 d病死率的关系,以期寻找评价脓毒症患儿疾病病情和临床预后的血清学指标。
1 资料与方法
1.1一般资料 选取2016年1月至2018年12月本院收治的脓毒症患儿137例作为脓毒症组。入选标准:(1)年龄3~<14岁,男女不限。(2)脓毒症的诊断参照相关标准[7],有明确证据表明患儿存在感染或高度怀疑感染并伴发以下征象。①呼吸频率≥22次/min,意识改变,收缩压≤100 mm Hg和(或)平均动脉压<70 mm Hg;②动脉氧分压<300 mm Hg和(或)氧体积分数<40 kPa;③胆红素≥33 μmol/L;④尿量<500 mL/d。(3)研究对象监护人同意参与并签署知情同意书。排除标准:(1)合并恶性实体肿瘤或者血液系统肿瘤;(2)近3个月接受免疫抑制剂治疗;(3)合并自身免疫性疾病如系统性红斑狼疮、类风湿关节炎;(4)交流沟通障碍或伴有精神疾病。脓毒症组男性79例、女性58例,平均年龄为(11.52±1.91)岁。另选取同期本院收治的非脓毒症住院患儿87例作为对照组,其中男性51例、女性36例,平均年龄为(11.43±1.15)岁。两组年龄、性别比例比较,差异无统计学意义(P>0.05)。本研究已获本院伦理委员会批准进行。
1.2血清miR-150检测 两组患儿清晨空腹状态采集肘静脉血共5 mL,以3 000 r/min转速且离心直径为80 cm的条件下,离心10 min,取上层血清保存于-80 ℃冰箱中备用。采用RNA提取纯化试剂盒(购自北京天根生化科技有限公司)完成血清总RNA的提取,采用实时荧光定量PCR技术检测入组患儿miR-150表达水平。以U6为内参对照,反应温度94 ℃ 2 min进行1个循环,94 ℃ 40 s、60 ℃ 40 s、72 ℃ 1 min内完成35个循环,最后72 ℃ 5 min完成1个循环,通过2-ΔΔCt法分析其相对表达水平。miR-150的上游引物为5′-GGA ACA GCA GGT CTG GT-3′,下游引物为5′-CCA CAG ACA TGG GCA GG-3′。U6上游引物:5′-CTC GCT TCG GCA GCA CA-3′,下游引物:5′-AAC GCT TCA CGA ATT TGC GT-3′。
1.3资料收集与检测方法 收集患儿的基线资料,包括年龄、性别、格拉斯哥昏迷(GCS)评分[8]、基线急性生理功能和慢性健康状况评分系统Ⅱ(APACHE Ⅱ)评分[9]、序贯器官衰竭评分(SOFA)评分[10]、基线血肌酐、基线预估的肾小球滤过率(eGFR)、血红蛋白、血小板、乳酸、尿酸、降钙素原、血清清蛋白、C反应蛋白,同时随访患儿从确诊脓毒症起始的28 d是否发生死亡。GCS评分由睁眼反应、语言反应和肢体运动 3部分组成,总得分为三者之和,总分为0~30分,分数越高则昏迷程度越严重。血常规使用广州迈瑞公司BC5000全自动血细胞分析仪进行检测,血清清蛋白、尿酸和血肌酐采用美国贝克曼公司型号为Beckmancoulter的LX20仪器检测,乳酸采用德国Senslab公司型号为Lactata-scout的便携式乳酸盐分析仪检测,降钙素原采用德国Berthold公司生产的型号BLA250的检测仪器检测,C反应蛋白采用Rche公司出产的MODULARP型号 P800全自动生化分析仪检测,eGFR按慢性肾脏病流行病协作研究(CKD-EPI)公式计算[11]。
2 结 果
2.1两组患儿临床基线资料比较 与对照组比较,脓毒症组APACHE Ⅱ评分、GCS评分、SOFA评分及血肌酐、乳酸、降钙素原、C反应蛋白水平较高,eGFR、血清清蛋白和血清miR-150表达水平较低,差异均有统计学意义(P<0.05)。两组其余临床指标包括年龄、性别、血红蛋白、血小板计数、尿酸水平比较,差异无统计学意义(P>0.05),见表1。
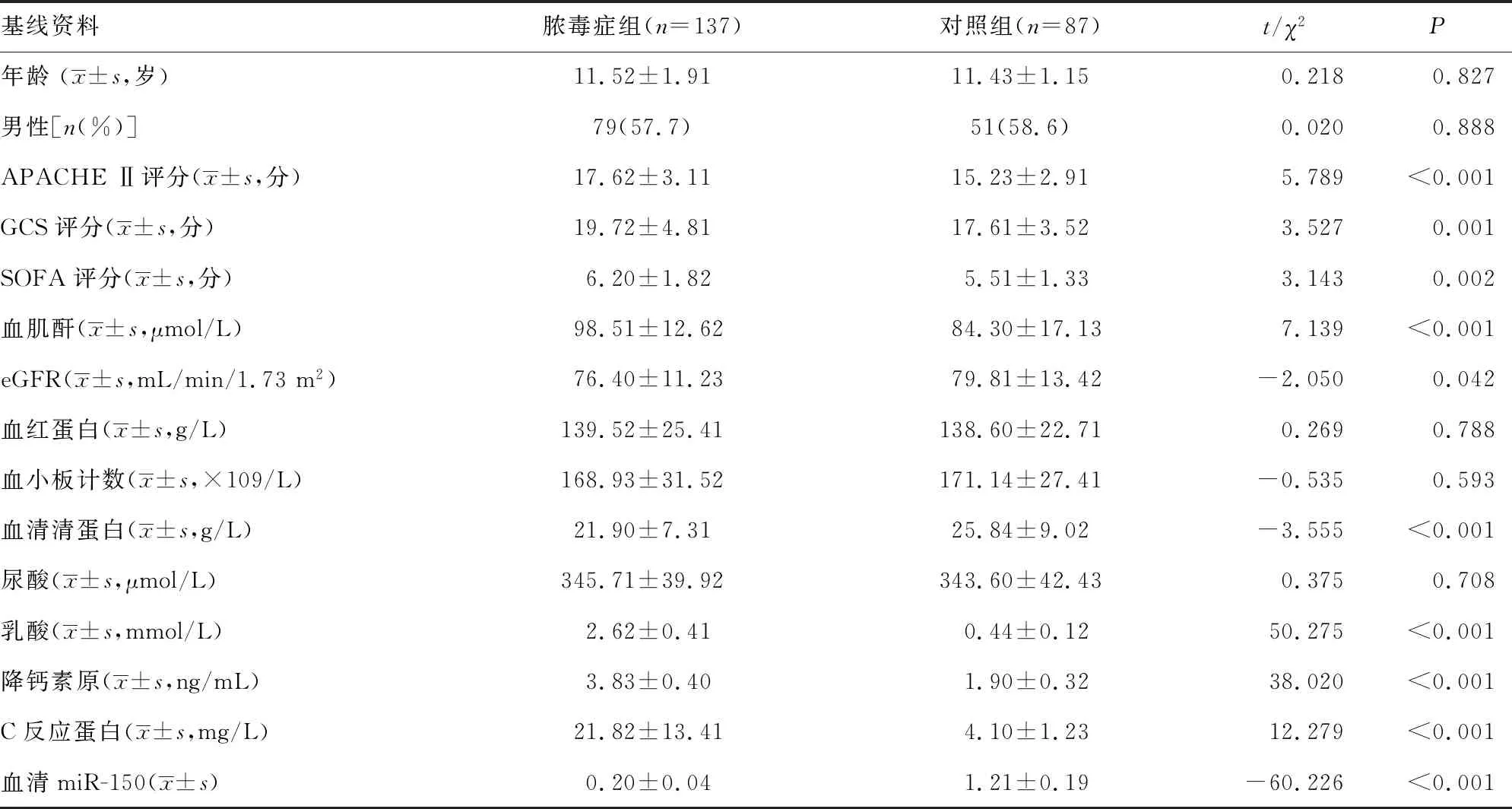
表1 两组患儿临床基线资料比较
2.2脓毒症患儿miR-150表达水平与疾病严重程度、炎性反应相关性分析 根据脓毒症患儿miR-150表达水平的平均值作为界限,分为低miR-150组(miR-150<0.20)64例和高miR-150组(miR-150≥0.20)73例,比较两组患儿疾病严重程度指标(APACHE Ⅱ评分、GCS评分、SOFA评分)和炎性指标(降钙素原和C反应蛋白)水平差异。低水平miR-150组的APACHE Ⅱ评分、SOFA评分、降钙素原和C反应蛋白水平均高于高水平miR-150组,差异均有统计学意义(P<0.05),而两组GCS评分比较,差异无统计学意义(P>0.05)。见表2。采用Pearson相关性分析脓毒症患儿血清miR-150表达水平与APACHE Ⅱ评分、GCS评分、SOFA评分、降钙素原和C反应蛋白之间的相关性,结果显示miR-150表达水平与APACHE Ⅱ评分、SOFA评分、降钙素原和C反应蛋白呈负相关(P<0.05)。见表3。

表2 低miR-150组和高miR-150组各指标水平比较

表3 miR-150与疾病严重程度、炎性反应的相关性分析
2.3脓毒症患儿28 d死亡危险因素分析 建立Logistic回归模型,以137例脓毒症患儿的基线资料为样本,以发生脓毒症后28 d是否死亡作为因变量,连续变量按照两组总均值进行分段,转化为两分类变量,以提高统计效率使回归结果清晰。137例脓毒症患儿中死亡51例(死亡组),存活86例(生存组)。其中与生存组相比,死亡组APACHE Ⅱ评分、SOFA评分及血肌酐、降钙素原、C反应蛋白、乳酸水平较高,eGFR、血清清蛋白和血清miR-150表达水平较低(P<0.05)。选取单因素Logistic回归分析中具有统计学意义的变量纳入多因素Logistic回归分析,回归过程采用“进入法”以进行自变量的选择和剔除,设定α剔除=0.10,α入选=0.05,连续变量按照两组总均值进行分段,回归结果:共有APACHE Ⅱ评分、乳酸、血肌酐、血清清蛋白、降钙素原、C反应蛋白和血清miR-150被保留入回归方程。APACHE Ⅱ评分升高,高水平的乳酸、血肌酐、降钙素原、C反应蛋白,以及低水平血清清蛋白和血清miR-150均是脓毒症患儿28 d死亡的危险因素(OR>1,P<0.05)。见表4、5。

表4 脓毒症患儿死亡组和生存组临床资料比较
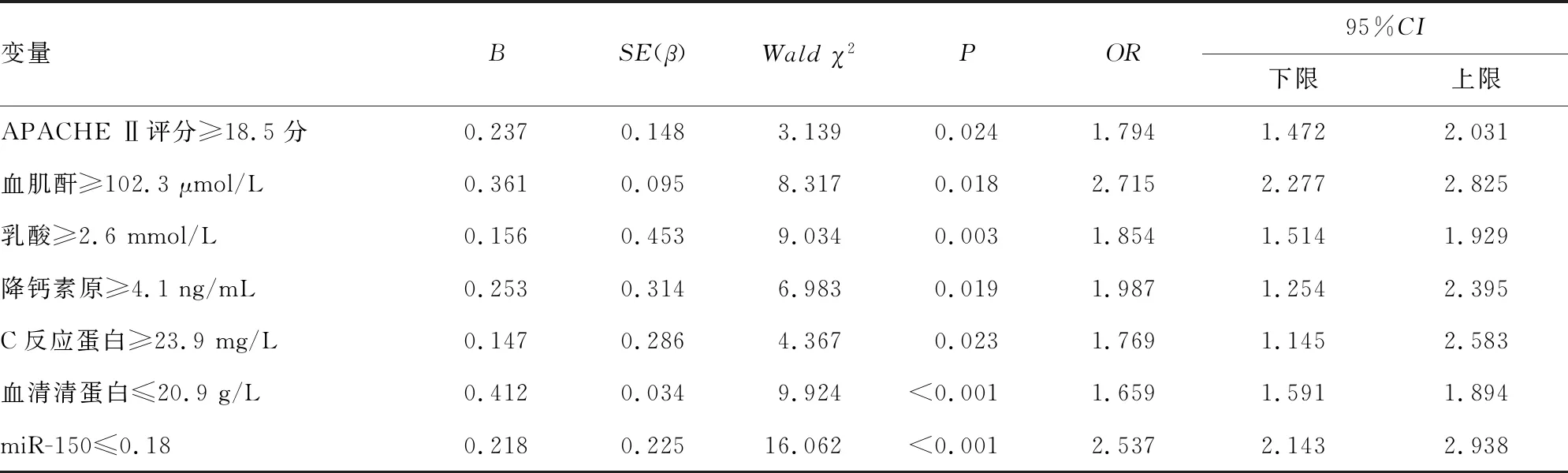
表5 脓毒症患儿28 d死亡的多因素logistic回归分析
3 讨 论
脓毒症是指由感染因素引起的全身炎症反应综合征,严重者可导致全身多器官功能障碍,是严重创伤、烧伤、休克、感染和外科大手术等常见的并发症。脓毒症和脓毒症休克是住院患儿死亡的主要原因,全世界范围内数百万人死于脓毒症,病死率高达25%[12]。脓毒症涉及全身炎性反应、免疫功能缺陷、基因遗传易感性等多种不同机制,且脓毒症患儿的病理生理与成人存在较大差异,其诊断、治疗和病情评估具有其特殊性[13],准确评估脓毒症患儿的疾病严重程度和炎性反应能尽早预判患儿的临床预后,采取积极的治疗措施可改善脓毒症患儿的临床结局。
miRNA是在真核生物中发现的一类内源性的具有调控功能的非编码RNA,在细胞内具有多种重要的调节作用。miRNA在脓毒症患儿的炎性反应和免疫调控方面发挥着重要作用[14-15]。细胞膜表面识别细菌组分的固有免疫相关的模式识别受体——Toll样受体,诱导产生miRNA,进而介导炎症介质的释放和信号传导。miR-150是一个由大约22nt组成的单链非编码小分子RNA,具有组织表达的特异性,参与免疫调节过程。既往在健康者和脓毒症患儿的全基因组miRNA芯片分析提示,miR-150在脓毒症患儿中具有较高的差异性表达[16]。此外,miR-150与炎性反应中的炎症介质如白细胞介素-18(IL-18)、白细胞介素-10(IL-10)和肿瘤坏死因子-α(TNF-α)的编码基因序列具有一定的互补关系,因此可能参与脓毒症炎症因子和炎性反应的调控[17]。本研究结果发现,脓毒症组miRNA-150表达水平明显低于对照组,且miR-150低水平组的APACHE Ⅱ评分和SOFA评分高于miR-150高水平组,降钙素原和C反应蛋白的水平也高于miR-150高水平组。既往相关研究也表明,脓毒症患儿血浆中miR-150的表达较正常组减少,且其表达水平与SOFA评分相关,可用于评价脓毒症患儿的疾病严重程度[16]。在心血管疾病领域也表明,急性心力衰竭患儿miR-150表达水平明显低于健康人群[18]。miR-150对于疾病的调节,主要是通过特异性结合靶位基因,负性调控目的基因的表达,进而导致疾病进程发生变化。
此外,本研究还发现,miR-150表达水平与APACHE Ⅱ评分、SOFA评分、降钙素原和C反应蛋白水平呈负相关。miR-150表达水平越低,疾病的严重程度越高,炎性反应越严重。miR-150对脓毒症患儿炎性反应的调控,主要基于miR-150能够在转录后水平调节基因的表达,调节Toll样受体信号通路的起始、终止和反应强度,而Toll样受体作为模式识别受体,能够通过多种途径激活相关信号激酶,引起炎症介质的表达和释放,参与炎性反应和免疫调节过程[17]。此外,miR-150与IL-18、IL-10和TNF-α的编码基因序列具有一定的互补关系,能够负性调控脓毒症患儿IL-18、IL-10和TNF-α水平[18]。IL-18、IL-10和TNF-α作为脓毒症患儿中参与炎性反应重要的炎症介质,直接反映脓毒症患儿的炎症水平[17]。
本研究还发现,APACHE Ⅱ评分升高,高水平的乳酸、血肌酐、降钙素原、C反应蛋白,以及低水平血清清蛋白和血清miR-150均是脓毒症患儿28 d死亡的危险因素。APACHE Ⅱ评分作为危重症医学重要的评分系统,能够反映疾病的严重程度,预测患儿的死亡风险。高水平的乳酸同样可以用于预测脓毒症患儿的死亡[19]。血肌酐水平升高则反映机体排泄代谢产物的能力下降,进而影响患儿的临床预后。低血清清蛋白患儿合成免疫球蛋白的能力下降,降低机体的免疫能力,从而增加脓毒症患儿的死亡风险。炎症水平较高的患者由于感染容易累及多脏器功能衰竭,增加临床死亡风险。miR-150表达水平不但反映机体炎性反应状态,而且在一定程度上能作为判断疾病严重程度及预后的指标。miR-150表达水平越低,提示脓毒症患儿的疾病严重程度越高,相应的死亡风险也越高。
本研究发现血清miR-150表达水平能够评估脓毒症患儿的疾病严重程度和炎性反应,对于预测28 d病死率具有一定的临床应用价值。但本研究为单中心小样本研究,需要进一步扩大样本量提高研究的循证证据力度;此外,本研究未能动态监测血清miR-150表达水平变化,其表达水平是否能够评估疾病转归过程仍然需要更多的研究证据。
综上所述,脓毒症患儿血清miR-150表达水平低下,且能够反映疾病的严重程度和炎症水平,预测患儿的死亡风险,可以作为协助评估脓毒症患儿病情的血清学指标。

