基于胸腔积液生物标志物和CT征象的肺癌风险模型的建立与验证
涂宇琴,吴 燕,陆云峰,陈 特,毕小云△
重庆医科大学附属第一医院:1.医学检验科;2.输血科;3.放射科,重庆 400016
肺癌在全球是导致癌症相关死亡的主要原因[1]。恶性胸腔积液是渗出性胸腔积液的第二大主要原因[2]。为了鉴别良恶性胸腔积液,目前常见的非侵入性诊断方法如生物标志物检测已广泛应用于肺癌的诊断,其中癌胚抗原(CEA)和细胞角蛋白19片段(CYFRA21-1)是肺癌诊断、治疗监测和预后判断中常用的生物标志物[3-4]。胸腔积液CEA是区分肿瘤与非肿瘤性胸腔积液最常见的指标[5-6];细胞学检查为金标准,但灵敏度仅为60%[7];低剂量CT(LDCT)筛查使肺癌病死率降低20%,但其假阳性率较高[8-9]。肺泡灌洗、经皮肺穿刺活检、胸腔镜手术等侵入性诊断方法在临床较常用,可与实验室和影像学检查相互补充,但这些方法成本偏高、风险较大,患者的耐受性较差。目前,使用数学模型预测肺癌风险是国内外推荐使用的方法[10]。为此,本实验基于生物标志物与CT征象建立肺癌风险模型,通过外部验证证实该模型具有较高的诊断性能及可重复性,可用于评估伴有胸腔积液的肺部病变患者罹患肺癌的风险。
1 资料与方法
1.1一般资料 采用回顾性研究设计,将2017年1月至2020年5月首次在本院行胸腔穿刺术的1 664例患者按纳入、排除标准筛选出训练集460例胸腔积液患者用于构建模型,134例胸腔积液患者研究对象组成验证集,对模型进行外部验证。训练集中肺癌组237例患者,对照组223例患者;验证集中肺癌组67例患者,对照组67例患者。肺癌组包括细胞学或组织病理活检确诊的腺癌、鳞癌、小细胞肺癌患者,对照组为同期住院的其他呼吸系统疾病(结核、肺炎、慢性阻塞性肺疾病等)并伴有胸腔积液的患者。
纳入标准:(1)有完整的临床资料,包括如年龄、性别、吸烟情况、肿瘤家族史和恶性肿瘤病史;(2)有完整的CT征象,包括肿块最大直径(cm)、病变位置、肿块有无分叶、毛刺、血管会聚、空气支气管征和胸膜凹陷征;(3)有完整的实验室数据,包括胸腔积液清蛋白(ALB)、球蛋白(GLB)、乳酸脱氢酶(LDH)、总胆红素(TBIL)、总蛋白(TP)、ALB/GLB比值(A/G)、CEA和CYFRA21-1。排除标准:(1)5年内有恶性肿瘤病史;(2)濒临死亡的病例;(3)患有慢性肾功能不全、糖尿病、肝硬化等可导致CEA等检查指标假阳性的疾病;(4)慢性病毒感染;(5)孕妇或者哺乳期;(6)器官移植。
1.2仪器与试剂 采用罗氏Cobas e602电化学发光法,检测CEA和CYFRA21-1水平;罗氏Cobas c701全自动生化分析仪检测TP、ALB、LDH、TBIL和A/G。采用64层螺旋CT对患者进行胸部扫描,收集平扫和(或)增强CT数据,详细记录病变部位特征。所有CT图像由两名经验丰富的胸部组放射科医师解读,对有争议的结果由两者协商并达成一致。
1.3方法 结合临床及既往研究经验对潜在危险因素进行特征选择,在5个临床基本资料(性别、年龄、吸烟史、肿瘤家族史和肿瘤病史),7个影像学特征(肿块最大直径、分叶征、毛刺征、胸膜凹陷征、血管集束征、空气支气管征和病变位置)和8个胸腔积液检测结果(CEA、CYFRA21-1、ALB、GLB、LDH、TBIL、TP和A/G)中,利用多因素Logistic回归分析在五折交叉验证中的分类结果来选择出最优的特征组合。采用一个标准误差(one-standard-error)准则作为后向选择的停止准则。模型1由临床-放射学结合生物标志物参数构成,模型2仅包括临床-放射学参数,以对比将生物标志物与CT征象联合后模型诊断性能的变化。同时为有胸腔穿刺禁忌证的患者提供替代模型2。
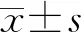
2 结 果
2.1训练集、验证集临床资料 训练集中肺癌组237例,其中腺癌158例,鳞癌49例,小细胞肺癌30例。对照组223例患者中结核146例,肺炎34例,其他病变43例。肺癌组平均年龄大于对照组(P<0.001),且肺癌患者中吸烟更常见;与对照组比较,肺癌组病变处呈现的分叶征、毛刺征、胸膜凹陷征、血管集束征、空气支气管征等征象更多见(P<0.05)。训练集中肺癌组和对照组的胸腔积液CEA、CYFRA21-1、ALB、GLB、TBIL水平和A/G比较,差异均有统计学意义(P<0.05)。肺癌组与对照组肿瘤家族史占比比较差异无统计学意义(P=0.223),但结合实际临床经验及既往研究,仍将该变量纳入候选因素。验证集中肺癌组和对照组各67例,其中腺癌47例,鳞癌17例,小细胞肺癌3例;结核34例,肺炎18例,其他病变15例,见表1、2。
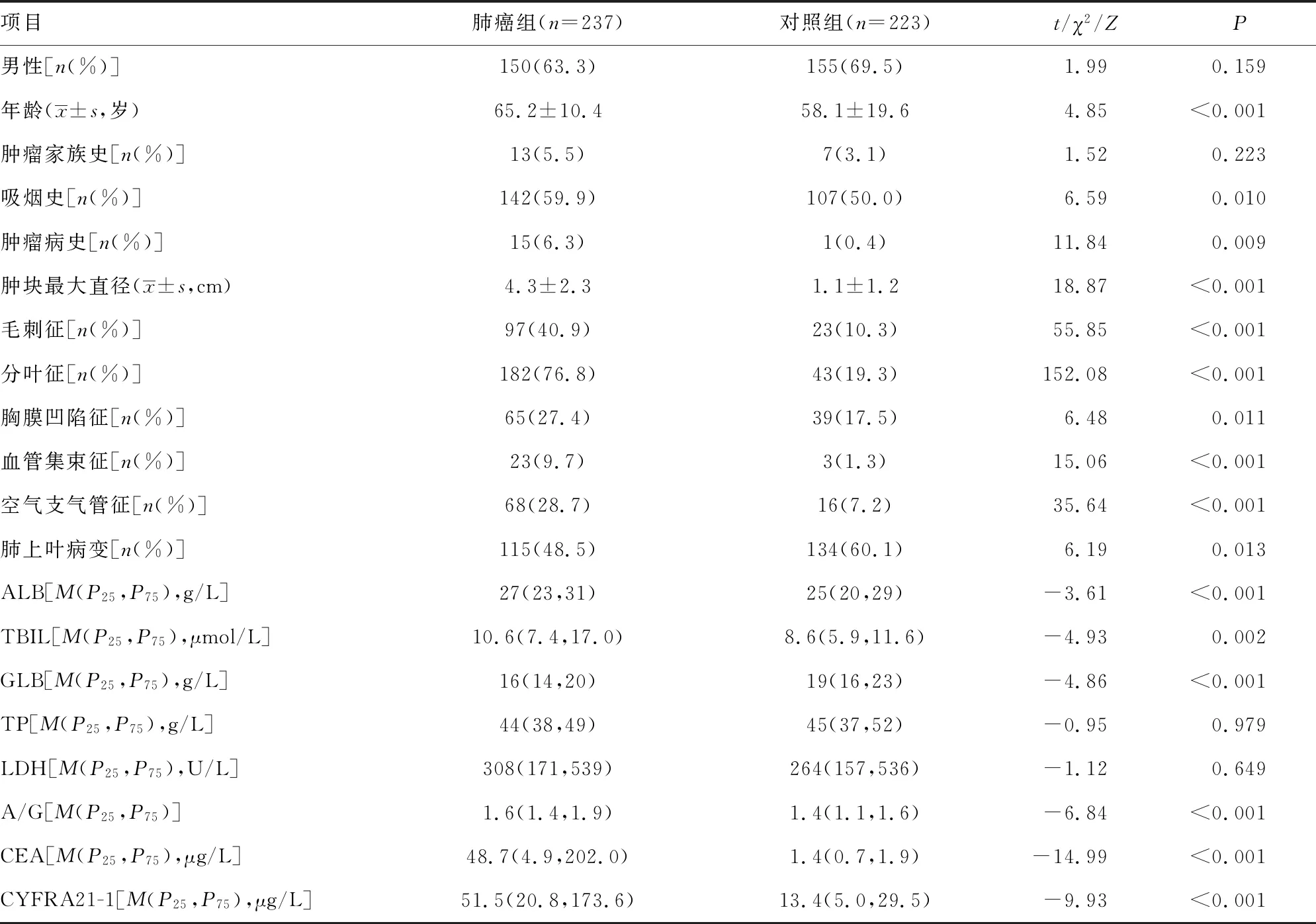
表1 训练集临床特征
2.2建立肺癌风险模型 通过交叉验证,模型1中肺癌的独立危险因素包括肿瘤病史、肿块最大直径、空气支气管征、A/G、lgCEA和lgCYFRA21-1。模型2的参数为肿瘤病史、肿块最大直径、分叶征和血管集束征(表3)。根据Logistic回归模型系数构建列线图,实现模型可视化(图1)。通过两个列线图可以实现肺部病变患者癌症发生概率的个体化预测,计算得出的数值越高,患者发生肺癌的可能性越高。
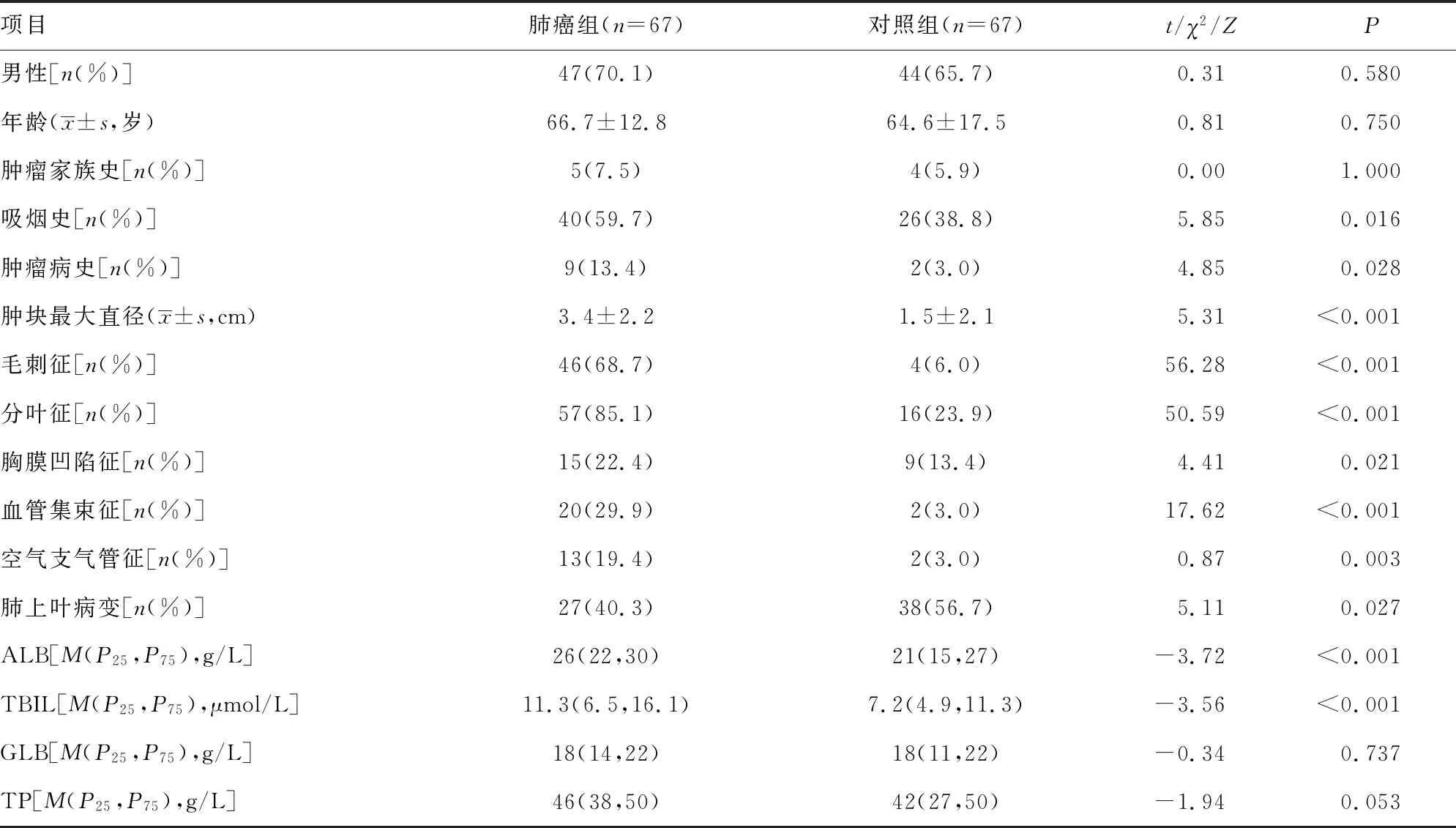
表2 验证集临床特征

续表2 验证集临床特征

表3 多因素Logistic回归模型

注:A为模型1;B为模型2。
2.3模型比较与验证 训练集与验证集对应的ROC曲线见图2,以AUC量化模型性能。在训练集中模型1的AUC为0.979(95%CI:0.968~0.991),模型2的AUC为0.932(95%CI:0.909~0.955);验证集中两个模型的曲线下面积用AUC′表示,分别为0.911(95%CI:0.861~0.961)和0.846(95%CI:0.776~0.917),反映了模型较高的外部适用性。通过Delong检验,训练集中模型1的性能优于模型2,两者AUC比较,差异有统计学意义(P<0.001),验证集中P=0.009。校准曲线中Hosmer-Lemeshow拟合优度测试,两个模型的P>0.05,分别为0.61和0.20,并且R2分别为0.85和0.70,表明模型拟合良好。可以看出模型1的预测概率与观测频率之间一致性更好(图3)。验证队列诊断分类表上模型1对肺癌患者的正确分类比例为86.6%,灵敏度91.0%,特异度82.1%,阳性预测值83.6%,阴性预测值90.2%;模型2正确分类比例为82.1%,灵敏度88.1%,特异度76.1%,阳性预测值78.7%,阴性预测值86.4%(表4)。模型1决策曲线分析在50%阈值概率下的净收益为45.0%,模型2为39.8%,均优于基线模型。并且模型1的表现要优于模型2,在临床上具有更好的应用价值(图4)。
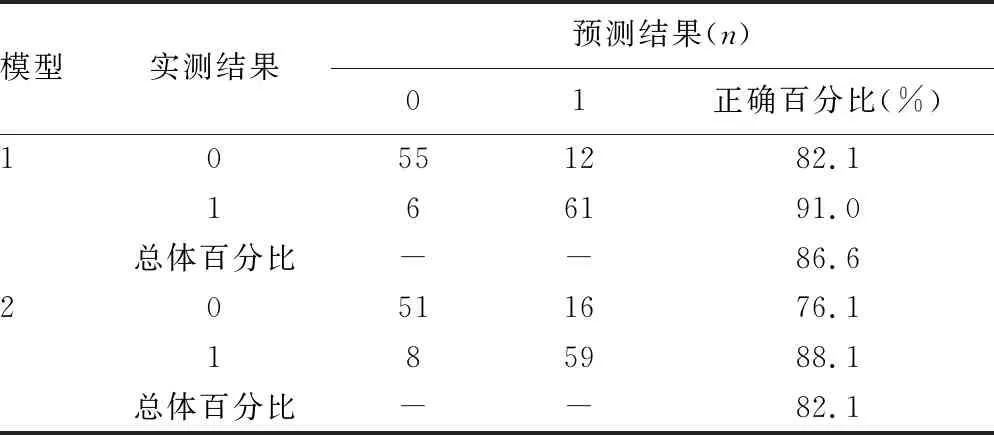
表4 验证队列模型的诊断分类
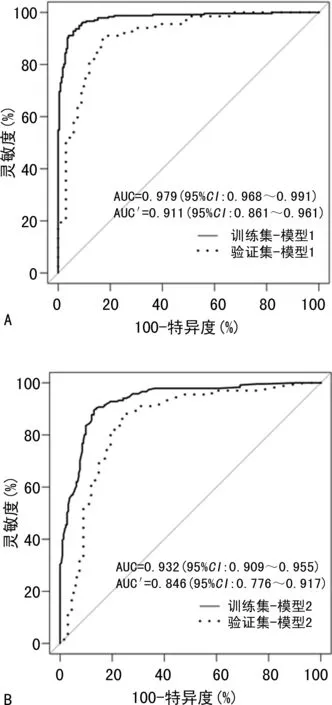
注:A为模型1、B为模型2;AUC与AUC′分别代表训练集与验证集模型曲线下面积。
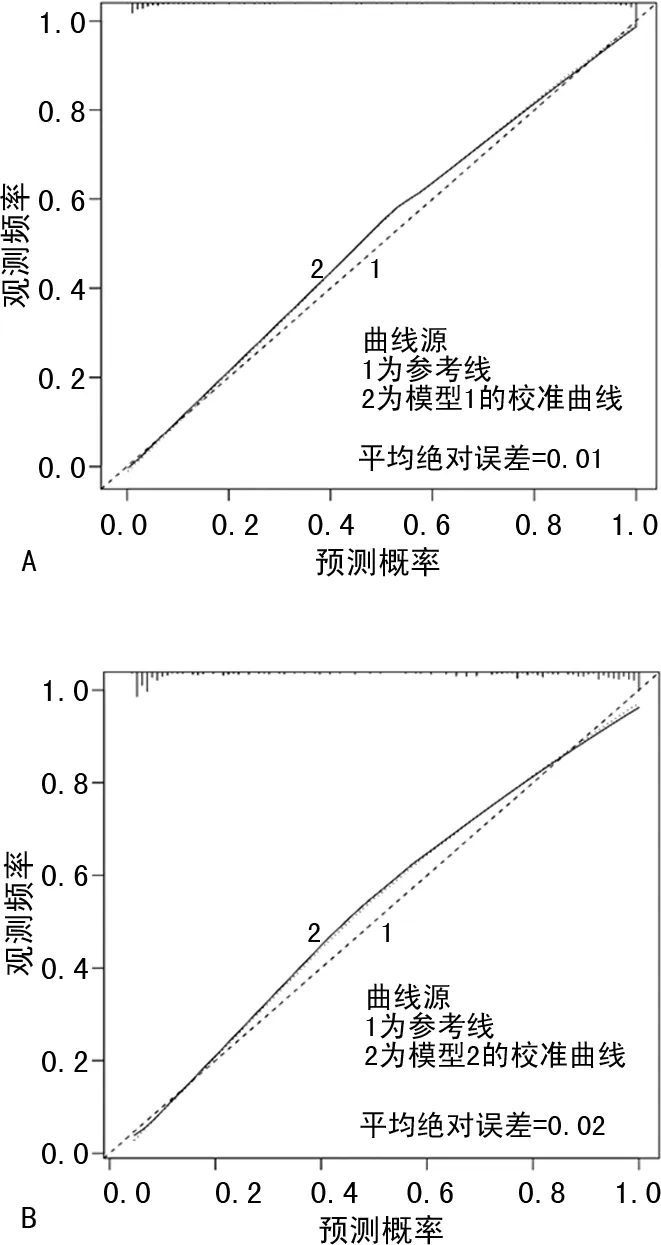
注:A为模型1;B为模型2。
3 讨 论
本研究使用临床上易于获取的基线资料、实验室数据和CT图像特征,来预估出现了胸腔积液的肺部病变患者罹患肺癌的风险大小,为良恶性胸腔积液诊断和是否需要进行进一步的侵入性检查提供依据。模型1对肺癌的识别能力优于模型2(P<0.05),决策曲线分析显示其临床应用价值也高于模型2,表明生物标志物与CT征象结合可以显著提高肺癌模型性能。而模型2可以为有胸腔穿刺禁忌证的患者提供参考。通过构建列线图实现了模型的可视化,对癌症发生概率进行个体化预测。另外,模型变量与既往研究已经证实对结局指标有影响的协变量一致[3,11],而且不需要额外的检测和成本。
胸腔积液生物标志物可以为了解积液的性质提供额外的信息,特别是对于细胞学检查阴性的病例。本研究结果显示,CEA在列线图中的权重较高,是肺癌较强的独立预测因子,而CYFRA21-1与CEA水平一直被认为与肺癌的诊断和转移密切相关,与既往研究一致[5,12]。A/G作为潜在变量被纳入到回归模型,可以反映胸腔积液中蛋白质组成的变化。影像学作为肺癌筛查的有效工具,是提高模型性能的另一个原因。从列线图可以看出,肿块最大直径是肺癌较强的客观预测因子,许多研究有相同的报道[3,10,13]。空气支气管征可用来鉴别肺癌、肺结核和肺炎,是恶性肿瘤的表现[14]。此外,血管穿行征提示癌性肿块可能性更高[15]。YANG等[16]发现分叶征与恶性肿瘤的高风险相关。放射学征象作为肺癌的危险因素对模型作出了贡献。本研究结果显示,肿瘤病史与肺癌的发生密切相关,与YANG等[16]的肺癌模型结果一致。
优势模型具有客观、可重复性和低侵入性的特点,这也正是多学科数据整合的优势所在。虽然本研究结果已初步显示出对伴有胸腔积液的肺癌的预测能力,但仍需要更大的样本量和多学科合作对模型进行优化。
近年来,随着基因组学、蛋白质组学和代谢组学的发展,更多灵敏的技术可以帮助预测肺癌的风险,例如基因测序、microRNA、液体活检及整合放射组学数据库等。然而,这些指标在临床上广泛应用之前,需要经过多阶段、大规模和长时间的临床试验及验证。为了推动个体化医学的发展,这些新方法需要与其他检测方式进行结合。模型也将在以后纳入更多先进的检测指标,使其性能进一步优化,提高对肺癌的诊断效率。
本研究有一定的局限性。首先,本研究较准确地预测了出现胸腔积液的肺癌病变,包括腺癌、鳞癌、小细胞肺癌等,但部分腺癌可以出现早期转移而没有胸腔积液。因此,模型适用范围包括出现胸腔积液的肺癌与出现胸腔积液的良性肺部病变之间的鉴别。其次,模型是基于回顾性研究的患者建立的,这些发现需要更大规模的、多中心的数据进行验证。最后,如果患者有胸腔穿刺绝对禁忌证,缺少胸腔积液生物标志物数据会限制优势模型1的使用,只能以模型2为替代。
本研究建立了一个新的基于胸腔积液生物标志物和CT征象的肺癌风险模型,能较准确地识别伴有胸腔积液的肺部病变的性质,并得到了验证,可以为良恶性胸腔积液的诊断及是否进行侵入性检查提供更准确的参考依据。

