基于陶瓷膜过滤工艺制备甘蔗红糖的多酚组成以及抗氧化研究
尚煜豪,侯楚璇,盖莉莉,谢彩锋,李 凯
(广西大学轻工与食品工程学院,广西南宁 530004)
甘蔗是我国重要的糖料作物,主要种植于广西、台湾等区域,其中广西占约63%,是国内名副其实的“糖罐子”[1]。红糖作为甘蔗的重要产品,其本质是非分蜜糖[2],因此极大程度保留甘蔗的天然成分[2–7],而这些成分在人体中又起到重要作用[8–12]。大量研究表明,红糖所具有的保护细胞[2]、免疫刺激[13]、抗病毒[14]、防龋齿[15]、抗氧化[16]、预防糖尿病[17]及高血压[18]等作用,主要是红糖中活性因子起主要作用,如多酚,黄酮类等[11]。
红糖抗氧化作用主要得益于红糖中活性因子,而活性因子含量主要受两个因素影响:甘蔗所含活性成分含量以及制糖工艺。在制糖工艺中,混合汁澄清工艺对红糖中活性因子的数量产生较大影响,目前国内外关于制糖过滤过程,主要分为三种,其一是利用化学试剂进行沉降,从而获得甘蔗清汁进行后续加工,其二为传统沸腾撇泡法,最后则是利用无机陶瓷膜[19–21]进行过滤,获得陶瓷膜过滤清汁(膜清汁)进行后续加工。相较于前两种方法,陶瓷膜过滤是物理过程,其将蔗汁通过无机陶瓷膜过滤系统实现蔗汁与杂质分离,有效取代传统工艺中澄清、分离等工艺中絮凝沉降、浓缩过滤等过程,由于其工艺不涉及化学试剂(除CaO),所得膜清汁也更加绿色安全,并且通过陶瓷膜过滤装置可以更多保留甘蔗中天然成分,因此用膜清汁生产出的红糖也更加健康。
目前传统红糖研究资料已经十分丰富,而应用无机陶瓷膜过滤技术所生产的红糖(膜法红糖),是一种新兴产品,该研究仍处于初级阶段,李文等[19]、曲睿晶等[20]、黄玭等[21]对陶瓷膜在糖业中的应用以及发展进行研究;Li等[22]以及Shi等[23]学者对陶瓷膜工业应用问题进行探索[22,23];Zhu等[24]将市售传统红糖与膜法红糖的营养成分以及抗氧化活性进行对比,发现膜法红糖的营养特性以及抗氧化活性要优于传统红糖[24]。本试验以广西南宁市扶绥县甘蔗双高基地的六种甘蔗(新台糖22、15-6015、贵南亚08-336、GUC15-2、GUC23-2、桂糖42)为原料,压榨取汁,经过陶瓷膜过滤系统[22–24]获取清汁(如图1所示),制得红糖[25]。并在此基础上对不同品种红糖多酚成分、含量以及抗氧化活性进行研究,以期为红糖专用型甘蔗的筛选以及甘蔗新产品开发提供一定的理论参考。
1 材料与方法
1.1 材料与仪器
甘蔗6种 分别为新台糖22(A)、15-6015(B)、贵南亚08-336(C)、GUC15-2(D)、GUC23-2(E)、桂糖42(F),选自广西扶绥市甘蔗双高基地,于2020年1月15日收割,压榨,澄清并制作红糖;二苯基苦基苯肼(DPPH)、2’-联氨-双-3-乙基苯并噻唑啉-6-磺酸(ABTS) 生物技术级,上海麦克林生化科技有限公司;甲醇 色谱纯,美国Fisher公司;没食子酸、芦丁 HPLC级,上海源叶生物科技有限公司;其余试剂 分析纯,上海国药集团化学试剂有限公司;50 nm陶瓷膜 南京工业大学膜科学与技术研究所。
RE-522AA旋转蒸发仪 上海亚荣生化仪器厂;YY-T1-10L超纯水仪 成都优越科技有限公司;TLE-204E分析天平 梅特勒-托利多中国有限公司;A-5082 Grodig连续波长多功能微孔检测器 奥地利Untersbergstr. 1A公司。
1.2 实验方法
1.2.1 红糖制备 收割样品甘蔗,进行压榨,获得混合汁,加入石灰乳调整混合汁pH至中性,静置后过滤,将过滤后的中性混合汁,加热并通过装有50 nm孔径陶瓷膜的无机陶瓷膜过滤装置进行过滤,获得膜清汁,在实验室利用敞口锅进行常压煮糖,获得六种红糖。工艺流程图如图1所示。
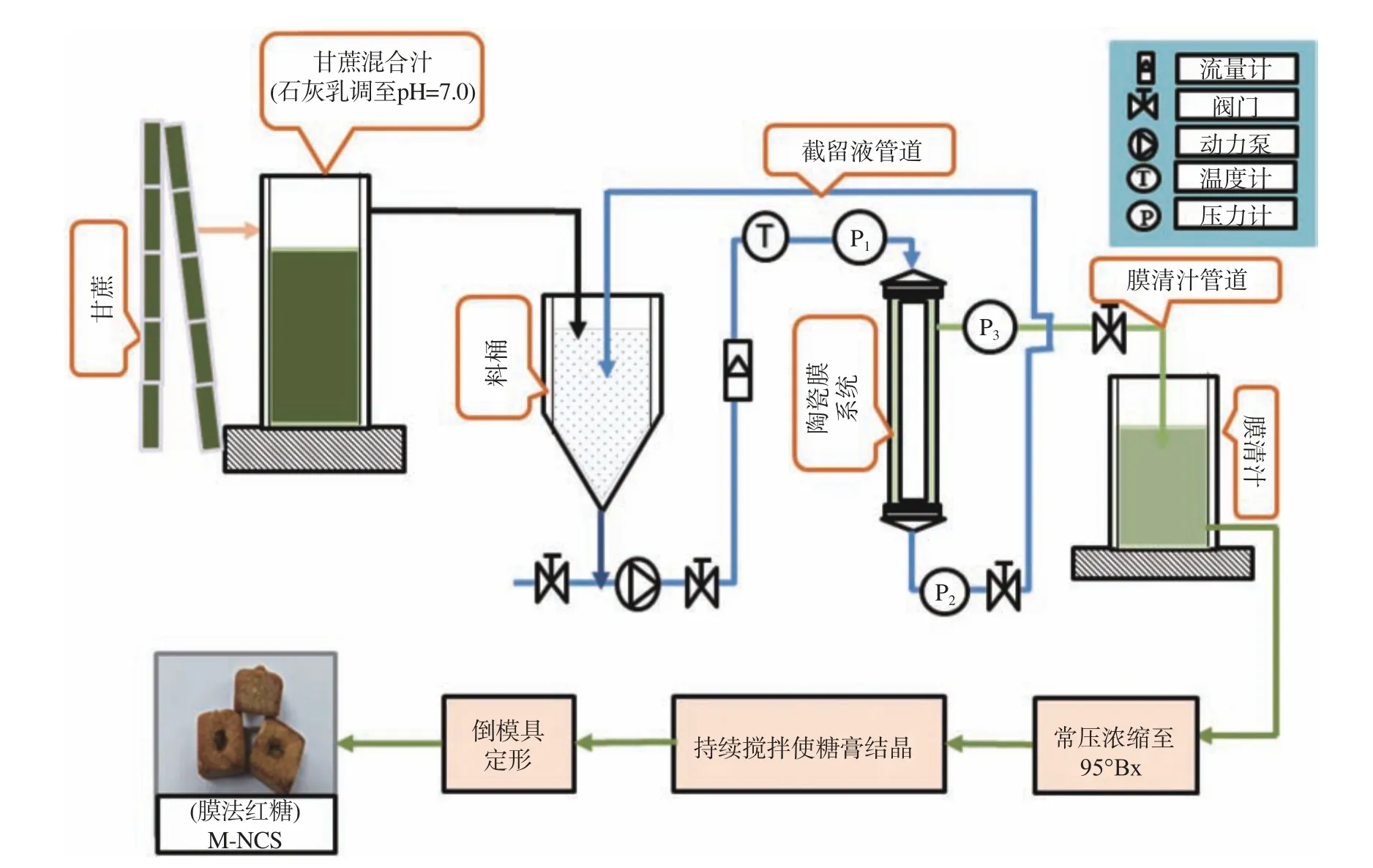
图 1 红糖制备工艺图Fig.1 Preparation process of non-centrifugal sugars(NCS)
1.2.2 红糖活性成分提取 红糖活性成分提取液制备,参考Chen等[26],并作出修改,具体实验过程如下。首先,取不同品种红糖(100±2)g,溶于200 mL的超纯水中。以6 mol/L盐酸调节溶液pH至2,使红糖水溶液中酚类物质处于分子态,便于进一步分离萃取,而后与等体积乙酸乙酯溶液均匀混合,静置0.5 h,萃取有机相,萃取三次,合并有机相。并用旋转蒸发仪在真空条件下,55 ℃去除乙酸乙酯,最后用甲醇定容至10 mL,保存至2~8 ℃冰箱。
1.2.3 红糖提取液总酚测定 红糖提取液总酚测定采用福林酚法,参照标准GB/T 31740.2-2015[27]和Asikin等[28]检测红糖提取液中总酚含量。具体实验过程为:取稀释20倍的红糖活性成分提取液1.00 mL或1.00 mL没食子酸溶液于比色管中,向比色管中加入5.00 mL10%的福林酚溶液,摇匀,并避光反应5 min,加4.00 mL 7.5%的碳酸钠溶液,避光反应1 h,在765 nm处,测定吸光度值。实验结果以 μg/g没食子酸当量表示。
1.2.4 红糖提取液总黄酮测定 红糖提取液总黄酮类测定采用硝酸盐法,参照Chen等[29]和Jia等[30]测定红糖中黄酮类含量,具体为:取30.00 μL红糖活性成分提取液或者芦丁溶液于比色管中,用60%乙醇定容至5.00 mL,向比色管中加入50 g/L亚硝酸钠1.00 mL,摇匀静置6 min,再加入100 g/L硝酸铝溶液1.50 mL,摇匀静置6 min,加入5 mol/L氢氧化钠溶液2.00 mL,然后摇匀静置15 min,在500 nm处测定吸光度值。测定结果以 μg/g芦丁当量表示。
1.2.5 红糖提取液单体酚测定 准确称取没食子酸、原儿茶酸、绿原酸等11中酚酸标准品,配制混合标准溶液,采用高效液相色谱(HPLC)对红糖提取液中单体酚进行鉴定,色谱条件如下:色谱柱:安捷伦C18反向柱;柱温:35 ℃;检测波长:280 nm;流速:0.8 mL/min;进样量:10.00 μL;流动相A:甲醇,流动相B:含1%冰乙酸的超纯水;采用梯度洗脱:0~6 min内洗脱剂为10%A和90%B,6~15 min内A溶液由10%升到15%,15~30 min内A溶液由15%升到20%,30~55 min内A溶液由20%升到25%,55~60 min内A溶液由25%降为10%。
1.2.6 红糖活性提取液自由基清除实验 实验采用DPPH自由基清除实验、ABTS自由基清除实验针对不同形式自由基而共同探究红糖抗氧化功能。
1.2.6.1 DPPH自由基清除能力检测 DPPH自由基清除能力的测定参考Payet等[31]方法,并稍作修改。配制0.1 mmol/L DPPH溶液,取400 μL DPPH溶液与50.00 μL提取液在试管中均匀混合,并添加无水乙醇稀释至3.00 mL,在室温下避光反应30 min,然后取各样品反应液250 μL于96孔板中,在515 nm下测定吸光度值,以等浓度抗坏血酸溶液作为阳性对照组进行实验。检测结果以EC50表示,见式(1)。

式中:A0空白样(无水乙醇)515 nm下吸光度值;Am样品515 nm下吸光度值。
1.2.6.2 ABTS自由基清除能力检测 ABTS自由基清除能力测定参考Payet等[31]方法,并稍作修改。配制7 mmo/L ABTS溶液以及2.45 mmol/L过硫酸钾溶液,将ABTS溶液与过硫酸钾溶液以1:2的体积比进行混合,并置于黑暗环境中反应12 h,得到ABTS自由基阳离子溶液。以磷酸盐缓冲液(pH7.34),稀释ABTS自由基阳离子溶液,直至其在734 nm处吸光度值在0.70±0.02。取500 μL稀释后的ABTS自由基阳离子溶液与300.00 μL提取液与试管中避光反应5 min,然后取样品各反应液250 μL于96孔板中,在734 nm处测定其吸光度值,以等浓度抗坏血酸溶液作为阳性对照组进行实验。检测结果以EC50表示,见式(2)。

式中:A0空白样734 nm下吸光度值;Am样品734 nm下吸光度值。
1.2.7 红糖活性提取液对亚铁与铜离子螯合能力检测
1.2.7.1 红糖活性提取液与亚铁离子螯合实验 红糖活性提取液与亚铁离子螯合实验参考Janio等[32]方法,并稍作修改,其具体过程为:取300.00 μL新配600.00 μmol/L硫酸亚铁溶液、300.00 μL柠檬酸盐缓冲溶液(pH5.4)、200.00 μL氯化钠溶液(0.9%)混于试管中,摇匀后加入50.00 μL稀释四倍的红糖活性提取液或者EDTA标准液溶液,反应5 min后加入30.00 μL邻菲啰啉溶液(0.35%),取各样品反应后的溶液250 μL到96孔板中,在507 nm处测定吸光度值,以等量EDTA溶液作为对照组进行实验。测定结果以 μg/mL EDTA当量表示。
1.2.7.2 红糖活性提取液与铜离子螯合实验 红糖活性提取液与铜离子螯合实验参考Santos等[32]方法,并稍作修改,其具体过程为:取100.00 μL红糖活性提取液或者EDTA标准液溶液与300.00 μL乙酸盐缓冲溶液(pH6.0)混于试管中,摇匀后加入100.00 μL硫酸铜溶液(100 mg/L),摇匀反应2 min后,加入30.00 μL邻苯二酚紫溶液(2 mmol/L),摇匀后静置10 min,取各样品反应后溶液250 μL于96孔板中,在632 nm处测定吸光度值,以等量EDTA溶液作为对照组进行实验。测定结果以 μg/mL EDTA当量表示。
1.3 数据处理
所有实验获得数值均表示为平均值±标准差;采用Origin2019进行绘图;采用SPSS数据统计软件(SPSS 23.0 SPSS Inc, Chicago,United States)进行统计分析。
2 结果与分析
2.1 不同品种红糖活性提取液总酚、总黄酮分析
2.1.1 不同品种红糖活性提取液总酚含量 根据没食子酸标液的浓度与吸光度值绘制标准曲线(Y=0.0066X−0.0037,R2=0.999),红糖总提取液中总酚含量如图2所示,不同品种红糖所含总酚存在一定差异。总酚含量为2846.21~4073.48 μg/g,其中A红糖总酚含量最高(4073.48±137.30 μg/g),其次为B、C、F、E、D,且其含量显著高于其他红糖(P<0.05);D和E红糖两者属于同一品系,但是两者多酚含量呈现出较大差异,同时两者总酚含量均低于其他品种,尤其D品种,其含量远小于A。通过以上对比分析,可以初步认为甘蔗品种不同是红糖总酚含量产生差异的主要原因;该研究结果同前人相似,同时Chen等[33]认为品种基因型的差异以及环境条件等因素是造成不同品种燕麦样品总酚含量差异的主要原因。

图 2 不同品种红糖的总酚含量Fig.2 Total phenolic contents of different varieties NCS
2.1.2 不同品种红糖活性提取液总黄酮含量 根据芦丁标液浓度与吸光度值绘制标准曲线(Y=0.0044X+0.0618,R2=0.9947),红糖提取液中总黄酮类含量如图3所示,除C品种外,其他五种红糖活性提取液的黄酮类含量均大于2000 μg/g,并且C总黄酮含量显著低于其他品种(P<0.05)。B中黄酮类含量最高(2438.63 μg/g),F中黄酮类含量次之,两者均大于2400 μg/g;而后依次为E、A、D、C。其中D和E两者属于同一品系,两者黄酮类含量同样具有一定差异,但其差距并没有像总酚,相差巨大;研究表明黄酮类属于多酚,因此两者具有相似官能团;而D和E两者黄酮类含量并没有表现出较大差异,说明两者存在一些共同成分,同时也拥有各自的特异成分,而这些差异性成分的存在可能导致了总酚含量和黄酮类含量的不同;从表1相关性分析可得,总酚和黄酮类两者确实存在相关性(P<0.05,R2=0.489),但是两者相关性并非很强。同时其他研究表明,酚类物质和黄酮类物质的相关性并非一直存在较高相关性,如蒋变玲等[34]在柑橘果皮活性物质以及抗氧化活性的研究中发现,总酚含量与黄酮类含量具有极高相关性,而李鹏程等[35]在其研究中却发现多酚类物质含量虽然也与黄酮类物存在相关性,但是其相关性并不是很好。这也说明,虽然酚类物质和黄酮类物质存在相关性,但是因为研究对象不同,两者相关性也产生相应变化。

图 3 不同品种红糖黄酮类含量Fig.3 Total flavonoid contents of different varieties NCS

图 4 甘蔗中酚酸形成机理Fig.4 Metabolism of phenolic compounds synthesis in sugarcane
2.1.3 不同品种红糖活性提取液单体酚组成及含量
通过HPLC法检测红糖提取液中多酚类物质含量以及种类,其结果见表2。从表2可得:红糖提取液多酚中存在11种含量较高的单体酚,其中儿茶素在这些样品中均未检出。在可检出单体酚中,没食子酸含量远高于其他(15327.70 μg/g),是红糖中最为丰富的单体酚,其次为丁香酸、对香豆酸、苯甲酸等。同时经过纵向对比可以发现,不同品种红糖提取液中,酚酸分布存在差异,如:B红糖提取液中丁香酸含量为(102.00±0.08)μg/g,而F红糖提取液中丁香酸含量则为(364.60±2.90)μg/g。
对比于福林酚比色法测定结果,可以发现福林酚比色法测定结果与HPLC法测定结果存在差异,在HPLC法测定结果中,C红糖提取液单体酚总含量最高,而在福林酚法测定结果中,A总酚含量最高。这可能是因为甘蔗基因型不同,其所能够特异性表达成分与含量也不同,如表2所示,红糖提取液中没食子酸含量远高于其他成分的含量,可以推断出没食子酸属于红糖的主要酚酸;但是不同品种红糖没食子酸含量存在较大差异,如C样品中没食子酸的含量要远大于其他样品;同时其他成分之间的存在相似差异,如F样品中丁香酸含量,E样品中香草酸含量等。基因型不同造成同一成分的不同表达,进而造成了红糖中总酚含量差异。对于福林酚比色法与色谱法测定结果的差异,目前众说纷纭,其中Payet等[31]认为提取物中非酚类物质与福林酚试剂发生反应,进而导致福林酚比色法测定的结果与色谱法结果产生差异。

表 1 抗氧化能力与总酚和总黄酮之间相关性分析Table 1 Correlation coefficient between antioxidantactivityand TPC and TFC
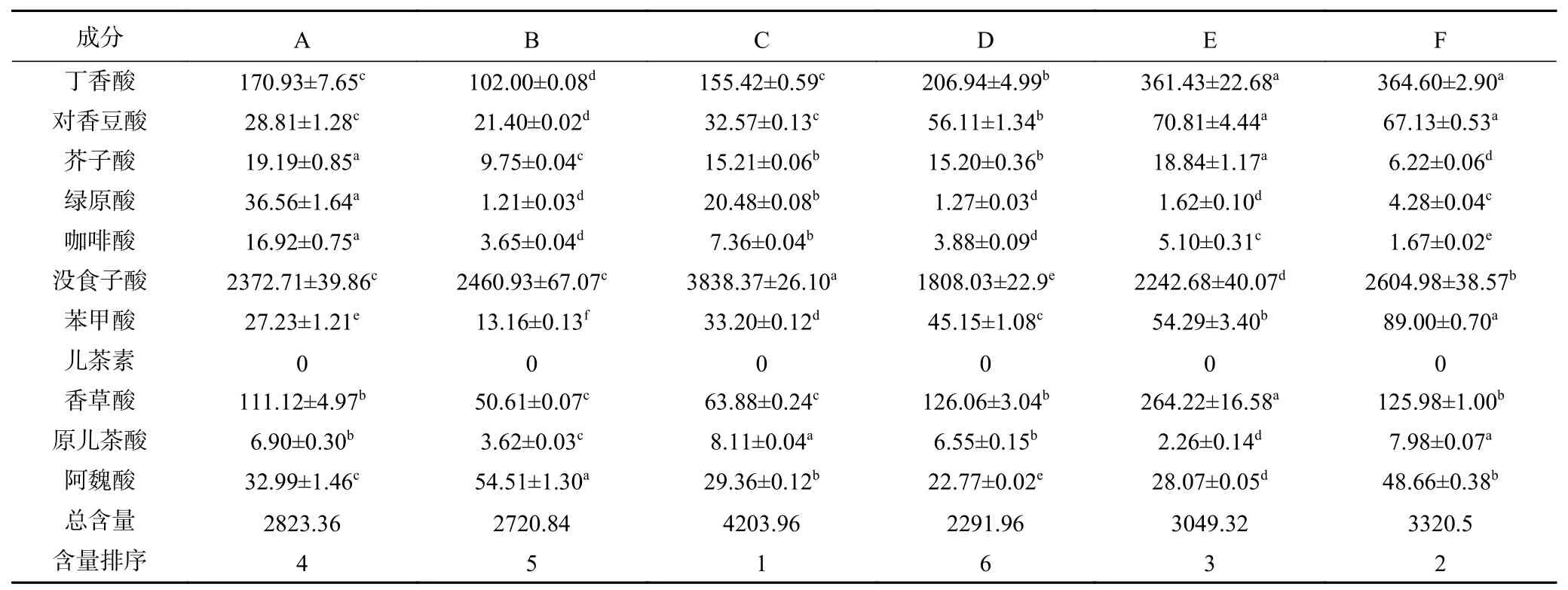
表 2 红糖上清提取液液质分析结果(μg/g)Table 2 Contents of polyphenols by LC-MS of NCS supernatant extracts(μg/g)
对比红糖总酚、总黄酮以及单体酚检测实验结果,不同品种红糖这些成分具有较大差异,这可能受两方面影响:甘蔗自身差异;加工过程中成分变化。甘蔗中多酚来源如图4所示,酚类物质是次级代谢产物,属于天然形成,其含量以及结构主要受基因型以及外在生长环境影响。本实验中所选用甘蔗,出自同一地区,其生长条件相仿,因此可以初步认为红糖多酚的变化主要是由基因型不同所引起;同时样品总酚测定结果的差异性进一步证明甘蔗品种对红糖多酚含量的影响。在甘蔗后处理形成清汁以及红糖的过程中,加工工艺也促使差异的产生,如混合汁预处理过程中所加入的石灰乳在热条件下能够促进混合汁中多糖形成具有三维网状结构的凝胶[36–38](其类似于囊状),对混合汁中一些多酚,如儿茶素、阿魏酸等,产生吸附作用[39−41],形成不可逆复合物,进而引起蔗汁中酚类物质减少;同时混合汁中蛋白质与多酚物质在氢键、共价键的作用下形成复合物[42−43],蛋白—多酚复合物在热力以及金属盐作用下,导致空间结构改变,形成不可逆的多酚—蛋白复合物。而后这些复合物在陶瓷膜过滤过程中被去除,进一步影响膜清汁中多酚含量,并使它们之间差异化加剧;而在煮糖过程中,多酚的氧化反应以及与氨基酸的反应,再次引起多酚含量变化以及单体酚结构转变,进而再次增大红糖中这些成分的差异。
2.2 不同品种红糖提取液自由基清除能力分析
2.2.1 DPPH自由基清除能力分析 DPPH自由基清除能力分析红糖DPPH自由基清除结果由EC50值表示,EC50值与清除能力成反比。由图5可知,D的EC50值最小(0.18 μmol/L),其显著低于其他品种(P<0.05),依次为C、E、F、A,B,尽管A、B和C的数值接近且它们之间并没有表现出显著相关,但B的EC50值最大(0.24 μmol/L)。因此D的DPPH自由基清除率最高,B的DPPH自由基清除率最低。同一品系D和E样品的DPPH自由基清除率存在较大差异(P<0.05),两者相差0.05 μmol/L,(D 0.18 μmol/L,E 0.23 μmol/L)。对比于对照组,样品EC50值均小于对照组,因此可以说明,红糖提取液具有较好的DPPH自由基清除能力。由表2相关性分析可得,DPPH自由基清除的能力与总酚含量以及黄酮类含量具有较高相关性(P<0.05,R12=−0.480,R22=−0.828),但是结合图2与图5可以发现,总酚含量高并不等同于自由基清除效果好,这说明,在提取物中并非所有物质都能起到清除自由基作用,该研究结果同Payet等[31]相似,该研究者认为,红糖提取物中其他物质(美拉德产物),如含氮或者含氧杂环类物质也能够影响自由基清除能力。

图 5 不同品种红糖DPPH自由基清除活性比较Fig.5 Comparison of the DPPH radical scavenging capacity of different varieties NCS
2.2.2 ABTS+自由基清除能力分析 由图6可知,红糖ABTS+自由基清除实验结果以EC50值进行表示。其中D的EC50值最小(0.40 mmol/L),其显著低于其他品种(P<0.05),依次为B、F、A、E、C,其中C和E的EC50值相接近,且两者没有显著性差异,但是C的EC50值最大(0.62 mmol/L),因此C样品ABTS+自由基清除率最低,而D样品ABTS+自由基清除率最高。属于同一品系的D和E样品ABTS+自由基清除率存在较大差异(P<0.05),两者相差0.21 mmol/L(D 0.40 mmol/L,E 0.61 mmol/L)。对比于对照组,样品EC50值均小于对照组,因此可以说明,红糖提取液具有较好的ABTS+自由基清除能力。由表2显著性相关性分析可得,ABTS+自由基清除的能力并没有像与DPPH自由基清除结果一样与总酚的含量以及黄酮类的含量具有较高相关性(P<0.05),这可能是因为,不同抗氧化体系作用机理不同,其所需的激活物也存在差异;ABTS+自由基清除实验的pH反应范围较为广泛,并且其反应也十分灵敏[10]。不同提取液中,酚类物质含量不同,因此反应体系pH也存在差异。

图 6 不同品种红糖ABTS+自由基清除活性比较Fig.6 Comparison of the ABTS+ radical scavenging capacity of different varieties NCS
2.3 亚铁离子和铜离子螯合能力分析
亚铁离子和铜离子属于诱发芬顿反应的金属离子,在人体内,芬顿反应产生过量自由基从而引起过度的氧化应激反应[9],导致一系列慢性疾病发生[10],天然螯合剂可以适当螯合体内诱导芬顿反应发生的元素,从而维持体内稳态平衡。因此研究红糖提取液与亚铁和铜离子螯合反应具有重要意义。
2.3.1 亚铁离子螯合能力分析 根据EDTA标液浓度与吸光度值绘制标准曲线(Y=−0.0051X=0.5998,R2=0.9913)。由图7可知,不同品种红糖提取液亚铁离子的螯合能力存在差异(P<0.05)。其波动范围为15.32~45.48 μg/mL,其中对亚铁离子螯合当量超过40 μg/mL的有两种,为C和D,其值分别为41.53±0.41 和45.48±0.48 μg/mL,两者均显著高于其他品种(P<0.05),且两者之间存在显著性差异(P<0.05);而B和F的值远低于其他样品(15.32±0.92 和18.84±0.40 μg/mL),且两者均显著低于其他品种(P<0.05)。其中D和E属于一个品系,但是两者却呈现出较大差异。对比于对照组,B、E和F样品亚铁离子螯合当量远小于对照组,因此说明该品种红糖提取液的亚铁离子螯合能力较弱;而A、C和D样品亚铁离子螯合当量接近与对照组,尤其是D样品,其值甚至大于对照组,因此说明D红糖提取液具有较强的亚铁离子螯合能力。根据表2相关性分析可得,红糖活性提取液亚铁离子螯合能力与红糖提取液总酚含量(P<0.05,R2=−0.497)、总黄酮含量均呈现出较强的相关性(P<0.01,R12=−0.768,R22=−0.739)。该研究结果同Santos等[32]一致,即酚类以及黄酮类物质是这些天然产物提取物产生抗氧化功能的主要物质。

图 7 不同品种红糖螯合亚铁离子能力比较Fig.7 Comparison offerous ion chelating ability of different varieties NCS
2.3.2 铜离子螯合能力分析 根据EDTA标液浓度与吸光度值绘制标准曲线(Y=−0.008X+0.2636,R2=0.9973)。由图8可知,不同品种红糖提取液铜离子螯合能力存在差异(P<0.05)。其波动范围为81.87~177.45 μg/mL,其中C样品效果最好(177.45±0.42 μg/mL),且其显著优于其他样品(P<0.05);A和D样品效果较差(94.58±1.99、81.87±0.17 μg/mL),两者均显著低于其他品种,但两者之间却存在显著性差异(P<0.05)。其中D和 E属于一个品系,但是两者呈现出较大差异,其值相差约67.42 μg/mL。对比于对照组,样品组铜离子螯合当量大于对照组,因此说明红糖提取液具有较强铜离子螯合能力。根据相关性分析可得(表2),红糖活性提取液铜离子的螯合能力与红糖总酚含量、黄酮类含量以及DPPH、ABTS自由基清除能力均呈现出较好的相关性(P<0.05)。该研究结果同Santos等[32]一致,即铜离子的螯合能力检测同其他抗氧化检测实验一样也具有较广的适用性;同时也进一步证明多酚类物质是天然产物抗氧化活性作用的重要物质。

图 8 不同品种红糖螯合铜离子能力比较Fig.8 Comparison of cupric ion chelating ability of different varieties NCS
在红糖提取液与亚铁离子和铜离子螯合实验中,可以发现不同品种红糖提取液对亚铁和铜离子的螯合能力表现出一定差异,这可能是由以下原因造成:不同红糖由于原料之间的差异,以及加工误差,所引起红糖中多酚类物质总含量就存在较大差异;根据HPLC结果可知,红糖提取液中,多酚种类以及含量确实存在较大差异,并且亚铁以及铜离子和多酚类物质间的螯合作用存在特异性,即并非所有的多酚都能与其发生螯合反应;多酚特异官能团不同,其对亚铁离子和铜离子所表现出的螯合能力也存在一定差异;在红糖提取液中存在非酚类以及非黄酮类成分,但其具有相似的官能团结构,进而影响实验结果[31,44−45]。
3 结论
本研究表明,不同品种甘蔗制备的红糖,其多酚含量、成分以及抗氧化活性均存在一定差异。在该条件下A(新台糖22)总酚含量最高,达4073.48 μg/g,B(15-6015)红糖总黄酮含量最高,达2438.63 μg/g,通过多种抗氧化方法测定,红糖确实具备较好的抗氧化能力。同时相关性分析表明,红糖多酚含量与其抗氧化活性具有较高相关性,表明红糖中多酚类物质是其能够发挥抗氧化作用的物质基础,同时结合不同红糖多酚类含量以及成分差异,也能初步认为甘蔗品种的差异是引起红糖活性物质差异的主要原因。
通过该研究初步确定甘蔗品种对红糖多酚成分、含量以及抗氧化活性产生重要影响,同时也能够确定多酚是影响不同红糖抗氧化特性差异的主要因素。因此,后续研究应该着重对不同品种甘蔗制备红糖的特异性成分进行分离研究,并进一步分析其与抗氧化活性构效关系,进一步推动甘蔗以及红糖扩展性研究。

