西瓜类甜蛋白家族全基因组鉴定及表达
陈 兵,杨钰雯
(江苏农林职业技术学院 信息工程学院,江苏 句容 212400)
病程相关蛋白(pathogenesis-related proteins,PRs)是寄主与病原物相互作用过程中诱导产生的一类蛋白,不仅在受侵染的组织中积累,在整个植株中都有表达[1]。目前已鉴定出17个不同的PRs家族,其中许多蛋白具有抗真菌活性[2]。PR5蛋白也称为类甜蛋白(thaumatin-like protein,TLP),是PRs中非常重要的蛋白之一。有研究证明,TLP不仅能诱导真菌细胞的程序性死亡,抑制真菌侵染;还能诱导植物细胞的程序性死亡,激活植物防卫反应信号途径,增强植物抗逆境能力。目前已经从番茄[3]、玉米[4]、小麦[5]、大豆[6]等多种植物中克隆到TLP基因。研究发现,植物基因组中TLP以基因家族的形式出现,如拟南芥[7]、水稻[7]、杨树[8-9]、芜菁[10]基因组中分别有28,31,55,20个TLPs基因。此外,具有抗逆功能的渗调蛋白(osmotin)和类渗调蛋白(OLP),以及permatin、zeamatin等也属于PR5家族[4]。
抗真菌活性是TLP的主要生理功能之一。其通过诱导孢子裂解、抑制孢子萌发、降低菌丝活力、消耗细胞膜势能等方式,抑制不同的致病和非致病真菌侵染。TLP的抗真菌功能可能与其具有β-1,3-葡聚糖酶活性有关[4]。也有研究认为,TLP和病原菌的互作与真菌特异质膜组成介导的信号传导有关[11]。Gómez-Casado等[12]研究发现,TLP与病原菌的菌体蛋白存在互作,链格孢菌的过敏性蛋白Alt a 1可以抑制PR5-TLP蛋白的酶活性。
西瓜是重要的经济作物之一,随着市场需求的增加,我国西瓜种植面积和总产量将继续保持稳中有升的发展趋势。枯萎病是严重制约西瓜生产的主要病害之一,为害严重时可造成西瓜减产80%以上甚至绝收。枯萎病是一类土传维管束系统病害,由尖镰孢菌西瓜专化型(Fusariumoxysporumf.sp.niveum)侵染引起。根据西瓜枯萎病菌对不同鉴别寄主的抗感反应,现已鉴定出4种尖镰孢菌西瓜专化型的生理小种(0,1,2和3)[13]。本课题组前期研究发现,枯萎病菌侵染后西瓜类甜蛋白的表达丰度显著升高,说明类甜蛋白可能在西瓜与枯萎病菌互作过程中发挥重要作用。在此基础上,本研究对西瓜类甜蛋白家族进行全基因组鉴定,利用生物学软件对其序列特征、蛋白结构和聚类进行分析,并利用实时荧光定量PCR技术检测其在西瓜不同组织和响应枯萎病菌侵染后的表达模式,旨在为进一步开展类甜蛋白家族基因的功能鉴定及其与枯萎病菌互作机制研究奠定基础。
1 材料与方法
1.1 植物材料
以8424西瓜为试验材料,在两叶一心期,取根、茎、叶组织用于TLP基因组织特异性表达分析。同时,采用灌根法接种西瓜枯萎病菌孢子液(浓度为1×106CFU/mL),分别于侵染后0,12,24,48,120,168 h 取根系组织。取样时随机选取3株混合。所有样品液氮速冻,置于-80 ℃ 超低温冰箱备用。
1.2 TLP家族成员鉴定及结构域分析
以拟南芥TLP蛋白和西瓜Cla97C01G003090和Cla97C10G188000序列为探针,在西瓜基因组数据库(http://cucurbitgenomics.org/)中搜索西瓜TLP同源序列。候选蛋白序列在 Pfam 数据库(http://pfam.xfam.org/)中对蛋白功能域进行确认。利用ProtParam(http://expasy.org/tools/protparam.html)在线分析氨基酸各种理化性质。利用TargetP-2.0 Server (http://www.cbs.dtu.dk/services/TargetP/)进行蛋白亚细胞定位预测。利 用 MEME (http://meme-suite.org/tools/meme)进行TLP蛋白的氨基酸序列保守基序(Motif)分析,基序搜索数目为6,其他参数为默认设置。用SignalP 5.0(http://www.cbs.dtu.dk/services/SignalP/)进行信号肽分析。
1.3 TLP家族启动子元件分析
从西瓜基因组数据库中获取西瓜TLP翻译起始位点(ATG)上游2 000 bp的启动子序列。利用 PlantCARE(http://bioinformatics.psb.ugent.be/webtools/ plantcare/html/)分析启动子反应调控元件,并利用 TBtools[14]软件对特定表达元件的数量开展聚类分析。
1.4 TLP系统进化分析
拟南芥TLP序列下载于TAIR网站(http://arabidopsis.org);水稻TLP序列来自水稻基因组数据库RGAP (http://rice.plantbiology.msu.edu/)。利用 Clustal X 2.1和GeneDoc软件,对拟南芥、水稻和西瓜TLP氨基酸序列进行同源性比对和序列分析。利用MEGA 5.05 软件构建系统进化树,采用邻接法(neighbor joining,NJ)作图,Bootstrap设置为1 000次,采用泊松校验(poisson correction)方法计算遗传距离。
1.5 TLP表达模式分析
取西瓜根系、茎、叶组织和枯萎病菌侵染不同时间的西瓜根系组织,分别采用RNApure Plant kit (with DNaseI)(CWBiotech,China)试剂盒提取其总RNA,使用BU-SuperScript RT Kit (Biouniquer,China)反转录试剂盒合成cDNA。以西瓜18S RNA为内参基因,用SuperReal PreMix (SYBR Green,TianGen,China)荧光定量PCR试剂盒在ABI PRISM7300 PCR系统中进行扩增。设置3次重复,采用2-ΔΔCt计算基因相对表达量[15],利用SPSS软件进行差异显著性分析。
2 结果与分析
2.1 ClTLP基因家族的鉴定
在西瓜响应枯萎病菌侵染的蛋白质组分析中,检测到2个类甜蛋白(Cla97C01G003090和Cla97C10G188000)的表达丰度显著升高(数据未发表)。以这2个类甜蛋白序列和拟南芥TLP蛋白序列为探针,在西瓜基因组数据库中搜索西瓜TLP同源序列,共鉴定得到28个ClTLP成员(表1)。
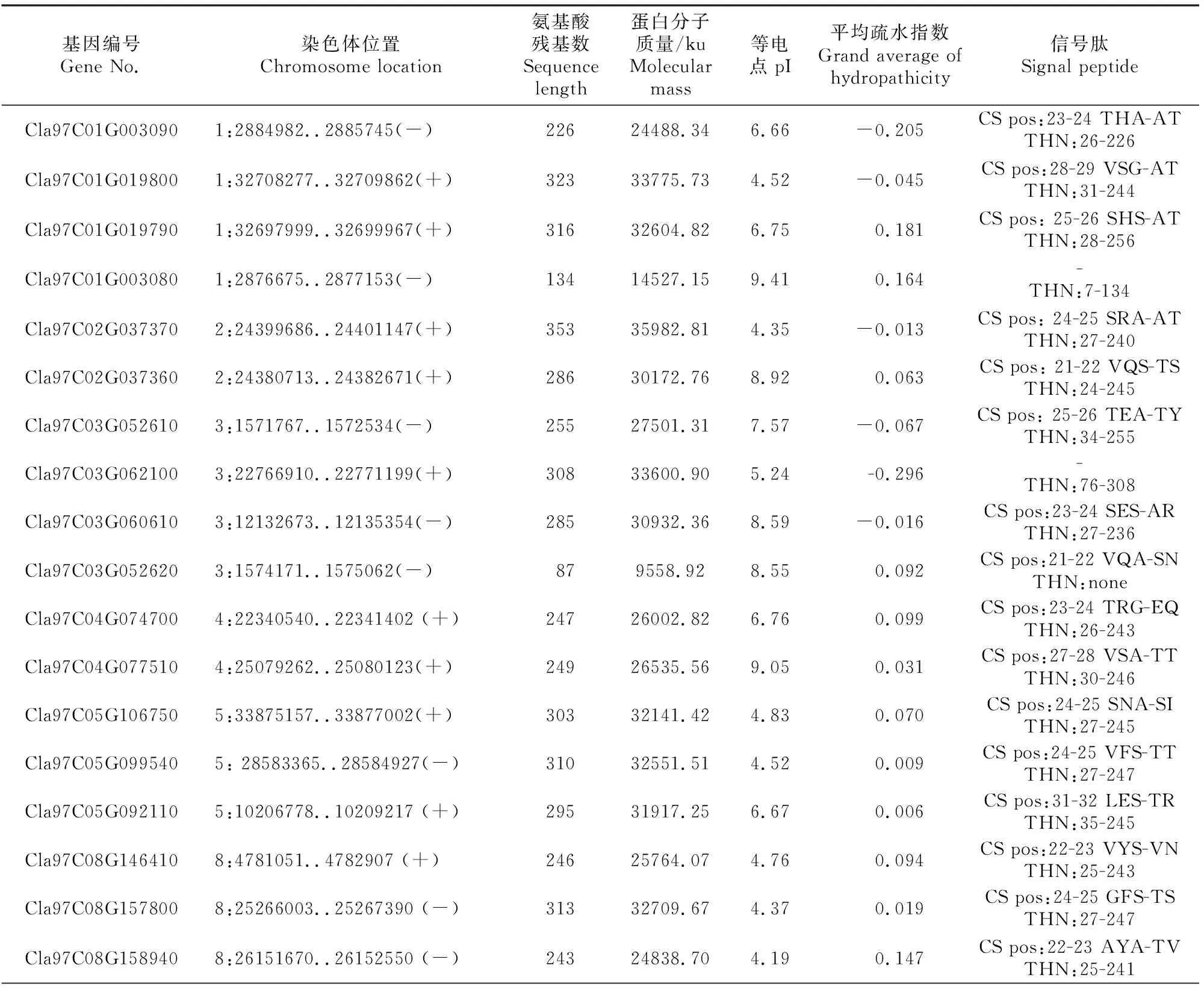
表1 28个ClTLP基因家族信息Table 1 Information of 28 ClTLP gene family in watermelon
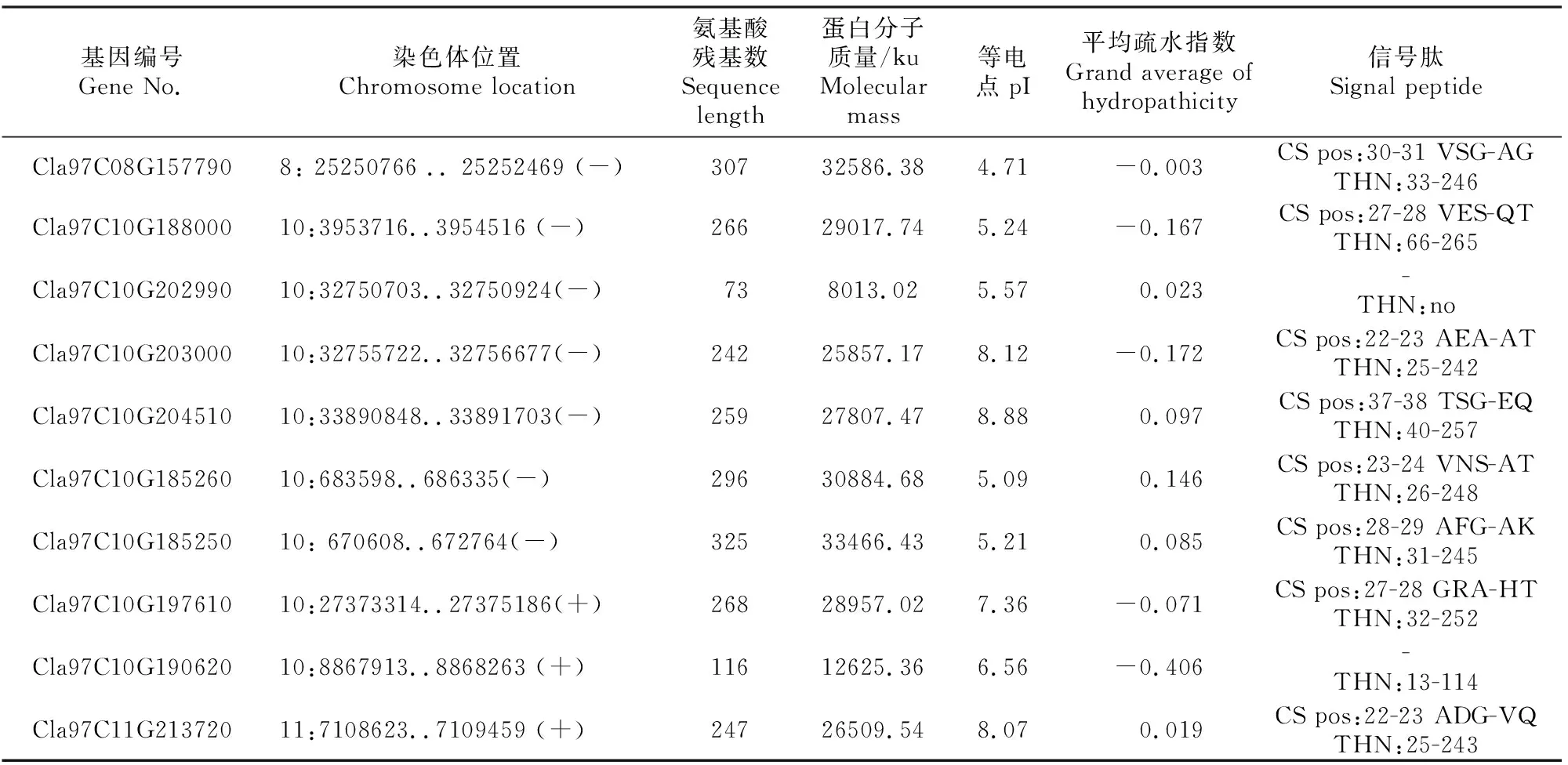
表1(续) Continued table 1
由表1可见,SMART(http://smart.embl-heidelberg.de/)结构域分析结果显示,除Cla97C03G-052620、Cla97C10G202990和Cla97C10G190620外,其余25个ClTLP家族成员均含有典型的索玛甜(THN)结构域。生理生化分析结果显示,ClTLP家族蛋白氨基酸残基数为73~353。蛋白等电点为4.35~9.41,酸性蛋白占64.3%,疏水性蛋白占60.7%。除6、7和9号染色体外,ClTLP家族基因在其余8对染色体上均有分布,其中8号染色体上基因成员最多(8个)。
2.2 ClTLP蛋白结构及聚类分析
对ClTLP家族基因蛋白结构的分析结果如图1所示。
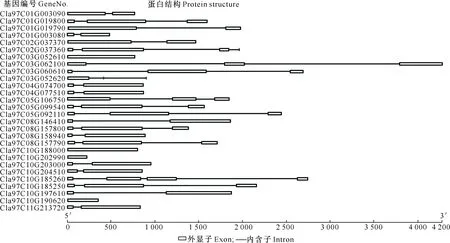
图1 28个ClTLP家族基因结构Fig.1 Gene structure of 28 ClTLP family in watermelon
由图1可知,该家族基因蛋白结构主要有4类,按其中内含子数量不同分为0,1,2,3等4类,对应基因数分别为4,12,10和2。对内含子的相位类型分析结果显示,在12个含有1个内含子的西瓜ClTLP成员中,有10个为1型相位,2个为2型相位;10个含有2个内含子的西瓜ClTLP成员中,8个属于1-2型相位,1个为1-1型相位,1个为2-0型相位;含有3个内含子的2个西瓜ClTLP成员分别为1-2-1型和1-1-0型相位。
对ClTLP家族基因编码蛋白保守氨基酸Motif分析结果(图2)显示,有6类Motif的保守性较强,分别为Motif 1(VACKSACEAFNTPEYCCSG-EYNNPNTCKPSSYSKIFKSACPKAYSYAYDD)、Motif 2(GGLDFYDVSLVDGYNLPMSVTP-TGGTGGC)、Motif 3(APPGWSGRFWGRTGCSFDSSG)、Motif 4(ATFTIVNNCPYTVWPGILSGA)、Motif 5(GAGGTPPATLAEFTL)和Motif 6(STGCAADLNGQCPSELRVKSG)。其中,Cla97C-01G003090和Cla97C10G188000含有除Motif 1以外的5个保守Motif。Cla97C01G003080、Cla97C03-G052620和Cla97C10G202990分别仅含有Motif 5、Motif 1和Motif 3。除上述5个ClTLP外,其余ClTLP家族成员均含有6个保守的Motif,说明西瓜ClTLP家族蛋白较保守。

图2 西瓜TLP保守氨基酸基序序列分布Fig.2 Positions of TLP conserved motif sequences in watermelon
为了解ClTLP蛋白与其他物种TLP蛋白的进化关系,根据Shatters等[16]和Guo等[17]对TLPs家族基因的分类原则,分别选取拟南芥和水稻各10个TLPs蛋白,与24个ClTLP(去除短链)构建系统进化树。由图3可见,本研究中选取的拟南芥和水稻的10个TLPs蛋白分别隶属于10个类群,与前人研究结果[19-20]一致,24个ClTLP也聚为10个类群。其中,类群Ⅰ含1个成员,类群Ⅱ含3个成员,类群Ⅲ、Ⅳ各含1个成员,类群Ⅴ含2个成员,类群Ⅵ含5个成员,类群Ⅶ和Ⅷ各含4个成员,类群Ⅸ含1个成员,类群X含2个成员。

Cl代表西瓜TLP序列,AT代表拟南芥TLP序列,Os代表水稻TLP序列;标尺为氨基酸置换概率Cl means watermelon TLP sequences,AT means Arabidopsis TLP sequences,Os means rice TLP sequences.The scale bar means changes of amino acid图3 ClTLP蛋白与拟南芥和水稻TLPs蛋白的系统进化树Fig.3 Phylogenetic tree among TLPs protein from watermelon (Citrullus lanatus),Arabidopsis thaliana and Oryza sativa
2.3 ClTLP家族基因启动子作用元件分析
对西瓜TLP家族基因上游2 000 bp启动子区顺式作用元件进行分析(图4)发现,所有成员启动子区均含有多个启动子增强元件(CAAT-box)。所有ClTLP家族基因均含有一个或多个激素响应元件,包括赤霉素响应元件(GARE-motif,P-box,TATC-box)、水杨酸响应元件(TCA-element)、脱落酸响应元件(ABRE)、生长素响应元件(AuxRR-core)和茉莉酸响应元件(TGACG-motif和CGTCA-motif)。同时,部分基因包含多个胁迫响应元件,包括干旱响应MYB结合位点MBS、机械损伤响应元件(WUN-motif)、光响应MYB结合位点MRE、低温响应元件(LTR)、类黄酮生物合成MYB结合位点MBSI和防御性响应元件(TC-rich repeats)。这些启动子作用元件在基因上的分布和数量不同,说明不同的基因可能参与不同的信号通路。
2.4 ClTLP家族基因表达分析
2.4.1 组织特异性表达 利用实时荧光定量PCR,分析ClTLPs家族基因在西瓜根、茎、叶器官中的表达模式。结果(图5)显示,除Cla97C10G204510和Cla97C10G185260在所有检测组织中都不表达外,其余26个CITLP基因在所有检测组织中均有表达,说明其为组成型表达基因。其中,Cla97C01G003090、Cla97C01G019790和Cla97C04G074700表达相对较弱,其余基因表达较强。Cla97C01G019800表达量在3个器官中相当,其余基因表达量在不同器官中各有不同,除Cla97C01G003090和Cla97C10G185250外,其余基因在根中表达量高于茎和叶。Cla97C01G003090基因在茎中表达量高于根和叶。ClTLP家族基因在叶中的表达量总体略低,仅Cla97C10G185250基因在叶片中表达量高于根和茎,而Cla97C01G019790在叶片中几乎不表达。

图4 西瓜TLP基因启动子顺式作用元件分析Fig.4 Analysis of putative cis-acting elements in upstream promoter region of TLP genes
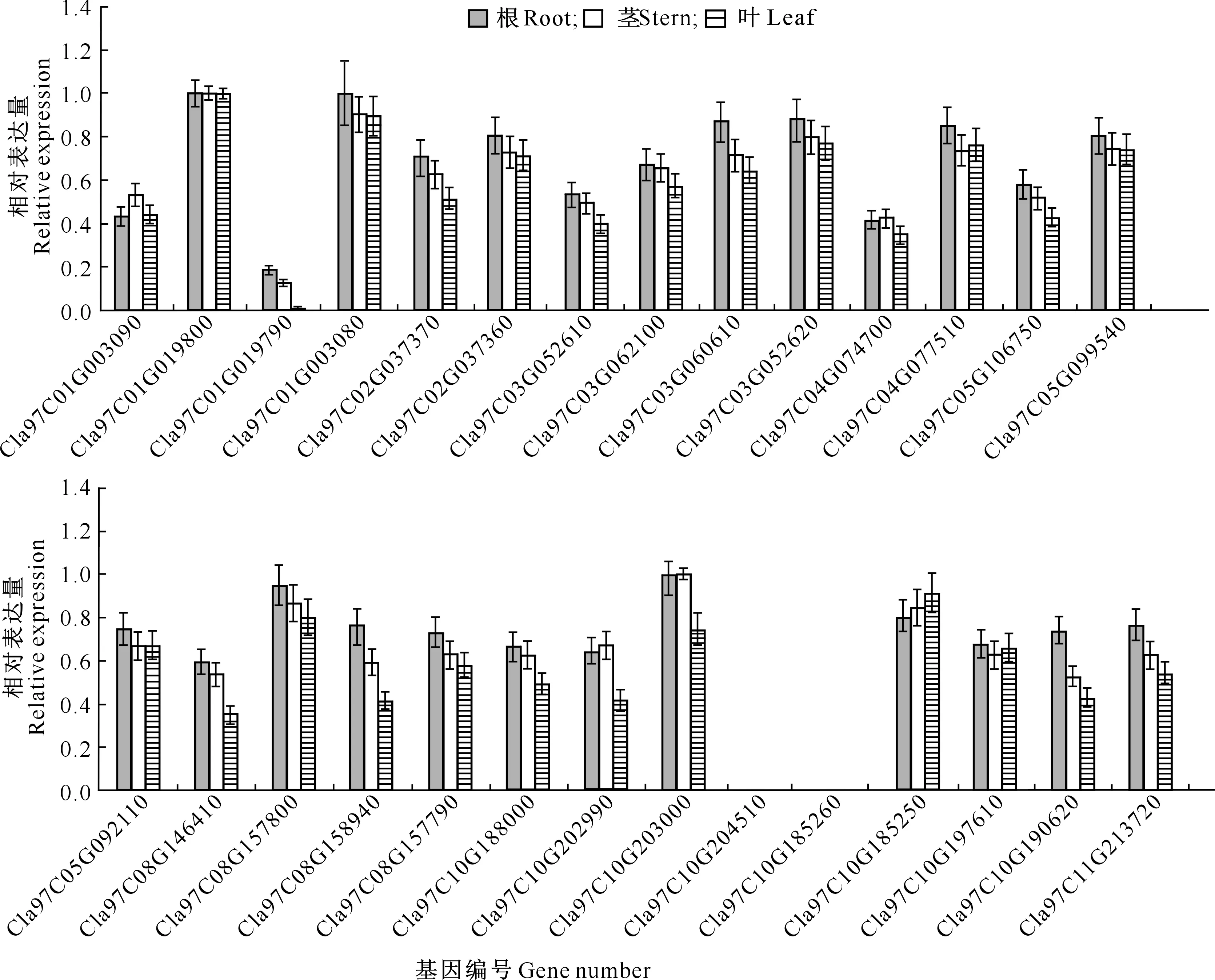
图5 CITLP基因在西瓜不同组织中的表达特异性Fig.5 Expression specificity of CITLP genes in different watermelon organs
2.4.2 枯萎病菌侵染的诱导表达 枯萎病菌侵染后,利用qRT-PCR分析ClTLPs基因的诱导表达模式。结果(图6)显示,与在组织表达中一致,Cla97C10G204510和Cla97C10G185260在枯萎病菌侵染后不表达,而其他基因的表达均受到枯萎病菌的诱导。其中,Cla97C01G019790和Cla97C10G-185250随着枯萎病菌侵染时间的延长,表达量逐渐升高,浸染168 h时达最高。Cla97C01G003080和Cla97C10G197610在枯萎病菌侵染前有微量表达,侵染12 h后表达被抑制,浸染24 h表达再次被诱导且达到峰值。此外,Cla97C10G188000、Cla97C10-G202990和Cla97C10G190620等3个基因表达在侵染后24 h达到高峰,而其他大部分基因表达量均在侵染后120 h达到峰值。

图6 ClTLP家族基因在西瓜与枯萎病菌互作过程中的表达分析Fig.6 Expression of ClTLP gene in interaction of watermelon and Fusarium oxysporum
3 讨 论
病程相关蛋白5家族在植物生长发育和胁迫应答过程中发挥重要作用。TLP为多基因家族,在拟南芥中有28个、水稻中44个、杨树中55个。研究证明,基因家族数目可能与基因组进化中染色体的重组事件或植株生长过程中的环境胁迫有关。本研究基于前期西瓜从枯萎病菌互作的蛋白组中挖掘到的高丰度表达类甜蛋白,进行西瓜全基因组分析鉴定,获得了28个西瓜TLP序列;并对其进行了生物信息学分析,采用实时荧光定量 PCR技术对各基因在不同组织器官及枯萎病菌侵染后的表达进行了分析。
本研究通过序列分析发现,西瓜TLP家族成员分布在8条染色体上,且各染色体上的数目不同。其中10号染色体上分布有8个成员,3号和8号染色体上则各有4个成员,说明基因存在集中分布现象。这可能与西瓜基因组的全基因组复制事件有关[18]。西瓜TLP基因有4种结构类型和7种不同的内含子相位,类型较为丰富,说明西瓜TLP在复制时易发生可变剪切。内含子相位相同的基因可能来源于共同祖先,也可能是染色体内或染色体间复制扩张的结果,本研究与对水稻TLP的分析结果[19]一致。
本研究的系统聚类分析结果显示,西瓜TLP蛋白分为10个聚类群,与已报道的拟南芥[20]、杨树[17]和水稻[19]结果一致,说明西瓜TLP蛋白有较强的保守性。有研究指出,TLP聚类分析中每个聚类群组功能各不相同,其中群组V成员最多,且与植物应答病原菌胁迫有关[4,20]。本研究中,聚类群组Ⅵ中西瓜TLP数量最多,说明该组基因由于具有相同的生物学活性,而导致了基因的复制扩张[17]。聚类群组Ⅴ中仅含有2个基因(Cla97C01G003090和Cla97C10G188000),其是否参与西瓜响应病原菌胁迫需进一步验证。本研究中西瓜TLP在10个聚类群中均有分布,也说明了其功能的多样性。同时,在西瓜TLP家族基因启动子区发现了多个与激素和胁迫响应相关的顺式作用元件,进一步说明了其功能的复杂性,预示其在西瓜生长发育和胁迫应答过程中可能具有重要作用。
前人研究结果显示,TLP基因在植物不同组织器官中表现为组成型表达,且表达活性不尽相同[21]。本研究中,大部分西瓜TLP基因在根中的表达量最高,该结果与大豆[6]和水稻[18]中的多个TLP基因表达结果类似,说明这些基因可能在根系生长发育或根系响应胁迫应答中发挥作用。本研究中,Cla97C01G019800在所有器官中均有较强表达,说明其可能参与了西瓜整个生长过程,该结果与辣椒Capana00g000465[18]的表达结果一致。大多数ClTLP家族基因在叶片中表达量较低,仅Cla97C10G185250基因在叶片中高表达,说明该基因可能参与叶片的生长发育或胁迫应答。另外,大量研究表明,不同植物中的TLP过表达均提高了转基因植株的抗真菌能力。在香蕉中高效表达水稻TLP能够提高香蕉对4号枯萎病菌的抗性[22]。Zamani等[23]将黑麦TLP基因转入油菜中,增强了油菜对菌核病菌(Sclerotiniasclerotiorum)的抗性。在土豆中过量表达茶树CsTLP基因提高了土豆对甘薯炭腐病菌(M.phaseolina)和晚疫病菌(P.infestans)的抗性[24]。本研究中,枯萎病菌侵染可以诱导大部分西瓜TLP基因的表达。聚类群组V中的2个基因表达各不相同,Cla97C10G188000表达量在侵染后24 h最高,推测该基因可能参与西瓜抗枯萎病菌的早期响应;Cla97C01G003090表达在侵染后120 h达到峰值。另外,随着枯萎病菌的侵染,Cla97C01G019790和Cla97C10G185250 两个基因表达量逐渐升高,推测其在西瓜抗枯萎病菌侵染的整个过程中都发挥作用,下一步将重点对这几个基因的功能进行研究。

