光照处理对发芽燕麦中多酚类物质含量及抗氧化活性的影响
邓佳琪,李娟娟,贺馨怡,陈东方,b,黄师荣,陶能国
(湘潭大学 a化工学院,b化学工程与技术博士后流动站,湖南 湘潭 411105)
燕麦含有丰富的碳水化合物、均衡蛋白质、必需脂肪酸、维生素等营养成分,被营养学家称作“全价营养食品”,长期食用具有降血脂、降胆固醇、预防和改善心血管疾病等潜在功效[1]。发芽作为一种安全无害、低成本处理手段,在提升种子的营养价值和食用性方面具有悠久历史,豆芽和大麦芽就是最好的例证。已有研究发现,发芽处理能增加燕麦中维生素、矿物质等营养成分含量[2-3],提高其消化率和生物利用率[4-5],改善其营养价值[6-7],提高生物活性成分(如多酚)的含量[8-9]。因此发芽能有效提高燕麦制品的营养和功能价值。
光照是影响植物生长代谢的重要环境因子之一,除了能够控制光合作用外,还影响着植物中诸多生物活性物质(如多酚、黄酮)的积累[10-12]。虽然关于光照对植物的影响已经有了一些研究,如暴露于发光二极管(LED)下可以增加豌豆幼苗的抗氧化活性[11]和荞麦芽中的黄酮含量[12]。光照能够诱导植物组织中黄酮类化合物的积累,光照条件下三叶青愈伤组织黄酮类化合物的含量是黑暗条件下的1.5~2倍[13]。光照处理的发芽甜玉米中总多酚、总黄酮含量均高于黑暗处理[11]。但光照对不同特性植物的影响还缺乏深入研究,而且关于光照处理对发芽燕麦中酚类化合物及其抗氧化活性的影响还鲜有报道。本试验研究了光照和黑暗处理下燕麦中游离态和结合态多酚、黄酮及其醇提物抗氧化活性在发芽过程中的动态变化,并分析了光照和黑暗处理对发芽燕麦中主要酚酸组分的影响,旨在为光照处理在发芽燕麦中的应用以及后续燕麦的高质化利用提供理论依据。
1 材料与方法
1.1 材料与试剂
燕麦种子(发芽率95%以上),购于河北张家口。
肉桂酸、阿魏酸、没食子酸、对香豆酸、咖啡酸、芦丁,阿拉丁试剂(上海)有限公司;Folin-Ciocalteu试剂,合肥博美生物公司;2,2-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)、1,1-二苯基-2-三硝基苯肼(DPPH)、水溶性维生素E(Trolox),美国Sigma公司;甲醇,色谱纯级,天津科密欧化学试剂有限公司;其余试剂均为国药集团化学试剂有限公司的分析纯级试剂。
1.2 仪器与设备
GZX-250E光照培养箱、FW100高速粉碎机,天津市泰斯特仪器有限公司;Cary 60紫外-可见分光光度计,安捷伦科技(中国)有限公司;W201B旋转蒸发仪,上海申生科技有限公司;LC-20A高效液相色谱仪,日本岛津公司;LabogenecooLSafe1104真空冷冻干燥机,Labogene公司;KQ5200DE数控超声波清洗器,昆山市超声仪器有限公司;GL21M冷冻离心机,长沙英泰仪器有限公司。
1.3 方 法
1.3.1 发芽燕麦的制备 将经挑选除杂后干燥的燕麦籽粒(Y0)分为光照组和黑暗组,均用20 g/L次氯酸钠溶液浸泡30 s消毒,再用蒸馏水反复冲洗干净,在20 ℃下用去离子水浸泡24 h。浸泡结束后取部分样品记作J0,剩下的燕麦颗粒沥干水分平铺于2层湿的无菌纱布上,光照组置于20 ℃、相对湿度95%、光照强度为200 μmol/(m2·s)的光照培养箱中进行发芽;黑暗组置于同一培养箱中进行发芽,并在发芽盘上方覆盖铝箔纸进行避光处理。光照和黑暗组均在发芽24,48,72和96 h时取样(G1~G4)。Y0、J0、G1~G4取样后样品立即进行冷冻干燥保存。所有冷冻干燥后的样品经高速粉碎机粉碎后过孔径0.18 mm(80目)筛,-20 ℃下贮存,备用。
1.3.2 多酚的提取 参考Irakli等[14]的方法提取样品中的游离态多酚。称取上述制备好的燕麦粉2.0 g置于离心管中,加入30 mL体积分数80%的乙醇溶液,在20 ℃下超声(功率200 W)提取20 min,4 000 r/min离心10 min,收集上清液,每个样品提取3次,合并各次所得上清液,于45 ℃下真空旋转蒸发至干,甲醇溶解定容至5 mL,-80 ℃下贮存备用。结合态多酚的提取:向游离态多酚提取后剩余的残渣中,加入100 mL 2 mol/L NaOH溶液,置于25 ℃摇床振荡水浴1 h,然后用6 mol/L盐酸酸化至pH 2~3,加入100 mL乙酸乙酯进行萃取,每个样品萃取3次,合并上层液体并于45 ℃下真空旋转蒸发至干,用甲醇定容至5 mL,-80 ℃下贮存备用。
1.3.3 多酚含量测定 采用Folin-Ciocalteu法[15]测定样品中的多酚含量。分别取100 μL样液于2.5 mL离心管中,加入0.5 mL Folin-Ciocalteau试剂(10倍稀释)混合均匀,在5 min内加入0.8 mL 75 g/L Na2CO3溶液后混匀,在25 ℃避光放置30 min后,在波长为765 nm下测定吸光度(OD765)。用没食子酸(GA)构建标准曲线(GA质量浓度:0,50,100,150,200,250 μg/mL)。根据标准曲线计算多酚含量,结果以每克(以干质量计)燕麦粉中所含没食子酸的当量表示,单位为μg/g。
1.3.4 黄酮含量测定 参照Do等[16]的方法测定样品中的黄酮含量。吸取2 mL提取液于10 mL试管中,加入0.3 mL 50 g/L亚硝酸钠摇匀放置5 min,加0.3 mL 100 g/L硝酸铝溶液摇匀放置5 min,再加4 mL 40 g/L氢氧化钠溶液摇匀,用蒸馏水定容后于60 ℃水浴10 min,冷却后在380 nm下测吸光度(OD380)。用芦丁(0,100,200,300,400,500,600 μg/mL)构建标准曲线。根据标准曲线计算黄酮含量,结果以每克(以干质量计)燕麦粉中所含芦丁的当量表示,单位为μg/g。
1.3.5 酚酸组分含量测定 本研究选取肉桂酸、没食子酸、咖啡酸、阿魏酸和对香豆酸5种酚酸作为目标物质,参考文献[17],采用高效液相色谱法对光照和黑暗2种处理下样品中的目标酚酸进行定性定量分析。色谱柱:C18柱(5 μm,250 mm×4.6 mm),PDA检测器;流动相为超纯水(磷酸调 pH 2.6)(A相)和甲醇(B相);流速0.8 mL/min;检测波长280和320 nm;柱温30 ℃;进样量15 μL。采用梯度洗脱,洗脱程序:0-15 min,15%~25% B;15-25 min,25% B;25-55 min,25%~65% B;55-60 min,65%~15% B;65 min,15% B。根据肉桂酸、阿魏酸、没食子酸、对香豆酸、咖啡酸标准品的保留时间和紫外光谱图对酚酸组分进行定性分析;根据峰面积对酚酸进行定量分析,单位为μg/g。
1.3.6 抗氧化活性测定 (1) 2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)自由基清除能力的测定。取10 mL 7 mmol/L的ABTS溶液与5 mL 7.35 mmol/L K2S2O8溶液混合后在室温下避光放置16 h形成ABTS+·储备液,使用前用无水乙醇稀释成在734 nm波长处的吸光度为(0.70±0.005)的工作液。标准曲线的制作[18]:将2 000 μmol/L Trolox标准储备液稀释成400,800,1 000,1 200,1 600 μmol/L的系列标准溶液,取各标准液200 μL与8 mL ABTS+·工作液充分混合均匀,于25 ℃水浴中避光反应30 min,用分光光度计(蒸馏水调零)于波长734 nm处测吸光度。用样品代替标准液进行测定,根据标准曲线计算样品的ABTS自由基清除能力,结果以每克(以干质量计)燕麦粉中所含Trolox的当量表示,单位为μmol/g。
(2)1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除能力的测定。标准曲线制作[19]:将2 000 μmol/L Trolox标准储备液稀释成50,100,150,200,250 μmol/L的标准溶液,取各标准液2 mL与0.3 mL 0.6 mmol/L DPPH无水乙醇溶液混合,摇匀后于25 ℃水浴中避光反应30 min,用分光光度计(无水乙醇调零)于波长517 nm处测吸光度。用样品代替标准液进行测定,根据标准曲线计算样品的DPPH自由基清除能力,结果以每克(以干质量计)燕麦粉中所含Trolox的当量表示,单位为μmol/g 。
(3)铁还原能力测定。 标准曲线制作[20]:将2 000 μmol/L Trolox标准储备液稀释成200,400,800,1 200,1 600 μmol/L的系列标准溶液,取各标准液1 mL与1 mL pH 6.6的PBS、1 mL 0.03 mol/L铁氰化钾溶液充分混匀,50 ℃下水浴20 min后快速冷却,加1 mL 100 g/L三氯乙酸混匀,3 000 r/min离心10 min,取上清液1 mL,加入1 mL 1 g/L三氯化铁溶液反应10 min,于波长700 nm处测定吸光度。用样品代替标准液进行测定,根据标准曲线计算样品的铁还原能力,结果以每克(以干质量计)燕麦粉中所含Trolox的当量表示,单位为μmol/g。
1.4 数据处理
所有试验均独立进行3次。试验结果以“平均值±标准差”表示。采用SPSS 13.0软件对数据进行显著性分析,并对光照和黑暗处理下发芽燕麦中游离态和结合态多酚、黄酮含量与3种抗氧化指标间的关系进行相关性分析。
2 结果与分析
2.1 光照处理对发芽燕麦中多酚含量的影响
光照和黑暗处理对发芽燕麦中游离态和结合态多酚含量的影响见图1。由图1可知,光照和黑暗组样品中的游离态、结合态多酚含量均呈现先降低再升高的趋势。2种处理样品多酚含量的降低均主要出现在浸泡阶段,这一方面可能因为种子浸泡过程中组织结构变软,使得一部分酚类物质释放溶解到水中;另一方面可能是浸泡过程中多酚氧化酶的活性增强,使得一部分酚类物质被氧化从而使其含量降低[21]。在浸泡后的发芽过程中,2种处理样品中游离态、结合态多酚的含量均随发芽时间的延长而升高。与Y0相比,光照组G4游离态多酚增加了45.6%,结合态多酚增加了47.7%,差异均达显著水平(P<0.05);黑暗组G4游离态多酚增加了31.4%,结合态多酚增加了30.8%,差异也均达显著水平(P<0.05)。由此可见,相较于黑暗组,光照处理更能促进发芽燕麦中游离态和结合态多酚的积累。
2.2 光照处理对发芽燕麦中黄酮含量的影响
光照和黑暗处理下燕麦发芽过程中黄酮含量变化见图2。

图1 光照和黑暗处理燕麦发芽过程中多酚含量的变化Fig.1 Changes of polyphenol content in oat during germination under light and dark treatments

图2 光照和黑暗处理发芽过程中燕麦黄酮含量的变化Fig.2 Changes in flavonoid content of oats during germination under light and dark treatments
由图2可知,随着发芽时间的延长(G1~G4),光照组游离态黄酮含量呈先增加后降低的趋势,而黑暗组游离态黄酮含量呈下降趋势;光照和黑暗组样品中的结合态黄酮含量均呈增加趋势。结果表明,在浸泡后的发芽过程中(G1~G4),结合态黄酮的含量明显增加,游离态黄酮有降低趋势,推测游离态和结合态黄酮之间可能存在一定转化[22]。光照组除了发芽初期(G1)游离态黄酮含量低于黑暗组外,其余阶段(G2~G4)均明显高于黑暗组;光照组结合态黄酮含量在整个发芽阶段(G1~G4)均明显高于黑暗组。总体而言,光照组游离态、结合态黄酮含量高于黑暗组。
2.3 光照处理对发芽燕麦中酚酸组分的影响
光照和黑暗处理对发芽燕麦中游离态、结合态多酚提取物中5种目标酚酸(肉桂酸,没食子酸,咖啡酸,阿魏酸和对香豆酸)含量的影响分别如表1和表2所示。

表1 光照和黑暗处理发芽燕麦游离态多酚提取物中各酚酸组分含量Table 1 Contents of phenolic acids in free polyphenol extracts of sprouted oats under light and dark μg/g
由表1可知,2种处理的没食子酸、对香豆酸、阿魏酸和肉桂酸含量在浸泡阶段(J0)显著下降,发芽初期(G1)有所回升,但随着发芽时间的延长(G2~G4)又显著下降(P<0.05);咖啡酸含量在浸泡阶段有所增加,且黑暗处理样品在发芽初期(G1)较浸泡阶段(J0)略微降低,其余阶段变化趋势与其他酚酸一致。比较光照和黑暗2种处理可知,游离态多酚提取物中,光照组样中没食子酸、咖啡酸、阿魏酸含量在发芽过程中总体高于黑暗组,对香豆酸和肉桂酸的含量总体低于黑暗组;5种酚酸的总量在发芽前期(G1~G2)光照组略低于黑暗组,发芽后期(G3~G4)光照组显著高于黑暗组。2种处理下,发芽阶段(G1~G4)酚酸总量呈持续下降趋势,这与上文游离态多酚含量呈上升趋势的结果不一致,表明除了本研究检测的5种酚酸外,还存在其他未检测的多酚组分对光照和黑暗处理有所响应。
由表2可知,对于结合态多酚提取物中的酚酸而言,没食子酸、咖啡酸、对香豆酸和阿魏酸的含量在光照和黑暗处理样品中均呈现先降低后增加的趋势,与上文中结合态多酚含量的变化趋势基本一致,表明这4种酚酸对结合态多酚含量的变化具有重要贡献;肉桂酸含量一直呈下降的趋势。在整个发芽阶段(G1~G4),没食子酸、咖啡酸、对香豆酸和阿魏酸的含量均表现为光照组显著高于黑暗组(P<0.05),肉桂酸含量则恰好相反;整个发芽阶段5种酚酸总量表现为光照组显著高于对照组,与上文结合态多酚含量的结果一致。结果表明,与黑暗处理相比,光照处理能显著提高发芽燕麦结合态多酚提取物中没食子酸、咖啡酸、对香豆酸和阿魏酸含量。

表2 光照和黑暗处理发芽燕麦结合态多酚提取物中各酚酸组分含量Table 2 Contents of phenolic acids in combined polyphenol extracts of sprouted oats under light and dark μg/g
2.4 光照处理对发芽燕麦醇提取物抗氧化活性的影响
光照和黑暗处理下发芽燕麦中游离态和结合态多酚提取物的抗氧化能力变化规律如图3所示。由图3可知,2种处理下游离态和结合态多酚提取物清除DPPH自由基的能力和铁还原能力均呈先下降后上升趋势,这与前文多酚含量的变化趋势基本一致。2种处理下游离态和结合态多酚提取物清除ABTS自由基的能力均在浸泡阶段呈下降趋势,发芽阶段呈上升趋势,其中光照组在发芽初期(G1)达到最大值后趋于平稳,黑暗组则呈缓慢上升趋势。在浸泡后的发芽过程中,游离态和结合态多酚提取物清除ABTS、DPPH自由基和铁还原能力均表现为光照组高于黑暗组。结果表明,与黑暗处理相比,光照处理能明显提高发芽燕麦多醇提取物的抗氧化活性。
2.5 多酚、黄酮含量与抗氧化能力的相关性
由表3可知,光照处理下,除游离态黄酮含量与ABTS自由基清除能力呈负相关外,多酚、结合态黄酮与抗氧化指标均呈正相关,其中游离态多酚含量与DPPH自由基清除能力、铁还原能力分别呈显著和极显著正相关,结合态多酚、黄酮与铁还原能力分别呈极显著和显著正相关。黑暗处理下,除游离态黄酮含量与3个抗氧化指标呈负相关之外,多酚、结合态黄酮均与抗氧化指标呈正相关,其中结合态多酚含量与DPPH自由基清除能力、铁还原能力分别呈显著和极显著正相关,结合态黄酮含量与ABTS、DPPH自由基清除能力呈显著正相关(P<0.05)。结果表明,光照和黑暗处理下,除游离态黄酮外,发芽燕麦中的多酚、结合态黄酮均与其抗氧化活性呈显著正相关。

图3 光照和黑暗处理下发芽燕麦游离态和结合态多酚提取物的抗氧化能力Fig.3 Antioxidant capacities of sprouted oats under light and dark treatments
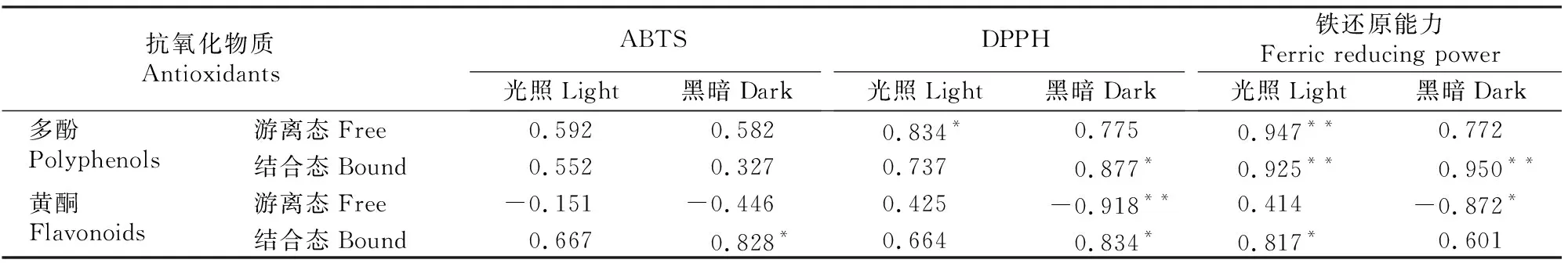
表3 光照与黑暗处理下发芽燕麦中多酚、黄酮含量与抗氧化活性的相关性Table 3 Correlation between contents of polyphenols and flavonoids and antioxidant activity of sprouted oats under light and dark treatments
3 讨 论
种子萌发是植物生命周期的初始阶段,也是植物对非生物胁迫最敏感的阶段[23]。作为一种常见的非生物胁迫,光照能促进植物中多酚等活性物质的积累[24-25]。本研究表明,与黑暗组相比,光照处理能显著提高发芽燕麦中游离态和结合态多酚、黄酮含量,这与前人的研究结果[10,12-13]基本一致。植物中的酚类化合物主要通过苯丙烷途径产生,而该途径易受生物和非生物胁迫的刺激,从而激活植物体内多酚类物质合成相关酶的活性,促进多酚的积累[26],而酶活又与相关基因的表达密切相关,因此推测,光照可能刺激了与多酚、黄酮物质合成相关的酶基因的表达,从而使萌发种子中多酚、黄酮含量增加。此外,光通过改善光合作用以及丙二酰辅酶A途径也可增加总多酚的含量[27]。
本研究测定了2种处理下发芽燕麦中游离态、结合态多酚提取物中5种酚酸物质的含量。结果显示,游离态多酚提取物中,5种酚酸的总量在浸泡和发芽初期呈先下降后上升的趋势,这与游离态多酚含量的变化趋势基本一致,表明在浸泡阶段5种目标酚酸有所损失或发生了生物转化[28-29],而在发芽伊始,种子内源酶的激活促进了某些酚酸物质的生物合成[30]。但是随着发芽时间的继续延长(G2~G4),5种酚酸的总量呈下降趋势,这与游离态多酚含量呈增加的趋势相反,表明发芽过程还存在其他游离态多酚。光照组样品中没食子酸、咖啡酸、阿魏酸含量在发芽过程中总体高于黑暗组,对香豆酸和肉桂酸的含量总体低于黑暗组,5种酚酸的总量在发芽前期光照组略低于黑暗组,发芽后期显著高于黑暗组。表明光照处理对游离态多酚提取物中不同酚酸的影响不同,推测燕麦发芽过程中与各酚酸组分代谢相关的酶的基因表达对光诱导的响应程度不同,导致酶活性不同,从而影响发芽过程中各酚酸组分的含量,针对此现象后续可做进一步的研究。结合态多酚提取物中,除肉桂酸外,其余4种酚酸的含量在发芽过程中均表现为光照组显著高于黑暗组,5种酚酸总量为光照组显著高于黑暗组。肉桂酸含量在燕麦发芽过程中一直呈显著降低趋势,光照组肉桂酸含量的减少量显著高于黑暗组。结果表明,与黑暗处理相比,光照处理能够显著提高发芽燕麦结合态多酚提取物中没食子酸、咖啡酸、对香豆酸和阿魏酸的含量,这与前人的报道[11,31]一致,分析其内在机理可能是因为光照能诱导与这些酚酸合成相关基因的表达,激活相关酶的活性,从而促进酚酸物质的积累。肉桂酸在燕麦发芽过程中一直呈显著降低趋势,且光照组肉桂酸减少量显著高于黑暗组,推测可能是因为发芽过程中肉桂酸被大量消耗用于合成其他多酚类物质,如对香豆酸、黄酮等[32]。
本研究还发现,2种处理下发芽燕麦多酚提取物清除ABTS、DPPH自由基的能力和铁还原能力随发芽时间的延长而增强,其中光照组样品的3个抗氧化指标均显著高于黑暗组,这与Wu等[33]的研究结果一致。推测其可能原因是:光照处理提高了发芽燕麦中多酚、黄酮等具有抗氧化性能物质的含量,从而使得光照组样品的抗氧化活性显著增加。光照和黑暗处理下发芽燕麦中多酚、结合态黄酮含量与抗氧化活性之间呈显著正相关也证实了此推测。

