地杆菌α-L-岩藻糖苷酶的分子改造及其在合成2’-岩藻糖基乳糖中的应用
史 然,张登娅,谷懿寰,江正强,杨绍青*
(中国轻工食品生物工程重点实验室,中国农业大学食品科学与营养工程学院,北京 100083)
人乳寡糖(human milk oligosaccharides,HMOs)是人乳中一系列结构复杂、不可消化的碳水化合物总称,在婴幼儿生长和发育过程中发挥着关键作用[1]。HMOs在人乳中质量浓度约为5~24 g/L,是仅次于脂肪和乳糖的第3大类固形物[2],其中2’-岩藻糖基乳糖(2’-fucosyllactose,2’-FL)(图1)是HMOs中的最主要成分之一[3]。研究表明,2’-FL具有调节肠道微生态、抗病原菌黏附、免疫调节及促进神经系统发育和修复等多种功能活性[3]。目前,2’-FL已经在美国和欧盟获得批准可作为食品原料添加到婴幼儿奶粉、膳食补充剂和医疗食品中[4]。

图1 2’-FL的分子结构Fig.1 Molecular structure of 2’-FL
2’-FL的制备主要有化学合成、全细胞合成和酶催化合成法[4-5],其中酶法合成具有反应条件温和、反应时间短、产物易于纯化等优点,具有较好的发展前景[6-8]。α-L-岩藻糖苷酶(EC 3.2.1.51)能够催化岩藻糖苷键的水解,在特定条件下也能够催化转糖苷反应合成岩藻糖苷键[8],因而在酶法合成岩藻糖基寡糖中发挥着关键作用[8-10]。α-L-岩藻糖苷酶来源广泛,特性各异,其中适用于2’-FL合成的α-L-岩藻糖苷酶主要以微生物来源为主,且主要集中于细菌种属,如地杆菌(Pedobactersp.)[11]、芽孢杆菌(Paenibacillussp.)[12]和热袍菌(Thermotogasp.)等[13],真菌来源相对较少,如禾谷镰刀菌(Fusarium graminearum)等[14]。虽然目前已有一些α-L-岩藻糖苷酶合成2’-FL的研究报道,但是受限于α-L-岩藻糖苷酶的催化特性,反应产物成分复杂、转化率低等问题仍然亟待解决[9-10]。蛋白质工程是提高酶学性质的有效手段,近年来已成功用于不同类型酶的分子改造中[15]。目前关于α-L-岩藻糖苷酶的转糖苷活性和区域选择性等方面的分子改造多采用理性或半理性设计的方法[16-17],采用定向进化技术用于提高α-L-岩藻糖苷酶合成2’-FL转化率的研究报道相对较少,仅见Osanjo等[18]采用定向进化技术对海栖热袍菌(T.maritima)α-L-岩藻糖苷酶进行突变和筛选,得到突变酶的转糖苷活性从7%提高至60%。
地杆菌CAU209是由本实验室研究人员从土壤中自行分离并保藏的1 株细菌。本团队前期从该菌株基因组中发掘出一个地杆菌α-L-岩藻糖苷酶(PbFuc29A1)(GenBank登录号:MN902190),并应用于2’-FL和3’-FL的合成,转化率分别为14.5%和70.5%。由于其合成2’-FL的转化率较低[11],本研究拟采用定向进化技术进一步对PbFuc29A1进行分子改造,以提高其合成2’-FL的效率。
1 材料与方法
1.1 材料与试剂
FastPfuDNA聚合酶 北京全式金生物技术有限公司;限制性内切酶、连接酶 New England Biolabs公司;Escherichia coliDH5α 上海唯地生物技术有限公司;引物 生工生物工程(上海)股份有限公司;酵母膏、胰蛋白胨 英国Oxoid公司;异丙基β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)美国Inalco公司;β-半乳糖苷酶(7 500 LAU/g)美国Novozymes公司;2-氯-4-硝基苯基-α-L-岩藻糖苷(4-nitrophenyl-α-L-fucopyranoside,pNP-FUC)爱尔兰Megazyme公司;薄层层析色谱(thin layer chromatography,TLC)硅胶板Silica gel 60 F254、β-D-乳糖美国Sigma公司;2’-FL、3-FL 法国Elicityl公司;3’-FL采用之前的方法自制[11]。其余试剂均为分析纯。
1.2 仪器与设备
MyCycler Thermal Cycler聚合酶链式反应(polymerase chain reaction,PCR)扩增仪、Power Pac BasicTM型电泳仪 美国Bio-Rad公司;JY92-II超声波细胞破碎仪 宁波新芝科器研究所;3K15台式高速冷冻离心机 德国Sigma公司;1260高效液相色谱仪(配套示差折光检测器) 美国Agilent公司。
1.3 方法
1.3.1α-L-岩藻糖苷酶随机突变体文库的构建
采用不同浓度的Mg2+(3、5 mmol/L)和Mn2+(0.1、0.2、0.4 mmol/L)对α-L-岩藻糖苷酶基因(PbFuc29A1)进行易错PCR扩增[19]。根据PbFuc29A1的基因序列设计引物为F:5’-TGCCGCGCGGCAGCC ATATGGCTAGCATGAAGAAACTCATCCTAATAGGC CT-3’;R:5’-TGGGTCGCGGATCCGAATTCGAGCTC CTATCCAATCTCCAAAACAATCACC-3’。PCR体系为50 µL:1×FastPfuDNA聚合酶缓冲液、0.2 mmol/L dATP和dGTP、1 mmol/L dCTP和dTTP、引物0.2 μmol/L、模板DNA 20 ng、FastPfuDNA聚合酶2.5 U。PCR扩增条件:95 ℃预变性3 min;95 ℃变性20 s,55 ℃退火20 s,72 ℃延伸45 s,变性-退火-延伸共35 个循环;终延伸5 min。
使用胶回收试剂盒切胶回收易错PCR扩增产物,用限制性内切酶NheI和SacI分别对载体pET-28a和基因的胶回收产物进行消化(37 ℃消化5 h),用DNA清洁回收试剂盒回收酶切后的载体和基因,利用T4 DNA连接酶连接回收的基因与线性化载体,16 ℃连接过夜,将连接产物转入E.coliDH5α中,涂布于LB固体平板(含50 μg/mL卡纳霉素)上构建突变体文库。
1.3.2α-L-岩藻糖苷酶随机突变体文库的筛选
1.3.2.1 初筛
初筛参照邵泽香等[20]的方法并略有修改。在96 孔板中加入100 μL LB培养基(含50 μg/mL卡纳霉素),用牙签逐个挑取突变菌接种至96 孔板(每板接种野生型菌株为对照),于37 ℃、180 r/min培养3 h。每孔取20 μL种子液转接至新96 孔板(每孔含180 μL LB培养基,50 μg/mL卡纳霉素),37 ℃、180 r/min培养3 h后加入终浓度为1 mmol/L的IPTG,20 ℃、180 r/min诱导16 h。在4 ℃、3 000 r/min离心20 min获得菌体,将菌体于-80 ℃冷冻2 h后于室温下复融,加入100 μL 10 mg/mL溶菌酶,pH 8.0、37 ℃处理30 min,再于4 ℃、3 000 r/min离心20 min,获得上清液即为粗酶液。
粗酶活力测定:96 孔板中依次加入10 μL酶液和100 μL 2.0 mmol/LpNP-FUC溶液,在pH 5.0、35 ℃反应30 min,每孔加入100 μL 1 mmol/L Na2CO3溶液灭活显色,在405 nm波长处读取OD值。筛选可检测到酶活力(OD405nm>0.3)的粗酶液,进行转糖苷活性测定:反应体系中依次加入250 μL 20 mmol/LpNP-FUC、250 μL 100 mmol/L乳糖和10 μL酶液,在pH 7.0、35 ℃反应3 h。沸水浴灭活10 min终止反应,取适量产物进行TLC分析,筛选出有转糖苷活性的粗酶液。随后在反应产物中加入β-半乳糖苷酶,于37 ℃、pH 7.0反应3 h水解剩余乳糖,沸水浴灭活10 min终止反应,取适量产物进行TLC分析,监测乳糖的水解程度。调整反应体系pH值为4.6,加入重组α-L-岩藻糖苷酶FgFCO1水解合成产物中的2’-FL,于40 ℃、pH 4.6反应3 h,由于FgFCO1可特异性水解2’-FL,而不能水解3’-FL,转糖苷产物中2’-FL比例越高,水解生成的乳糖和L-岩藻糖含量越高,挑选水解程度高的突变酶为阳性克隆。
1.3.2.2 复筛
将阳性克隆以1%接种量接入10 mL LB培养基(含50 μg/mL卡纳霉素)进行种子液培养,于37 ℃、180 r/min培养12 h。将种子液以1%接种量转接至50 mL LB培养基,于37 ℃、180 r/min培养至菌体OD600nm至0.6~0.8,加入终浓度为1 mmol/L的IPTG,20 ℃、180 r/min诱导16 h。4 ℃、10 000 r/min离心10 min收集菌体,用pH 7.0的磷酸盐缓冲液重悬菌体,菌液于冰水浴中超声破碎(200 W,超声3 s,间歇4 s,120 次),4 ℃、10 000 r/min离心20 min,获得上清液即为粗酶液。
转糖苷活性复筛:以10 mmol/L pNP-FUC作为岩藻糖基供体、50 mmol/L乳糖为受体,加入上述α-L-岩藻糖苷酶粗酶液(0.5 U/mL),在pH 7.0、35 ℃反应3 h。反应产物煮沸10 min灭活,经0.22 μm微孔滤膜过滤,利用高效液相色谱(high performance liquid chromatography,HPLC)分析。挑选转糖苷产物中2’-FL转化率升高的突变体进行后续研究。
1.3.3α-L-岩藻糖苷酶突变体(mPbFuc29A1)表达和纯化
菌体的培养、诱导产酶、酶液的提取与纯化参照Shi Ran等[11]的方法进行。
1.3.4 mPbFuc29A1酶活力和蛋白浓度测定
α-L-岩藻糖苷酶活力测定[21]:反应体系加入100 μL 10 mmol/LpNP-FUC、100 μL 0.05 mol/L柠檬酸-柠檬酸三钠缓冲液(pH 5.0)和10 μL适当稀释的酶液,在35 ℃反应20 min,加入200 μL 1 mol/L Na2CO3溶液终止反应并振荡均匀。取200 μL加入96 孔板,测定405 nm波长处OD值。以对硝基苯酚(4-nitrophenyl-α-L-fucopyranoside,pNP)为标准品作标准曲线。酶活力定义:在40 ℃、pH 5.0每分钟催化pNP-FUC水解生成1 μmolpNP所需要的酶量为一个酶活力单位(U)。
使用Lowry法测定蛋白浓度,以牛血清白蛋白作为标准蛋白[22]。
1.3.5 mPbFuc29A1的酶学性质分析
1.3.5.1 mPbFuc29A1的最适pH值和pH值稳定性
将mPbFuc29A1分别用50 mmol/L不同pH值的缓冲液(柠檬酸-柠檬酸三钠,pH 3.0~5.5;磷酸二氢钠-磷酸氢二钠,pH 6.0~8.0;Gly-NaOH,pH 8.5~10.5)稀释,然后在40 ℃测定α-L-岩藻糖苷酶活力,以酶活力最高点作为100%作图。
pH值稳定性测定:使用以上不同pH值的缓冲液和磷酸氢二钠-氢氧化钠(pH 11.0~12.0)稀释mPbFuc29A1,将稀释好的酶液在30 ℃处理1~8 h,每隔1 h取样并迅速置于冰水浴中孵育30 min,在pH 5.0、40 ℃测定mPbFuc29A1的残余酶活力,以未处理酶液的酶活力作为100%作图。
1.3.5.2 mPbFuc29A1的最适温度和温度稳定性
用50 mmol/L pH 6.0的磷酸盐缓冲液将mPbFuc29A1稀释适当倍数,然后分别在20~50 ℃和pH 5.0条件下测定α-L-岩藻糖苷酶活力,以酶活力最高点为100%作图。
温度稳定性测定:用50 mmol/L pH 6.0的磷酸盐缓冲液将纯酶液稀释适当倍数,分别在30~50 ℃处理0~8 h,定时取样并迅速置于冰水浴中冷却30 min,在pH 5.0、40 ℃条件下测定mPbFuc29A1的残余酶活力,以未处理酶的酶活力为100%作图。
1.3.5.3 mPbFuc29A1的底物特异性和动力学常数
分别以5 mmol/LpNP-FUC、2’-FL、3-FL和3’-FL为底物,测定mPbFuc29A1酶活力,计算mPbFuc29A1对各种底物的比活力和相对酶活力。反应体系中加入100 μL含10 mmol/L岩藻糖的pNP-FUC或其他底物、100 μL 50 mmol/L pH 5.0的柠檬酸缓冲液和10 μL适当稀释的酶液,在40 ℃、pH 5.0反应20 min,最后加热煮沸终止反应。采用HPLC测定体系中L-岩藻糖的浓度。酶活力定义:在40 ℃、pH 5.0每分钟催化底物水解生成1 μmolL-岩藻糖所需要的酶量,以pNP-FUC为底物时测定的酶活力作为100%。比活力(U/mg)为在40 ℃、pH 5.0每毫克纯酶的活力单位数。
用50 mmol/L pH 5.0的柠檬酸-柠檬酸三钠缓冲液配制0.25~0.75 mmol/L的pNP-FUC溶液,反应体系中加入200 μL上述不同浓度的pNP-FUC、10 μL适当稀释的酶液,在40 ℃、pH 5.0反应5 min,测定酶的初始酶活力。采用GraphPad Prism7.0软件计算米氏常数Km和最大反应速率Vmax。
1.3.6 2 ’-FL和3’-FL的酶法合成
1.3.6.1 合成条件优化
以合成产物中2’-FL含量为优化目标,对mPbFuc29A1合成2’-FL的反应条件进行单因素试验优化,包括反应温度(20~50 ℃)、pH值(5.0~9.0)、加酶量(0.25~2.0 U/mL)、反应时间(0~5 h)和乳糖浓度(0.1~1.0 mol/L)。所有样品煮沸10 min终止反应,产物经0.22 μm滤膜过滤后采用HPLC分析。
1.3.6.2 2’-FL、3’-FL和L-岩藻糖的定量
采用HPLC法定量分析。色谱条件:Waters XBridge氨基柱(4.6 mm×250 mm,5 µm),流动相为乙腈-水(72∶28,V/V),流速为0.5 mL/min,柱温45 ℃,示差折光检测器温度为35 ℃。
产物的定量:以2’-FL、3’-FL和L-岩藻糖为标准品,建立2’-FL、3’-FL和L-岩藻糖含量与相应HPLC信号峰面积之间的关系曲线。根据标准曲线计算产物中2’-FL、3’-FL和L-岩藻糖的含量。2’-FL和3’-FL转化率计算公式如下:

1.3.7 mPbFuc29A1的序列分析、定点突变和三维结构模拟
将筛选到的阳性突变体α-L-岩藻糖苷酶基因(mPbFuc29A1)测序后,与野生型基因(PbFuc29A1)进行序列比对分析,确定阳性克隆突变位点。根据突变位点信息,设计两个单点突变体,Glu266Lys和Asp21Val。对突变体转糖苷产物组成进行HPLC分析,确定关键氨基酸。
以拟杆菌(Bacteroides thetaiotaomicron)α-L-岩藻糖苷酶(PDB登录号:2wvs)为模板(同源性29.9%),在SWISS-MODEL(http://swissmodel.expasy.org/)上进行建模,生成PbFuc29A1模拟结构图,根据预测的结构信息对突变位点进行分析。利用PyMOL软件分析氨基酸残基间氢键相互作用和突变位点对蛋白质二级结构的影响。
1.4 数据分析
采用GraphPad Prism7.0软件对相关数据进行统计分析和绘图。
2 结果与分析
2.1 α-L-岩藻糖苷酶突变文库的高通量筛选
通过调整PCR体系中Mg2+或者Mn2+浓度获得具有合适突变率的文库是常规手段[9]。采用不同浓度的Mg2+(3、5 mmol/L)和Mn2+(0.1、0.2、0.4 mmol/L)对α-L-岩藻糖苷酶基因(PbFuc29A1)进行易错PCR扩增,每组突变库随机挑选12株菌落测序计算突变率,发现采用5 mmol/L Mg2+和0.2 mmol/L Mn2+构建文库的突变率为0.295%,在合理突变率范围内[20]。初筛得到524 个突变体可检测到α-L-岩藻糖苷酶活力,水解物经TLC分析,发现有129 个突变体具有转糖苷活性。进一步筛选出6 株转糖苷产物能够明显被α-L-岩藻糖苷酶FgFCO1水解的突变体。最终得到1 个转糖苷产物中2’-FL含量明显升高的正向突变体酶(图2),命名为mPbFuc29A1。

图2 地杆菌α-L-岩藻糖苷酶PbFuc29A1及突变体mPbFuc29A1转糖苷产物HPLC分析图Fig.2 HPLC analysis of the transglycosylation reaction products from PbFuc29A1 and mPbFuc29A1
2.2 mPbFuc29A1的表达及纯化
经过Ni-IDA亲和层析柱一步纯化,得到mPbFuc29A1的电泳级纯酶(图3),该酶的纯化倍数为3.41,回收率为47.7%。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)显示该酶的分子质量约为50 kDa,与野生型PbFuc29A1分子质量一致[11]。
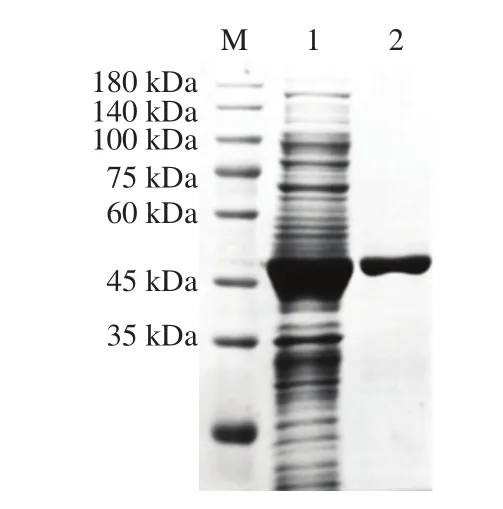
图3 α-L-岩藻糖苷酶突变体mPbFuc29A1纯化SDS-PAGE图Fig.3 SDS-PAGE analysis of the proteins during the purification process of mPbFuc29A1
2.3 mPbFuc29A1的酶学性质
mPbFuc29A1的最适pH值为5.0(图4A),与PbFuc29A1一致。mPbFuc29A1在pH 6.0~9.0范围内于30 ℃保温8 h可保持80%以上的酶活力(图4B)。mPbFuc29A1在pH 5.0的稳定性较差,在pH 5.0保温2 h,残余酶活力降至50%;在pH 11.0保温3 h,mPbFuc29A1完全失活,而未突变酶PbFuc29A1在pH 11.0保温3 h的残余酶活力仍为30%左右。因此,突变后α-L-岩藻糖苷酶的pH值稳定性有所下降。mPbFuc29A1的最适温度为40 ℃(图4C),在30 ℃和35 ℃保温8 h、在40 ℃保温4 h可保持80%以上的酶活力,在40 ℃保温8 h可保持60%以上的酶活力,在45 ℃保温0.5 h可保持75%左右的酶活力,超过0.5 h酶活力迅速下降(图4D)。而未突变酶PbFuc29A1在30、35 ℃和40 ℃保温8 h可保持80%以上的酶活力,在45 ℃保温2 h可保持60%左右的酶活力。因此,突变后的α-L-岩藻糖苷酶的温度稳定性也有所下降。
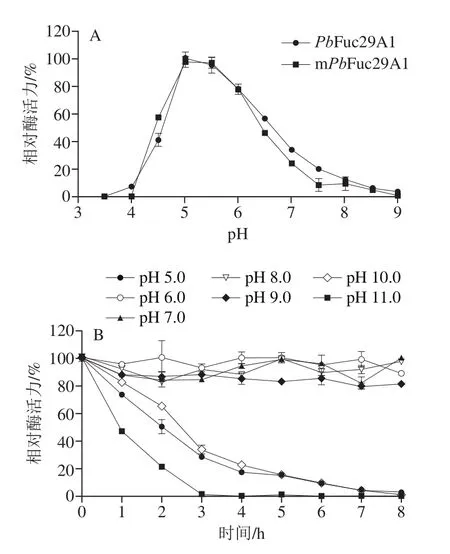
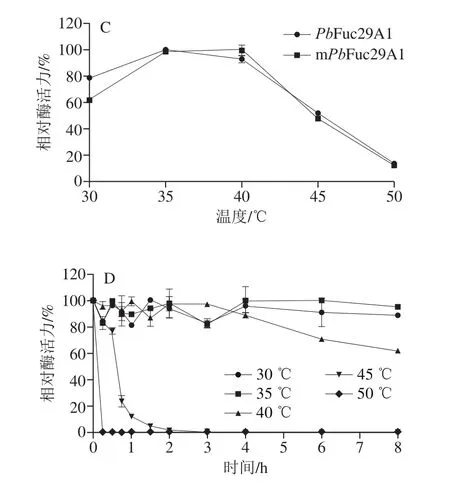
图4 mPbFuc29A1的最适pH值(A)、pH值稳定性(B)、最适温度(C)和温度稳定性(D)Fig.4 Optimal pH (A), pH stability (B), optimal temperature (C), and thermostability (C) of mPbFuc29A1
2.4 mPbFuc29A1的底物特异性和动力学常数
如表1所示,突变酶mPbFuc29A1水解pNP-FUC和3’-FL的比活力分别为20.30 U/mg和4.72 U/mg,与PbFuc29A1相比,分别降低了22.8%和52.5%;此外,mPbFuc29A1水解2’-FL的比活力提高到约3 倍,为11.70 U/mg。

表1 α-L-岩藻糖苷酶PbFuc29A1和mPbFuc29A1底物特异性Table 1 Substrate specificity of PbFuc29A1 and mPbFuc29A1
如表2所示,mPbFuc29A1对pNP-FUC的Vmax值为25.1 μmol/(min·mg),较PbFuc29A1略有降低,Km值为0.39 mmol/L,小于PbFuc29A1的Km值(0.72 mmol/L)。

表2 α-L-岩藻糖苷酶PbFuc29A1和mPbFuc29A1动力学参数Table 2 Kinetic parameters of PbFuc29A1 and mPbFuc29A1
2.5 2’-FL和3’-FL的合成
对mPbFuc29A1合成3’-FL和2’-FL的条件进行优化,结果表明,温度、pH值、加酶量、反应时间和乳糖浓度对3’-FL和2’-FL的合成均有显著影响(图5)。其中,pH值对2’-FL合成的影响较为明显,当pH值由5.5升高至8.0时,mPbFuc29A1合成2’-FL浓度逐渐升高,而3’-FL浓度逐渐降低;当pH值超过8.5时,3’-FL和2’-FL的转化率均迅速下降。最终得到的mPbFuc29A1转糖苷合成2’-FL相对最适条件为反应温度35 ℃、反应pH 8.0、加酶量0.75 U/mL、反应时间4.0 h和乳糖浓度0.7 mol/L,相对最适条件下2’-FL的转化率为23.6%,比野生型酶提高了9.1%,3’-FL的转化率为56.4%,2’-FL和3’-FL的总转化率为80%。

图5 转糖苷反应pH值(A)、加酶量(B)、反应时间(C)和乳糖浓度(D)对mPbFuc29A1合成2’-FL和3’-FL的影响Fig.5 Effects of pH (A), enzyme dosage (B), reaction time (C), and lactose concentration (D) on the synthesis of 3’-FL and 2’-FL by mPbFuc29A1
2.6 mPbFuc29A1序列分析、定点突变和结构模拟
测序结果表明,α-L-岩藻糖苷酶突变基因(mPbFuc29A1)中有2 个碱基发生改变,导致该突变体中2 个氨基酸发生改变,即Asp21Val和Glu266Lys,将PbFuc29A1和mPbFuc29A1的氨基酸序列与其他GH29家族α-L-岩藻糖苷酶进行序列比对,发现Asp21和Glu266均为部分保守氨基酸。
定点突变酶的转糖苷产物分析结果表明(表3),与野生型α-L-岩藻糖苷酶PbFuc29A1相比,突变体Asp21Val的转糖苷产物比例没有明显变化,而突变体Glu266Lys的转糖苷产物中3’-FL的比例明显降低,2’-FL的比例明显升高,推测第266位谷氨酸(Glu)突变是造成PbFuc29A1转糖苷产物比例发生改变的关键因素。与突变体Glu266Lys相比,双突变体Glu266Lys/Asp21Val的转糖苷产物中2’-FL的比例有进一步提升。

表3 地杆菌α-L-岩藻糖苷酶PbFuc29A1及其突变酶转糖苷产物分析Table 3 Composition of the transglycosylation reaction products from PbFuc29A1 and its mutants
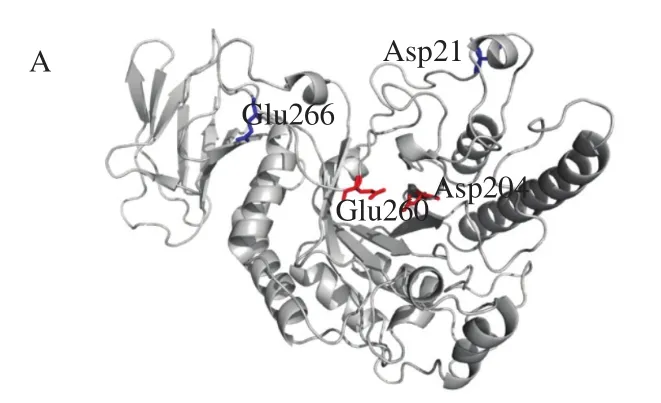
采用SWISS-MODEL对PbFuc29A1和mPbFuc29A1进行结构预测,结果如图5所示。PbFuc29A1的单体结构由2 个结构域组成。N端结构域具有类似于(β/α)8-TIM桶的折叠,主要由6 个β-片层和10 个α-螺旋结构组成,其中催化残基位于TIM桶内部。C端结构域则包括6 个反向平行的β-片层和1 个小的α-螺旋结构。在PbFuc29A1中,位于loop区第266位的谷氨酸(Glu)与第268位的赖氨酸(Lys)、第316位的丝氨酸(Ser)和第370位的丝氨酸(Ser)存在氢键相互作用,该位点在mPbFuc29A1中突变为赖氨酸(Lys266),与周围的氨基酸氢键作用减弱(图5B)。而第21位氨基酸在突变前后,与周围氨基酸的氢键作用力无明显变化(图5C)。此外,通过预测PbFuc29A1(图5B)和mPbFuc29A1(图5C)的表面电荷分布,发现进化后的mPbFuc29A1催化凹槽左侧区域的电性由弱负电变为强正,这主要是由Glu266Lys突变引起;而在催化凹槽背面的电性由强负变为中性,这主要是由Asp21Val突变引起。

图5 α-L-岩藻糖苷酶PbFuc29A1和mPbFuc29A1的结构和电荷分布Fig.5 Structures and charge distributions of PbFuc29A1 and its mutants PbFuc29A1-Asp21Val and PbFuc29A1-Glu266Lys
3 讨 论
目前关于提高α-L-岩藻糖苷酶的转糖苷活性及区域选择性的研究多采用理性或半理性设计的方法[15,17],定向进化技术应用较少[18]。本研究利用易错PCR对地杆菌α-L-岩藻糖苷酶PbFuc29A1进行随机突变,从约10 000 个突变株中获得了一个合成2’-FL能力显著提高的突变酶mPbFuc29A1。
mPbFuc29A1的最适pH值为5.0,明显低于一些细菌来源的α-L-岩藻糖苷酶,如解硫胺素芽孢杆菌(Paenibacillus thiaminolyticus,pH 7.0~9.0)[23]、产碱杆菌(Alcaligenessp.pH 7.0)[24]、干酪乳杆菌(Lactobacillus casei)BL23(pH 7.0)[25]和福赛斯坦纳菌(Tannerella forsythia,pH 7.0)[26]等。但与大部分真菌来源的α-L-岩藻糖苷酶接近,如黑曲霉(Aspergillus niger,pH 5.0)[27]、禾谷镰刀菌(pH 4.6)[14]和层出镰刀菌(Fusarium proliferatum,pH 5.5)[28]等。mPbFuc29A1的最适温度为40 ℃,比PbFuc29A1提高了5 ℃,与大部分细菌和真菌来源的α-L-岩藻糖苷酶都接近,但明显低于海栖热袍菌[13](60 ℃)和产碱杆菌[24](50 ℃)来源的α-L-岩藻糖苷酶。值得注意的是,与PbFuc29A1相比,mPbFuc29A1的底物特异性发生显著变化,对pNP-FUC和3’-FL的比活力显著降低,但是对2’-FL的比活力升高到3 倍左右。一般来说,α-L-岩藻糖苷酶的底物特异性与其转糖苷产物组成相关[14,25]。因此,mPbFuc29A1底物特异性的变化可能会导致其转糖苷产物的变化。此外,mPbFuc29A1的Km值(0.39 mmol/L)小于PbFuc29A1(0.77 mmol/L),表明突变酶对pNP-FUC的亲和力增强,但该酶对pNP-FUC的比活力却没有升高。
目前,已有一些具有转糖苷活性的α-L-岩藻糖苷酶被用于2’-FL的合成。本研究中,mPbFuc29A1合成2’-FL的转化率最高为23.6%,与PbFuc29A1比较提高了9.1%,高于芽孢杆菌(13%)[12]和禾谷镰刀菌(14%)[14]来源α-L-岩藻糖苷酶,与α-L-岩藻糖苷酶突变体FgFCO1-D286H相当(23%)[15],但是低于海栖热袍菌α-L-岩藻糖苷酶(32.5%)[13]。mPbFuc29A1合成3’-FL的转化率为56.4%,合成2’-FL和3’-FL的总转化率为80%,在2’-FL的合成中具有潜在应用价值。
近年来,柔性loop区对糖苷水解酶催化活性的影响越来越引起广泛关注[29]。GH29家族α-L-岩藻糖苷酶呈现典型口袋拓补结构,活性口袋内部的氨基酸配体是严格保守的,但位于催化口袋周围的loop环会影响催化口袋的形状[30]。结构数据显示,至少2 条loop环会参与酶的催化过程,且loop区在酶与底物结合后会发生变化[31-32]。因此,对α-L-岩藻糖苷酶催化口袋附近loop环区的氨基酸进行改造也是当前研究热点。研究发现,对一些糖苷水解酶的loop区进行分子改造可提高酶的转糖苷活性,如克氏锥虫(Trypanosoma cruzi)转唾液酸苷酶[32]和两歧双歧杆菌α-L-岩藻糖苷酶[17]等的改造。Loop区影响酶的转糖苷活性的机制可能有3 种:1)使催化口袋形成封闭的拓补结构;2)在催化活性中心入口处形成疏水环境;3)阻塞通往催化活性位点的水通道[17]。本研究中,α-L-岩藻糖苷酶PbFuc29A1位于loop环区第266位氨基酸由谷氨酸(Glu)突变为赖氨酸(Lys),是酶催化活性发生改变的关键,改变了该酶对pNP-FUC、3’-FL和2’-FL的比活力。同时,该酶合成2’-FL转化率提高,合成3’-FL的转化率降低,但总转化率仍高达80%。这可能是由于Glu266Lys氨基酸位点的变化降低了loop区与周围氨基酸的氢键作用力,改变了酶的催化口袋的形状,进一步改变了该酶的最适温度和底物特异性等酶学性质[18,29-32],增强了该酶在转糖苷反应中对α-1,2-糖苷键的区域选择性,进一步提高了该酶合成2’-FL的效率。
4 结 论
利用定向进化技术成功将地杆菌α-L-岩藻糖苷酶(PbFuc29A1)进行改造,使其合成2’-FL的转化率从14.5%提高到23.6%。mPbFuc29A1水解2’-FL的比活力提高到3 倍左右,但是对pNP-FUC和3’-FL的比活力明显降低。mPbFuc29A1中有2 个氨基酸发生替换,分别是Asp21Val和Glu266Lys,其中位于loop区的Glu266Lys是导致mPbFuc29A1c底物特异性和转糖苷产物发生改变的关键。mPbFuc29A1在合成2’-FL中具有潜在的工业应用价值。

