市售麝香壮骨膏的质量评价*
王发英 吴查青 陈张金 刘敏 余华丽 王伟影
(丽水市质量检验检测研究院,浙江 丽水 323000)
麝香壮骨膏是由八角茴香、山柰、生川乌、生草乌、麻黄、白芷、苍术、当归和干姜提取而制成浸膏、再取麝香、薄荷脑、水杨酸甲酯、豹骨、硫酸软骨素、冰片、盐酸苯海拉明与樟脑八味药物组成的一种外用橡胶膏剂,具有镇痛、消炎的功效,临床上用于风湿痛、关节痛、腰痛、神经痛、肌肉酸痛、扭伤和挫伤[1]。通过国家局网站批准文号查询,全国范围内麝香壮骨膏的生产企业共58家,批准文号61个。现行标准有《中华人民共和国卫生部药品标准》中药成方制剂第十一册[2]和国家食品药品监督管理总局国家药品标准WS3-B-2268-96-2[3]。本文拟通过法定标准与含量测定(樟脑、薄荷脑、冰片、水杨酸甲酯和盐酸苯海拉明)对市售麝香壮骨膏进行质量调研,为麝香壮骨膏的质量评价与临床应用提供参考数据。
1 仪器与试药
1.1仪器 Agilent7890B气相色谱仪;H-Class Waters超高效液相色谱仪;XS105DU、XS104电子天平(瑞士梅特勒公司);UNE400自然对流烘箱(德国Memmert公司)、Milli-Q Advantage A10超纯水仪。
1.2试剂 樟脑对照品(批号:110747-201409)、薄荷脑对照品(批号:110728-200506)、冰片对照品(批号:110743-200905)、水杨酸甲酯对照品(批号:110707-201112)、萘对照品(批号:111673-200803)、盐酸苯海拉明对照品(批号:100066-200807)、乌头碱对照品(批号:110720-201111),均购自中国食品药品检定研究院;乙酸乙酯(色谱纯,上海展云化工有限公司);甲醇(色谱纯,默克),其余试剂均为分析纯,水为自制超纯水。
麝香壮骨膏,市场随机购入50批次,涉及20家生产企业,生产企业所在省市包括浙江、安徽、江西、海南、吉林、桂林、江苏、重庆、河南、湖北、湖南、山东等地,具有一定的地域差异性,样品具有良好代表性。样品信息见表1。
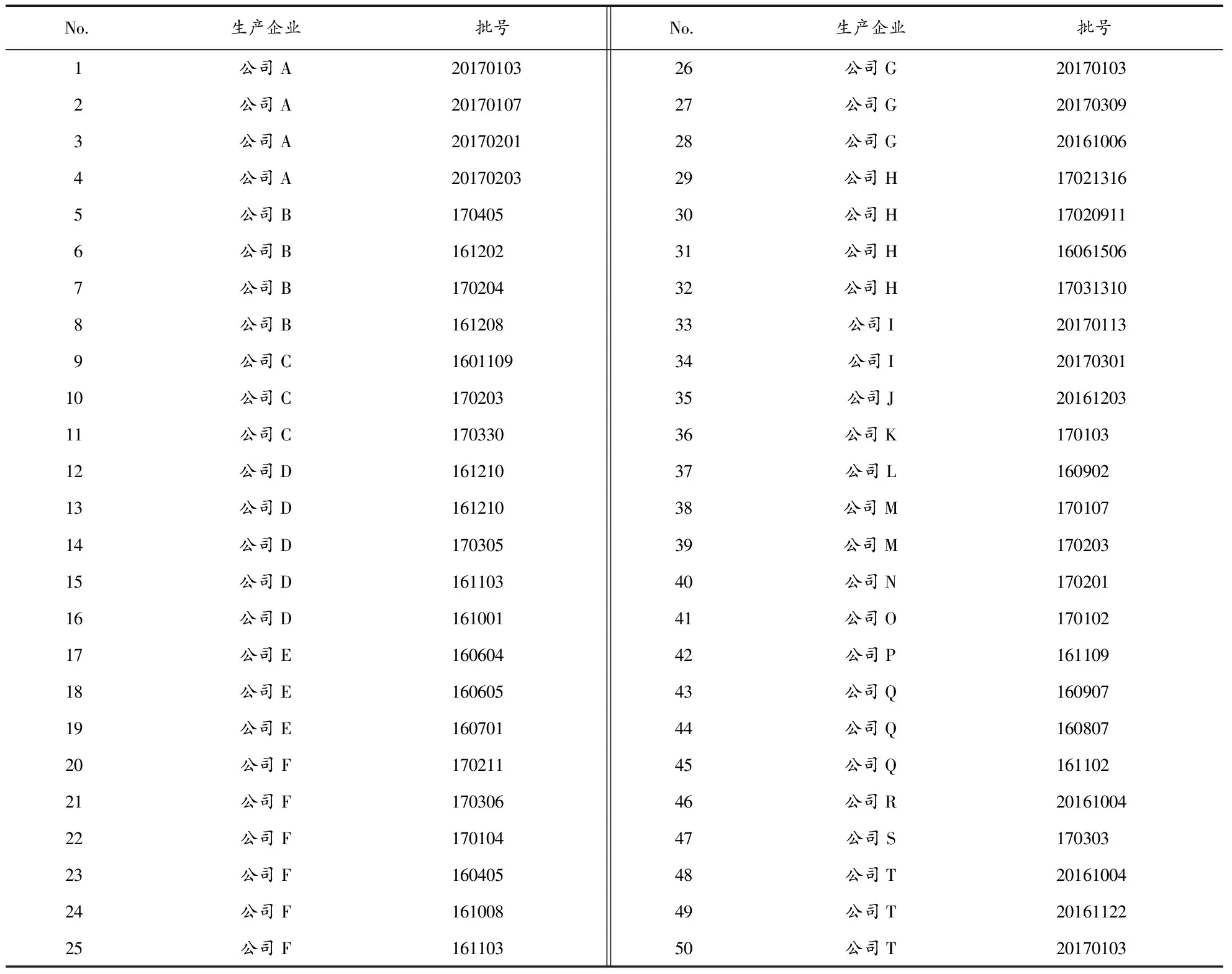
表1 麝香壮骨膏基本信息
2 方法与结果
2.1法定标准检验 现行法定标准《中华人民共和国卫生部药品标准》中药成方制剂第十一册,检验项目包括性状、含膏量、耐热性和微生物限度;现行法定标准国家食品药品监督管理总局国家药品标准WS3-B-2268-96-2(样品中仅公司F执行此标准),比《中华人民共和国卫生部药品标准》中药成方制剂第十一册多了樟脑、薄荷脑、冰片、水杨酸甲酯气相色谱鉴别,盐酸苯海拉明薄层鉴别,樟脑、水杨酸甲酯、盐酸苯海拉明的含量测定和乌头碱限量的薄层检查。按照法定标准检验,50批样品均符合所执行的标准规定,合格率为100%,其中含膏量结果见表2和图3。
2.2含量测定 盐酸苯海拉明(高效液相色谱法)。
2.2.1色谱条件[4-9]Agilent Zorbax XDB-C18(4.6 mm×250 mm,5 μm)色谱柱 (美国安捷伦公司);柱温:30 ℃;流速:1.0 mL·min-1;检测波长:258 nm;流动相:甲醇-1%硫酸铵水溶液(47∶53);进样量:10 μL。
2.2.2对照品溶液的制备 取盐酸苯海拉明对照品适量,精密称定,加80%甲醇制成每1 mL含0.2 mg的溶液,作为对照品溶液。
2.2.3供试品溶液的制备 取样品70 cm2,除去盖衬,剪成条状,精密加入80%甲醇25 mL,称定重量,加热回流2 h,放冷,再称定重量,用80%甲醇补足减失的重量,摇匀,滤过,取续滤液,作为供试品溶液。
2.2.4系统适用性实验 分别精密吸取“2.2.2、2.2.3”项下溶液,按“2.2.1”项下色谱条件进样,记录色谱图,见图1。由图1可见,在该色谱条件下,盐酸苯海拉明与相邻杂质峰均达到良好分离,分离度大于1.5,理论塔板数均在10000以上,具有良好的分离效果。
图1 HPLC图
2.2.5样品含量测定 取公司F生产的6批次样品,其他生产企业各1批,总共25批样品,各平行2份,按“2.2.3”项下方法制备供试品溶液,按“2.2.1”项下色谱条件测定,计算盐酸苯海拉明的含量,结果见表2和图4。
2.3含量测定 樟脑、薄荷脑、冰片、水杨酸甲酯(气相色谱法)。
2.3.1色谱条件[10-16]phenomen ZB-WAX毛细管柱,0℃~250℃(250℃):60 m×320 μm×0.5 μm;检测器:FID;进样口温度:220 ℃;检测器温度:250 ℃;柱温:150 ℃,维持23 min;流速:1.5 mL·min-1;进样量:2 μL;分流比:15∶1。
2.3.2内标溶液的制备 取萘适量,精密称定,加乙酸乙酯制成每1 mL含5.000mg的溶液,作为内标溶液。
2.3.3混合对照品贮备液的配制 精密称取樟脑、薄荷脑、冰片和水杨酸甲酯对照品适量,加乙酸乙酯溶解,配制成每1 mL含各对照品分别为5.2850 mg,5.4750 mg,5.2750 mg, 6.2000 mg的混合液,摇匀,作为混合对照品贮备液。
2.3.4供试品溶液的配制 取本品175 cm2,除去盖衬,剪成条状,置250 mL烧瓶中,加水100 mL,照挥发油测定法,自测定器上端加水充满刻度部分,并溢流入烧瓶为止,再加甲苯2 mL,加热回流3 h,放冷,将挥发油测定器中的液体转移至分液漏斗中,分取有机溶剂层,置预先精密加入5 mL内标溶液的25 mL量瓶中,以适量乙酸乙酯分次洗涤冷凝管、挥发油测定器及分液漏斗,洗涤液并入上述量瓶中,加乙酸乙酯至刻度,摇匀,作为供试品溶液。
2.3.5系统适用性实验 精密量取混合对照品贮备液与内标溶液适量,加乙酸乙酯稀释至一定的浓度,分别精密吸取上述溶液与供试品溶液,按“2.3.1”项下色谱条件进样,记录色谱图,见图2。由图2可见,在该色谱条件下,樟脑、薄荷脑、冰片、水杨酸甲酯、萘与其他成分可达到基线分离,分离度大于1.5,理论塔板数均在50000以上,具有良好的分离效果。
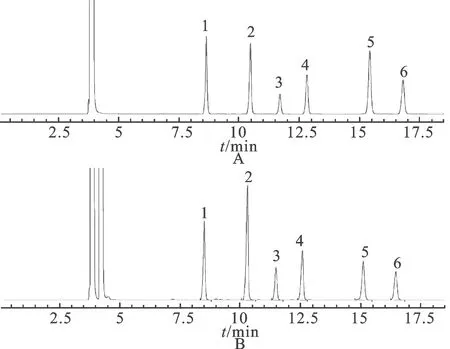
图2 GC图
2.3.6线性关系考察 精密量取混合对照品贮备液0.5,1.0,2.0,4.0,8.0 mL,分别置于10 mL量瓶中,各精密加入内标溶液2 mL,乙酸乙酯定容至刻度,摇匀,按“2.3.1”项下色谱条件进样,以各峰面积与内标峰面积之比为纵坐标(Y),待测物浓度为横坐标(X,mg·mL-1)进行线性回归,得樟脑回归方程为Y=0.7297X+0.0199,r=0.9999,薄荷脑回归方程为Y=0.7005X+0.0459,r=0.9998,冰片回归方程为Y=0.7516X+0.0041,r=0.9999,水杨酸甲酯回归方程为Y=0.4627X-0.0021,r=0.9998。结果表明:在樟脑、薄荷脑、冰片、水杨酸甲酯分别在0.261~4.172 mg·mL-1、0.274~4.380 mg·mL-1、0.258~4.136 mg·mL-1、0.309~4.944 mg·mL-1范围内呈良好的线性关系。
2.3.7方法学考察 经精密度、重复性、稳定性及加样回收率实验,结果均符合《中国药典》收载的“药品质量标准分析方法验证指导原则”的要求。
2.3.8回收率实验 取已知含量的麝香壮骨膏(编号39),共6份,各取本品90 cm2,除去盖衬,剪成条状,置250 mL烧瓶中,浓度为樟脑8.943 mg·mL-1、薄荷脑12.98 mg·mL-1、冰片10.85 mg·mL-1、水杨酸甲酯9.168 mg·mL-1的混合对照品溶液1 mL,按“2.3.4”项下方法制备供试品溶液,按“2.3.1”项下色谱条件测定,计算樟脑、薄荷脑、冰片、水杨酸甲酯的含量,计算回收率,结果其回收率平均值依次为樟脑97.12%(RSD=1.37%,n=6)、薄荷脑97.02%(RSD=1.35%,n=6)、冰片96.89%(RSD=1.24%,n=6)、水杨酸甲酯96.45%(RSD=1.46%,n=6)。
2.3.9样品含量测定 取公司F生产的6批次样品,其他生产企业各1批,总共25批样品,各平行2份,按“2.3.4”项下方法制备供试品溶液,按“2.3.1”项下色谱条件测定,计算樟脑、薄荷脑、冰片、水杨酸甲酯的含量,结果见表2和图5。
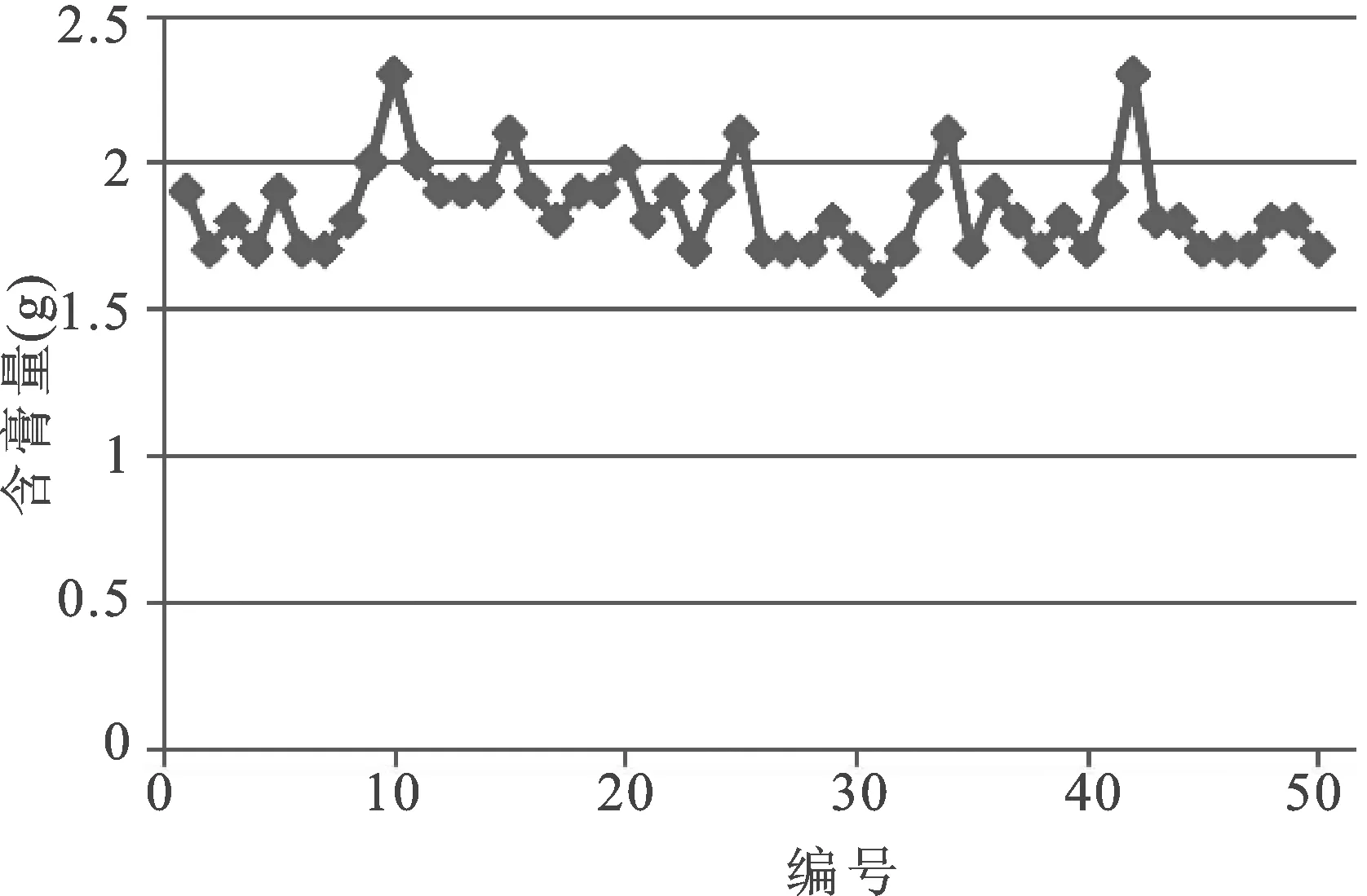
图3 含膏量分布图

图4 盐酸苯海拉明含量分布图
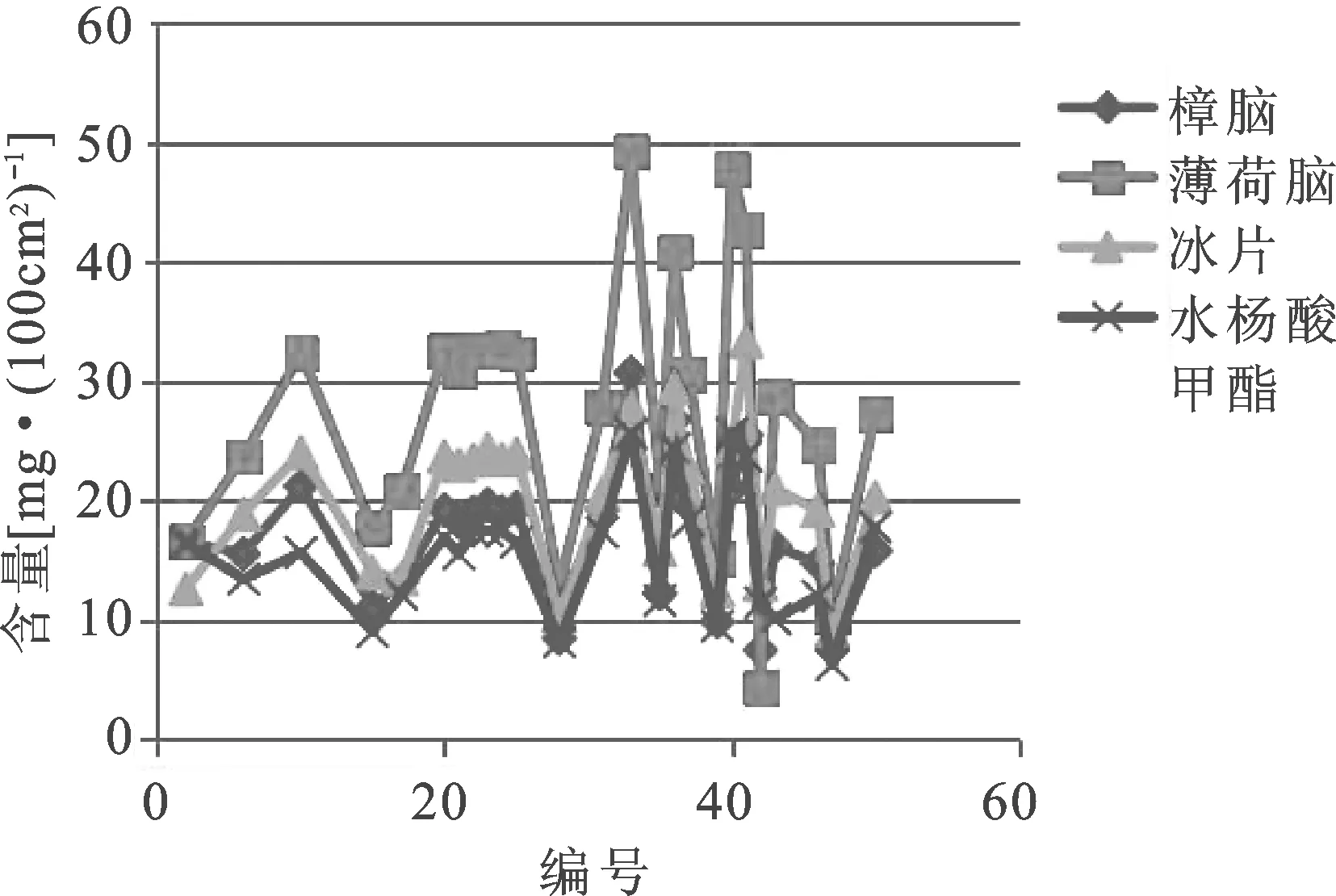
图5 樟脑、薄荷脑、冰片和水杨酸甲酯含量分布图

表2 麝香壮骨膏中含膏量、盐酸苯海拉明、樟脑、薄荷脑、冰片、水杨酸甲酯的测定结果(n=2)

续表2 麝香壮骨膏中含膏量、盐酸苯海拉明、樟脑、薄荷脑、冰片、水杨酸甲酯的测定结果(n=2)
3 讨论
3.1按法定标准检验结果 按照现行法定标准检验,50批样品均符合所执行的标准规定。
20个生产厂家50批样品含膏量范围1.6~2.3 g,平均值为1.8 g,RSD为8.4%,相差较大;同个企业不同批号的含膏量相对比较稳定,不同企业的含膏量差别较大,可能与生产工艺中的涂膏有关系,各个企业间涂胶工艺的差别引起含膏量的差异。除涂胶工艺外,含膏量也可能与膏体表面有无孔有一定的关系,两个现行标准都未对膏体的是否有孔及孔面积大小进行规定,也未说明计算含膏量是否要扣除孔面积[17-18]。
公司F生产的6批次样品,100 cm2含樟脑为18.19~19.64 mg,平均值为19.08 mg,RSD为2.6%;含水杨酸甲酯为15.50~17.43 mg,平均值为16.85 mg,RSD为4.6%;含盐酸苯海拉明为5.95~7.31 mg,平均值为6.70 mg,RSD为8.1%。樟脑、水杨酸甲酯的含量RSD均小于5%,含量差异较小,说明不同批次投料情况稳定,工艺对两者含量影响较小;而盐酸苯海拉明的含量差异较大,如投料情况稳定,则生产工艺对该成分存在一定影响,生产过程容易造成损失。生产企业需要把握好膏剂生产工艺,保持处方工艺稳定,最终保证药品质量均一、可控。
3.2挥发性成分(樟脑、薄荷脑、冰片和水杨酸甲酯)的含量测定 麝香壮骨膏中的挥发油类成分为其主要有效成分,其主要镇痛消炎成分为樟脑、薄荷脑、冰片和水杨酸甲酯,本实验建立了同时测定麝香壮骨膏中该4种有效成分含量的方法。所抽取的25批样品,每100 cm2含樟脑为7.44~30.71 mg,平均值为17.07 mg,最大值与最小值相差4倍多;含薄荷脑为4.33~49.28 mg,平均值为27.53 mg,最大值与最小值相差11倍多;含冰片为9.09~33.34 mg,平均值为20.17 mg,最大值与最小值相差3倍多;含水杨酸甲酯为6.22~25.62 mg,平均值为15.57 mg,最大值与最小值相差4倍多。公司F生产的6批次样品标准方法以外两种成分含量为每100 cm2含冰片平均值为23.63 mg,RSD为2.0%,含薄荷脑平均值为32.31 mg,RSD为2.2%;其他生产企业的19批样品每100 cm2含樟脑平均值为16.44 mg,RSD为40.2%,含水杨酸甲酯为平均值为15.16 mg,RSD为40.4%,含冰片平均值为19.08 mg,RSD为35.6%,含薄荷脑平均值为26.02 mg,RSD为48.1%。
从樟脑、薄荷脑、冰片和水杨酸甲酯这4种挥发性成分含量测定结果可以看出,不同生产企业的产品差别甚大,质量参差不齐;公司F生产的麝香壮骨膏质量较为稳定,挥发性成分含量控制的较好。这与企业投料的量和生产工艺有关,假设企业的投料量均符合要求,如果企业采用溶剂法生产橡胶膏剂,工艺中由于要加热,许多挥发性药物就会随溶媒一起蒸发而损失掉。因此其成分含量较低的企业要控制好投料的量,重点要改善其生产工艺,减少挥发性成分在生产过程中的损失[19]。项目组认为有必要对麝香壮骨膏种该4种挥发性成分进行质控,以提高该产品的质量,确保不同生产企业之间产品的均一性、稳定性。建议樟脑和水杨酸甲酯的含量限度采用现行法定标准2中的规定(每100 cm2含樟脑限度为不得少于12.0 mg、含水杨酸甲酯限度为不得少于9.0 mg);从现行法定标准2可以看出,樟脑和水杨酸甲酯的含量限度值约为投料的40%,参照该要求,建议每100 cm2含冰片限度为不得少于12.0 mg和含薄荷脑限度为不得少于16.0 mg。4种挥发性成分按照建议执行的限度标准,25批样品中樟脑含量低于12.0 mg的有5批,水杨酸甲酯含量低于9.0 mg的有2批,冰片含量低于12.0 mg的有2批,薄荷脑含量低于16.0 mg的有4批。
3.3盐酸苯海拉明的含量测定 麝香壮骨膏处方中含有的盐酸苯海拉明可缓解患者在使用过程中出现的过敏症状。所抽取的25批样品,每100 cm2含盐酸苯海拉明为0.13~10.11 mg,平均值为5.42 mg,最大值与最小值相差77倍。公司F生产的6批次样品盐酸苯海拉明含量的平均值为6.70 mg,RSD为8.1%,其他19批平均值为5.02 mg,RSD为48.6%。
盐酸苯海拉明含量测定结果表明不同生产企业的产品中盐酸苯海拉明含量差别极大,质量情况不容乐观;相比较,公司F生产的麝香壮骨膏对盐酸苯海拉明含量控制较好,质量更为稳定。个别生产企业盐酸苯海拉明的含量与处方量极不匹配,项目组认为在企业投料都符合要求的前提下,可能与生产企业的生产工艺有关,盐酸苯海拉明在光、湿、热和酸碱条件下,容易氧化降解生成二苯酮等物质,生产企业在控制其投入的量的同时,也要防止盐酸苯海拉明在生产过程中被破坏[20]。建议盐酸苯海拉明的含量限度采用现行法定标准2中的规定(每100 cm2含盐酸苯海拉明限度为4.8~7.4 mg)。按照此标准,25批样品中有3批超出限度上限7.4 mg、8批低于限度下限4.8 mg。
3.4小结 按照所执行的标准检验,50批麝香壮骨膏的合格率为100%,显示市售麝香壮骨膏的质量情况较好。但是,项目组通过对其中25批样品的盐酸苯海拉明和4种挥发性成分(樟脑、薄荷脑、冰片和水杨酸甲酯)含量的测定,发现不同生产企业的麝香壮骨膏质量差异甚大,产品稳定性、均一性较差,其中执行较高标准的公司F所生产的麝香壮骨膏质量较为稳定。为了更好控制麝香壮骨膏的质量,建议该品种执行统一的标准,并增加盐酸苯海拉明、樟脑、薄荷脑、冰片和水杨酸甲酯含量测定。

