黑曲霉转化穿山龙皂苷制备prosapogenin B 工艺的探究
高 鑫,王安琪,何正有,毕建军,蒋 用,李 佳,汤秀强
(四川省药物制剂及装备工程技术研究中心,四川抗菌素工业研究所,成都大学药学院,四川 成都 610106)
穿山龙为薯蓣科植物穿龙薯蓣Dioscorea nipponicaMakino 的干燥根茎,具有祛风除湿、舒筋活血等功效[1],主要含有甾体皂苷成分,如薯蓣皂苷、纤细薯蓣皂苷、原薯蓣皂苷、原纤细薯蓣皂苷等[2],具有抗肿瘤、抗炎、增强免疫、心血管活性等药理活性[3⁃4]。但这些甾体皂苷分子一般含有较长的糖链,具有极性较大、生物利用率低、药理活性弱等缺点[5],往往经体内微生物或酶分解成短糖链皂苷或苷元再被胃肠道吸收而进入血液循环系统,从而发挥药理活性[6]。然而,不同个体或同一个体在不同时间,其体内的微生物群或酶系都有显著性差异,对皂苷类物质的生物转化和入血吸收能力也因人因时而异,在临床上就体现出中药疗效的个体差异或时间差异,这也是造成中药疗效不稳定的主要原因[7⁃8]。为了进一步研究穿山龙皂苷的构效关系、药理活性及其体内过程,有必要规模化地制备出一系列短糖链的穿山龙皂苷或苷元。目前,制备短糖链皂苷或苷元的方法主要有物理法、化学法和生物法,其中物理法和化学法具有反应速度快的优点,但存在水解产物化学结构不可控和产量低等缺陷[9];生物转化法具有结构专一性强、反应速度可控、产量高等优点[10]。因此,本实验将研究穿山龙皂苷的生物转化途径及其相关产物,以期制备出不同糖链的皂苷成分,为深入研究其构效关系、药理活性和体内过程提供参考。
1 材料与方法
1.1 材料
1.1.1 菌种库 红曲霉(Monascus purpureusWent CGCC 3.570)、毛霉菌(Mucor sp.CGMCC 3.25)、黑曲霉(Asperillus nigerCICC 2462)、醋杆菌(AcetobacterCICC 7000)、发酵乳杆菌(Lactobacillus fermentumCGMCC 1.2133)、干酪乳杆菌(Lactobacillus caseiCICC 6007),均为实验室保存菌种。
1.1.2 菌种液体培养基 红曲霉、毛霉菌、黑曲霉培养基为每1 000 mL 培养液中含马铃薯200 g(用纯化水煮沸0.5 h 过滤)、硫酸镁1.5 g、磷酸二氢钾3 g、VB24 片(含有VB 240 mg)。发酵乳杆菌、干酪乳杆菌培养基为每1 000 mL 培养液中含有蛋白胨10 g、牛肉浸取物10 g、酵母提取液5 g、葡萄糖5 g、乙酸钠5 g、柠檬酸二胺2 g、磷酸氢二钾2 g、七水硫酸镁0.2 g、七水硫酸锰0.05 g、吐温80 0.1 g。
1.1.3 底物 穿山龙皂苷提取物(实验室自制,总皂苷含量为41.25%)。
1.2 仪器 GF25 型4 硅胶板(青岛海洋化工厂分厂);LDZM⁃80KCS⁃Ⅲ立式压力蒸汽灭菌器(上海申安医疗器械厂);ZWY⁃2102 恒温培养振荡器(上海智诚分析仪器有限公司);Agilent 1260 Series高效液相色谱仪(美国安捷伦公司)。Ultimate C18键合硅胶柱(250 mm×4.6 mm,5 μm)、反相硅胶层析填 料 C18(Dima)、Sephadex LH⁃20(GE Healthcare)。正丁醇、甲醇、乙醇等试剂均为分析纯(成都市科隆化学品有限公司);乙腈(国药集团化学试剂有限公司)。对照品薯蓣皂苷薯蓣皂苷元(纯度≥98%,成都市卓谱仪器有限公司)。
2 方法
2.1 微生物转化菌种的筛选 菌种筛选实验分为转化实验组和无底物空白组,在150 mL 的摇瓶中加入50 mL 相应的菌种液体培养基,向转化实验组中加入穿山龙皂苷提取物,使每50 mL 培养基中含有92 mg 穿山龙皂苷提取物,无底物空白组不做处理。所有培养基于121 ℃下高压灭菌30 min,然后向转化实验组和无底物空白组接种各个菌种,接种量为16%,28 ℃、220 r/min 下摇瓶培养5 d,取样检测。使用TLC 法检测转化产物,筛选出具有转化能力的菌种。
2.1.1 对照品溶液制备 制备质量浓度约1 mg/mL的薯蓣皂苷、薯蓣皂苷元对照品溶液。
2.1.2 样品溶液制备 分别收集转化液,滤过,减压浓缩,蒸发皿水浴干燥,称量后甲醇溶解制备成一定浓度。取薄层硅胶板,置于105 ℃恒温烘箱中活化30 min,取出,放于干燥器中冷却至室温,点样,使用二氯甲烷⁃甲醇(20 ∶1)展开剂展开,溶剂挥发完后喷10%硫酸乙醇溶液,于105 ℃烘箱中显色至斑点清晰,在365 nm 紫外线下观察。
2.2 转化产物扩大培养 设转化组与底物对照组,向2 组中加入穿山龙皂苷提取物,每500 mL 液体培养基中含有920 mg 穿山龙皂苷提取物,共配制3 000 mL,分装于750 mL 摇瓶中,每瓶150 mL,于121 ℃下高压灭菌30 min,放冷。底物对照组不加入菌种,转化组接入筛选出的菌种,接种量为16%,培养温度为28 ℃,摇床转速为220 r/min,2 组在相同条件下培养5 d,收集转化液。
2.3 转化产物的提取和分离纯化 将收集的转化液进行抽滤,收集滤液,低温浓缩滤液至小体积,用等体积的水饱和正丁醇萃取3 次,合并所有水饱和正丁醇层,将水饱和正丁醇层于40 ℃进行浓缩,减压真空干燥转化产物。将得到的干燥转化产物用反相硅胶柱层析分离,用乙腈⁃水(65 ∶35、70 ∶30、65 ∶25)依次进行洗脱,收集洗脱液,经凝胶柱层析纯化,二氯甲烷⁃甲醇⁃水(36 ∶6 ∶0.1)进行洗脱,收集洗脱液,干燥得化合物A(44 mg)。
2.4 转化产物分析
2.4.1 色谱条件 Ultimate C18色谱柱(4.6 mm ×250 mm,5 μm);流动相水(A)⁃乙腈(B),梯度洗脱,程序见表1;体积流量1 mL/min;柱温25 ℃;检测波长203 nm;进样量20 μL。
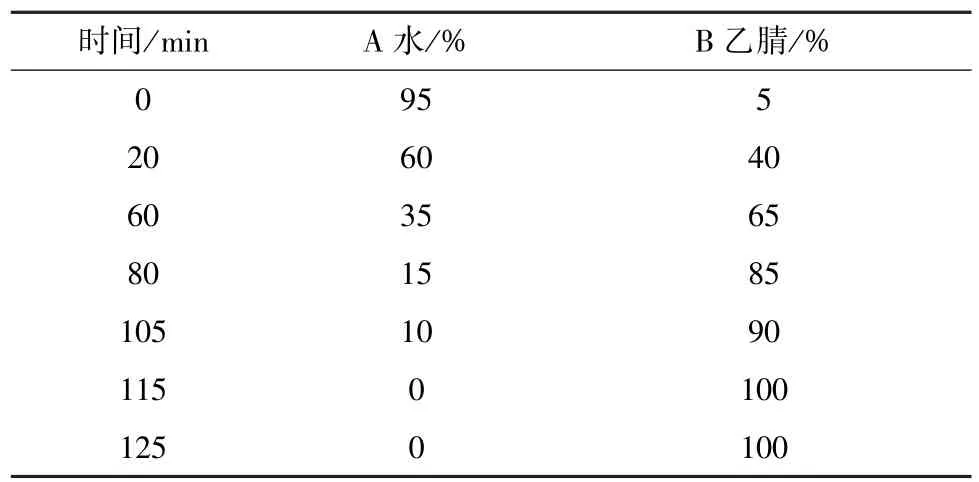
表1 梯度洗脱程序Tab.1 Gradient elution programs
2.4.2 对照品溶液制备 精密称取薯蓣皂苷、薯蓣皂苷元对照品适量,甲醇溶解制成质量浓度为0.310、0.396 mg/mL 的溶液。
2.4.3 样品溶液制备 将转化组与底物对照组的转化液抽滤,浓缩至小体积,水饱和正丁醇⁃转化液(1 ∶1)萃取3 次,合并正丁醇层,蒸干,取适量至10 mL 量瓶中,甲醇定容。化合物A 转化率=
3 结果
3.1 菌种筛选 TLC 检测结果见图1、表2,可知只有黑曲霉对穿山龙皂苷具有转化作用;图1 黑曲霉转化液中的薯蓣皂苷的斑点几乎消失,同时出现了新的化合物斑点,其形状较大并呈淡蓝色,Rf值位于薯蓣皂苷和薯蓣皂苷元之间。

图1 穿山龙经不同菌种转化后TLC 图谱Fig.1 TLC chromatogram for D.nipponicae after different strains⁃mediated transformation

表2 不同菌种对薯蓣皂苷转化TLC 检测结果Tab.2 TLC detection results of dioscin transformation by different strains
3.2 结果分析 图2 显示,与底物对照组比较,转化组出现了1 个原本不存在的色谱峰,出峰时间为83.3 min,位于薯蓣皂苷与薯蓣皂苷元之间,表明其极性也处于两者之间,推测可能为低取代糖链的甾体皂苷,与TLC 结果相似。根据峰面积计算,化合物A 含量占转化液的24.35%,总皂苷转化率达到59%。
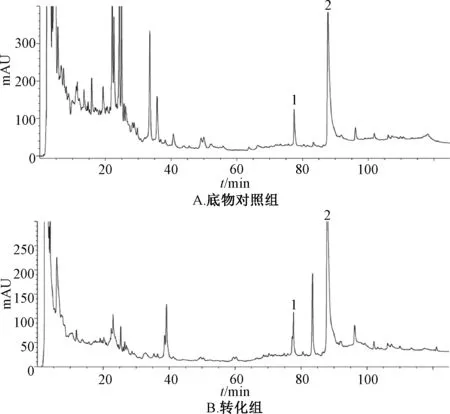
图2 各成分HPLC 色谱图Fig.2 HPLC chromatograms of various constituents
3.3 结构鉴定 通过1H⁃NMR、13C⁃NMR 数据和相关文献进行解析。化合物A:白色粉末,共44 mg,纯度95.3%,分子式C39H62O12。ESI⁃MSm/z:745[M+Na]+。1H⁃NMR(600 MHz,Pyridine⁃d5)δ:4.91(1H,d,H⁃1′),3.94(1H,t,H⁃2′),4.42(1H,t,H⁃4′),5.86(1H,s,H⁃1″),4.65(1H,d,H⁃2″),4.32(1H,t,H⁃4″);13C⁃NMR(600 MHz,Pyridine⁃d5)δ:140.6(C⁃5),121.6(C⁃6),109.1(C⁃22),102.5(C⁃1′),102.2(C⁃1″),80.9(C⁃16),78.0(C⁃3),77.0(C⁃5′),76.5(C⁃3′),75.4(C⁃2′),73.8(C⁃4″),72.6(C⁃2″),72.5(C⁃3″),70.2(C⁃5″),66.6(C⁃26),62.6(C⁃),61.3(C⁃6′),56.4(C⁃14),50.0(C⁃9),41.8(C⁃20),40.2(C⁃13),39.6(C⁃12),39.1(C⁃4),37.2(C⁃1),36.8(C⁃10),32.0(C⁃2),32.0(C⁃7),31.6(C⁃8),31.4(C⁃15),30.4(C⁃25),30.0(C⁃23),29.0(C⁃24),20.9(C⁃24),19.2(C⁃19),18.4(C⁃6″),17.1(C⁃27),16.2(C⁃18),14.9(C⁃21)。以上数据与文献[11] 基本一致,故鉴定为prosapogenin B。
4 讨论
目前,关于穿山龙皂苷微生物转化的研究大多集中于薯蓣皂苷元的获得[12],很少寻找新的先导化合物。赵桂云等[13]从黄山药根部土壤中筛选出了一株能够转化穿山龙干粉的菌种,能将穿山龙干粉直接转化为薯蓣皂苷元,转化率为7.37%;Liu等[14]通过米曲霉中提取的酶对穿山龙皂苷进行转化,获得了重楼皂苷E,产率较高;Zhang 等[15]从穿山龙根茎中筛选出了一株米曲霉,对穿山龙进行微生物转化,得到新化合物薯蓣皂苷E 和薯蓣皂苷F;本研究筛选出一株黑曲霉,它能有效转化穿山龙皂苷,得到了原穿山龙皂苷中不含有的prosapogenin B,总皂苷转化率可达59%。
prosapogenin B 是双糖甾体皂苷,能抑制许多人癌细胞增殖,诱导白血病K562 细胞以及大肠癌HCT⁃15 细胞的凋亡[16]。穿山龙皂苷含有薯蓣皂苷,但转化后其含量有所减少,即生成了新化合物,可能的转化途径见图3。薯蓣皂苷的糖基部分含有1 个葡萄糖和2 个鼠李糖。β⁃D葡萄糖的2,4位分别连有1 个鼠李糖,其中以1,2 糖苷键连接的鼠李糖被水解,留下了以1,4 糖苷键连接的鼠李糖,产生了1 个β⁃D葡萄糖1,4 连接α⁃L鼠李糖的薯蓣皂苷衍生物。由此推测,黑曲霉能够特异性识别薯蓣皂苷的L⁃鼠李糖⁃(1→2)⁃β⁃D葡萄糖位点,并同时产生了能够水解该位点的特异性水解酶,对该位点进行专一性水解,高效获得产物。因此,可以通过黑曲霉快速有效的获得2 个糖取代的低取代薯蓣皂苷的次生皂苷。
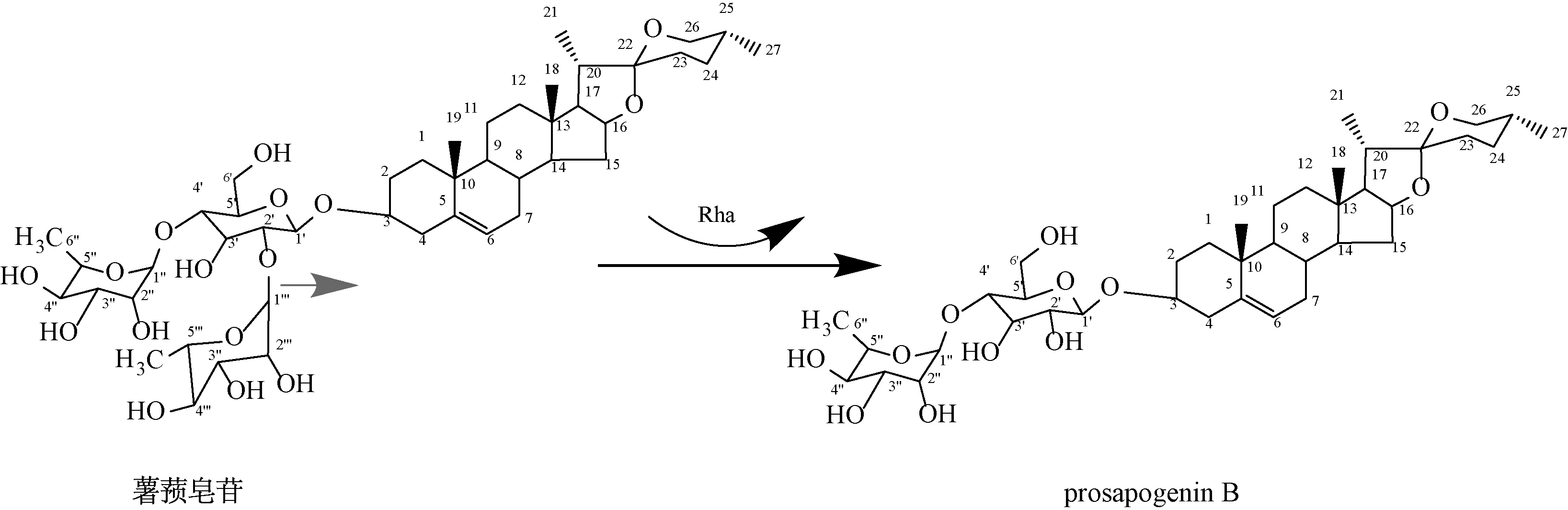
图3 黑曲霉对穿山龙皂苷可能的转化途径Fig.3 Possible pathway for Aspergillus niger⁃mediated transformation of D.nipponica saponins
综上所述,本实验采用黑曲霉对穿山龙皂苷进行转化,获得了低取代糖的皂苷prosapogenin B,并且转化率较高,为低糖链皂苷的制备提供了研究思路,即可采用微生物转化的方法或从具有转化能力的菌种中筛选特异性转化酶,制备低糖基取代的皂苷,从而为相关药理活性与构效关系的研究提供基础。

