动态对比增强MRI定量参数预测局部进展期胃癌病理类型
付 佳,石清磊,李子禹,朱海峰,吴卫平,李晓婷,李佳铮,刘一婷,唐 磊*
(1.北京大学肿瘤医院暨北京市肿瘤防治研究所医学影像科,3.胃肠肿瘤中心 恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142;2.西门子医疗系统有限公司磁共振事业部,北京 100096;4.北京民航总医院放射科,北京 100123)
我国是胃癌高发国家,且50%以上胃癌处于局部进展期。不同分化程度胃癌的生物学行为不同,对治疗的敏感度存在差异,低分化腺癌及Lauren弥漫型预后相对较差[1]。采用无创方法于术前预测胃癌病理类型具有重要意义。动态对比增强MRI(dynamic contrast enhanced MRI,DCE-MRI)是在血流动力学效应基础上量化病变及组织内的血管内外对比剂含量的MR功能成像技术之一,已初步用于评估部分肿瘤的组织学分级[2-3]。本研究观察DCE-MRI参数预测局部进展期胃癌分化程度及Lauren分型的价值。
1 资料与方法
1.1 研究对象 回顾性分析2014年9月—2016年2月48例于北京大学肿瘤医院经术后病理证实的胃癌患者,男34例,女14例,年龄35~79岁,平均(60.0±9.9)岁;31例累及胃窦、9例累及胃体、8例累及食管胃结合部。纳入标准:①CT联合内镜判断为局部进展期胃癌(cT2-4N0-3M0);②无 MR扫描禁忌证;③初次MR检查前未接受任何抗肿瘤治疗。排除标准:①资料不完整;②图像质量不佳。检查前患者均签署知情同意书。
1.2 仪器与方法 采用Siemens Magnetom Aera 1.5T超导型MR仪,配备8通道体部高分辨相控阵线圈。嘱患者禁食12 h、禁水2 h,检查前10~15 min予肌内注射20 mg盐酸消旋山莨菪碱(654-2,杭州民生药业有限公司)抑制胃肠蠕动,确定低张起效后嘱患者饮水800~1 000 ml以充盈胃腔。嘱患者仰卧,头先进,双上肢置于身体两侧,采用目视联合手触方法训练患者稳定屏气及均匀呼吸。采集轴位容积内插水脂分离快速扰相(Dixon volumetric interpolated breath-hold examination,Dixon-Vibe)TlWI,TR 6.69 ms,TE 2.39 ms,层厚3 mm,层间距1 mm,矩阵128×128,扫描野380 mm×380 mm,NEX l,扫描层数28层;冠状位半傅立叶单次激发快速自旋回波(half-Fourier acquisition single-shot turbo spin-echo,HASTE)T2WI,TR 2 500 ms,TE 91 ms,层厚6 mm,层间距1 mm,矩阵256×256,扫描野380 mm×380 mm,NEX l,扫描层数28层;轴位刀锋伪影校正(BLADE)T2WI,TR 2 200ms,TE 86 ms,层厚3 mm,层间距1 mm,矩阵128×128,扫描野380 mm×380 mm,NEX 1,扫描层数 28 层。采用具有放射状K空间采样技术的三维容积内插扰相梯度回波科研序列(prototype radial volumetric imaging breath-hold examination withK-space weighted image contrast,Radial-VIBE-KWIC)获取四维动态增强数据,于注射对比剂前扫描基准像,于启动扫描后第3期开始注射对比剂,以流率3 ml/s自肘静脉快速团注对比剂钆喷酸葡胺注射液0.1 mmol/kg体质量,并以相同流率注射生理盐水10 ml,行DCE-MRI,参数:TR 3.78 ms,TE 1.77 ms,FA 12°,层厚3.2 mm,层间距1 mm,扫描野380 mm×380 mm,矩阵256×256;总扫描时间为4 min 4 s。利用“黄金角”模式行K空间数据填充,以K空间共享技术行图像重建,时间分辨率5.5秒/期,共重建43期,0~9.7 s为动脉期,14.6~99.8 s为静脉期,129.1 s后为平衡期。
1.3 图像分析 采用Siemens Syngo MRWP后处理工作站,将原始DCE-MRI数据导入Siemens Medical Systems Tissue 4D图像灌注处理软件,由1名具有3年以上工作经验的放射科医师选择Tofts模型,行运动矫正及图像匹配后,参考TlWI、T2WI,选取静脉期轴位图像显示病灶最大层面,避开肿瘤周围脂肪、胃腔内液体及血管结构,以边缘勾勒法纳入实性肿瘤整体(ROI),排除大片分布特征显著的坏死囊变区域;并根据ROI实际流入动脉信号强度曲线和模型之间拟合的卡方值选择动脉输入函数,软件自动得出容积转移常数(volume transfer constant,Ktrans)、血管外细胞外间隙容积比(extravascular extracellular volume fraction,Ve)及反流速率常数(rate constant,Kep),Kep=Ktrans/Ve[4]。见图1、2。

图1 患者男,77岁,胃窦癌,Lauren弥漫型,低分化腺癌 A.轴位MR T2WI示胃窦增厚(箭);B.轴位T1WI示病灶呈等低信号(箭);C.轴位静脉期DCE-MRI示病灶(箭)呈明显高强化;D.于轴位静脉期DCE-MRI勾画病灶ROI(红色);E~G.测量结果Ktrans=0.27 min-1,Ve=0.48,Kep=0.60 min-1;H.病理图(HE,×50)
1.4 病理学分型 根据肿物生长模式(有无腺管或乳头状结构)和胃壁浸润模式进行Lauren分型[5],包括肠型(n=22)、弥漫型(n=12)和混合型(n=14);根据2010年WHO分类[6],将肿瘤分为低分化(n=19)、中/高分化(n=29)。
1.5 统计学分析 采用SPSS 22.0统计分析软件。以±s表示符合正态分布的计量资料,以中位数(上下四分位数)表示不符合者,组间行Mann-WhitenyU检验。绘制受试者工作特征(receiver operating characteristic,ROC)曲线,计算曲线下面积(area under the curve,AUC),评价DCE-MRI参数预测Lauren弥漫型及低分化腺癌的效能。P<0.05为差异有统计学意义。
2 结果
2.1 DCE-MRI参数 弥漫型胃癌的Ve明显高于肠型+混合型(P<0.05),Kep明显低于肠型+混合型(P<0.05);各型肿瘤的Ktrans差异无统计学意义(P>0.05)。低分化胃癌的Ktrans及Ve均明显高于中/高分化胃癌(P均<0.05),而Kep差异无统计学意义(P>0.05)。见表1。
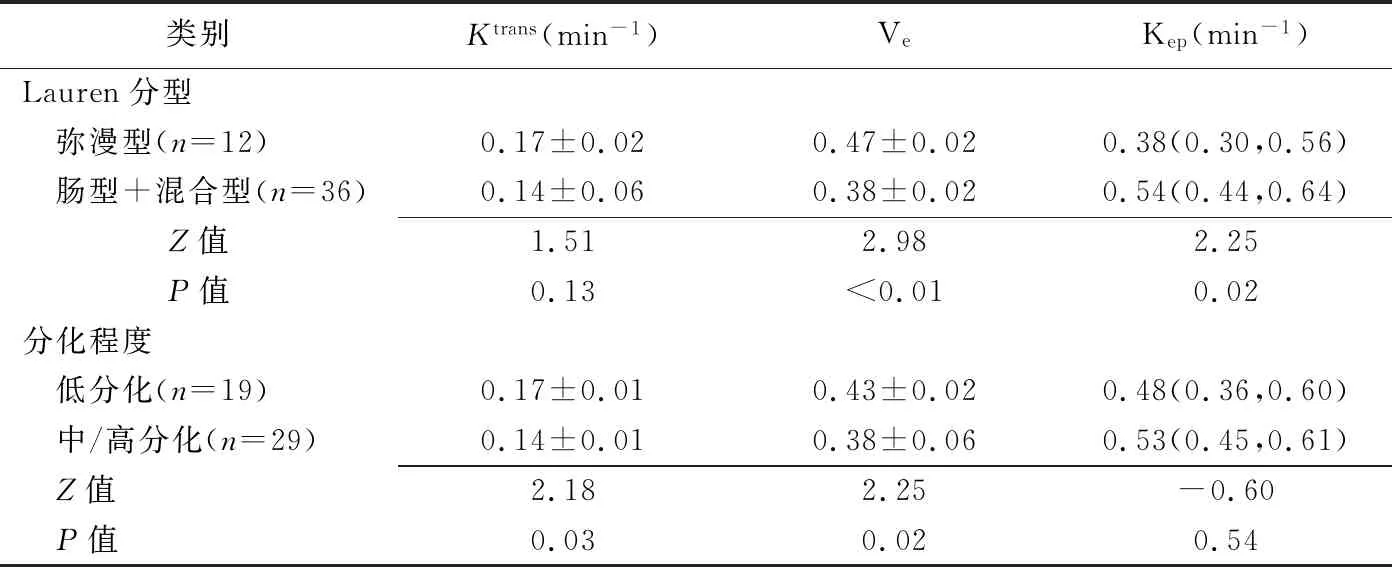
表1 48例局部进展期胃癌DCE-MRI参数比较
2.2 预测效能 Ve预测弥漫型胃癌的AUC为0.79[95%CI(0.66,0.92)],截断值为0.41时,敏感度为91.70%,特异度为72.20%。Kep及Ktrans的ROC曲线差异均无统计学意义(P均>0.05),见图3。

图3 DCE-MRI参数预测弥漫型胃癌的ROC曲线
3 讨论
胃为空腔脏器,受呼吸运动、心脏搏动、胃肠道蠕动及胃壁充盈程度的影响,MR的应用价值有限[7]。为提高图像时间分辨率和质量,本组检查前均予规范处置,包括低张、水充盈法及呼吸训练,且采用具有放射状的K空间采集技术的Radial-VIBE-KWIC序列,扫描速度快,与常规图像相比层厚及层间距小,受部分容积效应影响小[8];该序列采用“辐射状数据线”K空间填充方式,相邻辐射状数据条角度以111.25°恒定值递增,即“黄金角”方案,无论采集数据线量大小,其“辐射状数据线”均可平均分布,故可选择任意时间点T0并围绕其行重建图像。为最大限度减少时间效应所致图像模糊,K空间被分隔成数个半径不等的同心环,按照一定规则,如奈奎斯特准则,确定重建图像所需“辐射状数据线”数目。
本研究发现低分化胃癌的Ktrans及Ve明显高于中/高分化胃癌。Ktrans为对比剂从组织毛细血管内扩散至血管外细胞间隙的速度常数,与血管通透性及内皮细胞表面积相关,以微循环中的对比剂含量变化反映肿瘤血供变化[9]。Ve为单位容积组织内的血管外容积,反映对比剂在血管外间隙的分布,间接体现血管壁的通透性。低分化胃癌异型性及恶性程度均较高,血管壁结构不完整或缺陷更为显著,通透性增加,易引起血管内对比剂分子外漏,即Ktrans及Ve升高[10-11]。JOO等[12]报道,低分化胃癌Ktrans及Ve虽高于中分化胃癌,但差异无统计学意义;本研究结果与之有所不同,考虑与病例分布相关:本组病例均为进展期胃癌,样本量分布不均,且部分低分化胃癌并不具有高Ve和Ktrans值,提示胃癌异质性较强。针对DCE-MRI预测低分化和中/高分化的价值有待进一步探索。
Lauren分型可操作性强,观察者间一致性较高,是胃癌常用组织学分型之一[5]。弥漫型胃癌可见由多个体积较小且近似的细胞组成的微簇,而不形成明确的上皮带;基质中多见分泌细胞及其分泌的黏液散在分布,不形成边缘清晰的肿物[13]。与肠型胃癌相比,弥漫型多倾向于浸润性发展,伴淋巴结转移甚至种植转移[13-15],预后较差。本研究发现弥漫型胃癌Ktrans及Ve均高于混合型+肠型胃癌,但Ktrans差异无统计学意义;Kep明显低于肠型+混合型。MA等[14]认为弥漫型胃癌Ktrans及Ve均明显高于肠型;本研究结果与之不尽相同,可能与本组纳入混合型胃癌及病例数有关,或因弥漫型胃癌中部分间质黏液成分丰富,存在较多增生纤维结缔组织和炎性水肿,影响血管通透性,进而导致相对较低的Ktrans。弥漫型胃癌呈弥漫性生长,细胞排列紧密,多为低分化胃癌,分化差,缺乏细胞连接,内皮细胞连接松散,新生血管增多[14-15],通透性增高,对比剂分子从血管内渗透到血管外间隙,占血管外间隙容积的比例增加,即Ve值增高;肠型胃癌多为中/高分化胃癌,多发生于肠化生背景下,瘤细胞呈柱状或立方型,多有明显腺管样结构,细胞外血管外空间可能相对较大,以转运营养物和处置代谢物。本研究结果显示,Ve截断值取0.41时,预测弥漫型胃癌的效能较好。
Kep代表对比剂自细胞外血管外间隙回返至血管间隙的速率,显示渗漏空间和血浆间流量,间接反映微血管生长状态[2-3]。本组弥漫型胃癌Kep明显低于肠型及混合型胃癌,可能与弥漫型胃癌纤维化成分较多、细胞排列紧密、对比剂回流渗透率低相关[14];而不同分化程度胃癌之间Kep差异无统计学意义,原因可能在于胃癌异质性较强,肿瘤血供及细胞外间隙环境复杂,坏死分布不均[16]。
本研究的主要局限性:①样本量少,未能根据发病部位进一步分组,且各病理分型分布不均;②以单层面勾边法勾画ROI,未考虑病灶的三维结构及测量者间一致性;③各中心所用DCE-MRI定量分析软件不同,药物动力学模型存在差异,可能导致结果差异。
综上,不同Lauren分型及不同分化程度局部进展期胃癌DCE-MRI参数存在差异;Ve预测弥漫型胃癌的效能较高。

