肿瘤治疗中免疫检查点抑制剂相关的感染并发症
王琦琦,李若瑜,刘伟
北京大学第一医院皮肤性病科,国家皮肤与免疫疾病临床医学研究中心,北京大学真菌和真菌病研究中心,北京市皮肤病分子诊断重点实验室,北京 100034
肿瘤通过多种机制来逃避机体免疫系统的监视和攻击,包括改变肿瘤相关抗原表达和表面分子结构、诱导免疫抑制细胞和分泌抑制性细胞因子、建立免疫抑制的肿瘤微环境等,其中免疫检查点通路在肿瘤免疫逃逸中发挥了重要作用[1]。2018年诺贝尔生理学或医学奖授予美国的Allison教授和日本的Honjo教授[2],以表彰他们在细胞毒性T淋巴细胞抗原4(cytotoxic T lymphocyte antigen 4, CTLA-4)和程序性死亡受体1(programmed death receptor 1, PD-1)相关领域研究与应用中所作的杰出贡献。目前,已批准了几种针对免疫检查点通路的抑制剂用于多种肿瘤的治疗,并取得成功[3-5],这是近年来抗肿瘤免疫治疗领域的重要进展。然而,这类新型抗肿瘤药物广泛应用带来相应的毒副作用不容忽视,尤其是随之而来的机会性感染更加值得重视。本文拟针对免疫检查点抑制剂(immune checkpoint inhibitors, ICI)的应用及其所致的感染并发症方面进行综述,以期为相应的防治提供新的认识。
1 T细胞活化和免疫检查点受体
T细胞表面分布识别抗原的T细胞抗原受体(T cell antigen receptor, TCR)和调控活化的共刺激受体,其活化依赖双信号:由抗原提呈细胞(antigen-presenting cells, APC)提呈的抗原肽-主要组织相容性复合体(major histocompatibility complex, MHC)提供给TCR的信号,称为第一信号;APC表面的共刺激分子与T细胞表面相应受体结合后提供给T细胞使之完全活化的信号,称为第二信号[4](见图1A)。常见的共刺激分子有CD80和CD86,相应共刺激受体有两类:①持续表达于T细胞表面并提供T细胞活化第二信号的受体(如CD28);②主要表达于活化T细胞表面并发挥负向免疫调控作用的受体,即免疫检查点受体(immune checkpoint receptors, ICR),包括CTLA-4、PD-1、B和T淋巴细胞衰减蛋白(B and T lymphocyte attenuator, BTLA)、淋巴细胞激活基因3(lymphocyte activation gene 3, LAG3)、T细胞免疫球蛋白和黏蛋白3(T cell immunoglobulin and mucin-3, TIM-3)、腺苷A2a受体(adenosine A2a receptor, A2aR)等[6],分别与各自的配体结合而抑制T细胞功能。
ICR可与配体在T细胞激活和作用的不同阶段进行结合而发挥对T细胞功能的负向调控作用,如CTLA-4、LAG3、TIM-3在T细胞启动阶段限制T细胞激活[6];而PD-1在T细胞效应阶段发挥负向调节作用[7]。正常情况下,接受信号的T细胞在活化的同时上调其表面的ICR,触发抑制T细胞功能的信号通路,使T细胞衰竭,以维持自身免疫耐受、调节免疫平衡[7-8]。肿瘤细胞正是通过上调ICR而抑制T细胞功能,实现免疫逃避;而使用ICI阻断ICR与配体结合,则能减少因ICR上调而对效应T细胞产生的抑制作用,从而改善肿瘤特异性免疫反应,达到有效治疗的作用。以下主要针对PD-1及其配体[程序性死亡配体1(programmed death ligand 1, PD-L1)]以及CTLA-4的ICI进行介绍。
1.1 CTLA-4
CTLA-4(即CD152)是T细胞表面重要的ICR,属于CD28免疫球蛋白超家族,主要表达于活化的CD4+和CD8+T细胞表面。CTLA-4的配体为APC表面的CD80和CD86,主要在淋巴组织中发挥免疫抑制作用。
CTLA-4的作用机制如下:①接受活化信号的T细胞过度表达CTLA-4,通过竞争性结合CD80/CD86来抑制CD28的作用,同时经反式内吞而减少CD80/CD86表达,抑制APC传递给T细胞并使之激活的第二信号[9];②CTLA-4结合了配体,其胞内段免疫受体酪氨酸抑制基序(immune-receptor tyrosine-based inhibition motif, ITIM)中酪氨酸残基被磷酸化而进一步募集酪氨酸磷酸酶(SHP-1),从而使T细胞活化途径中的多个重要信号分子去磷酸化,最终抑制T细胞活化[10];③调节性T细胞(regulatory T cell, Treg细胞)持续性表达CTLA-4,下调APC表面CD80/CD86水平而抑制CD28共刺激信号通路,最终抑制效应T细胞功能[6]。
针对CTLA-4的单克隆抗体通过阻断CTLA-4与CD80/CD86结合,解除其对T细胞的抑制,从而发挥抗肿瘤作用(见图1B)。
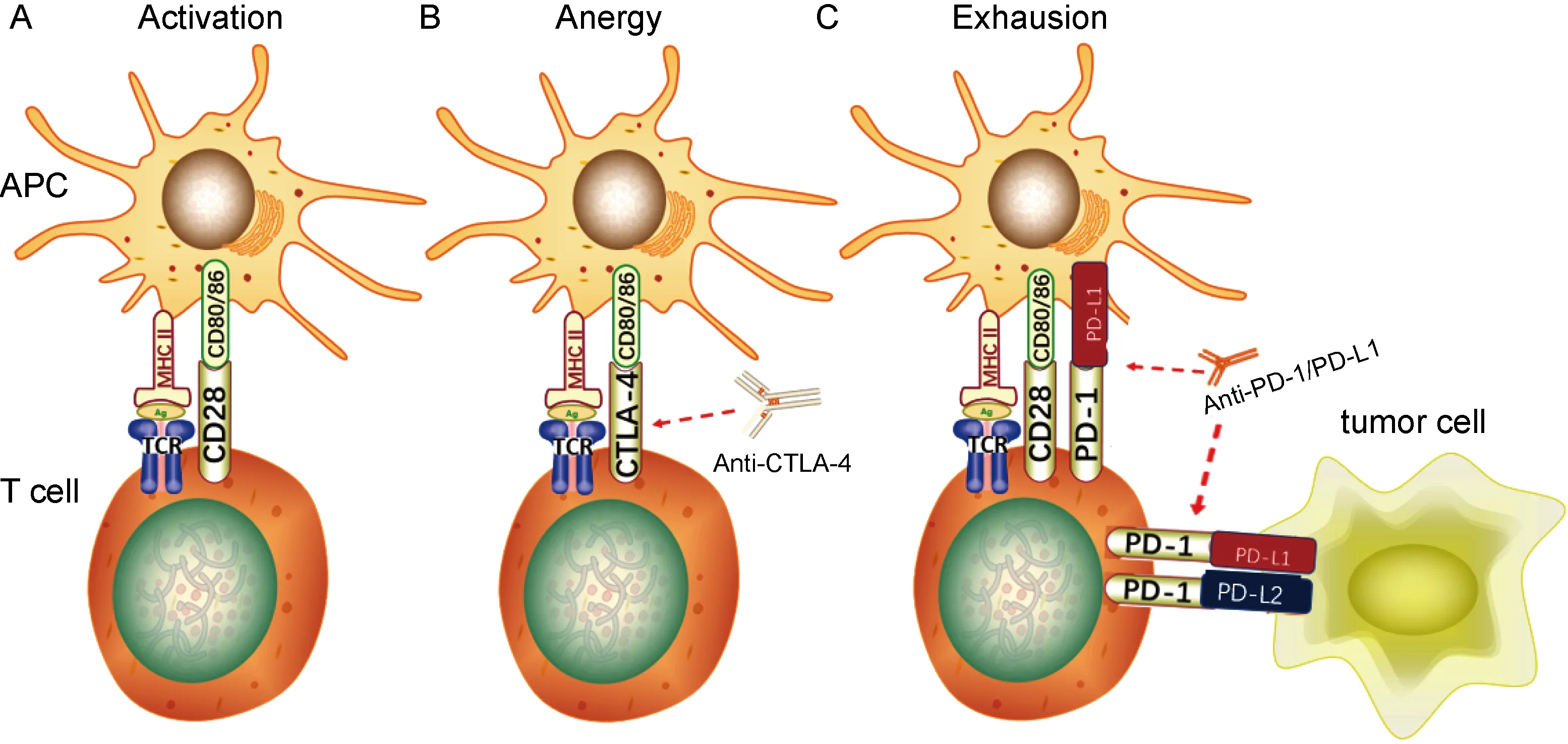
A. T细胞活化依赖双信号:由APC提呈的抗原肽-MHC复合物与T细胞表面TCR结合提供第一信号,APC表面的共刺激分子(如CD80/86)与T细胞表面相应受体(如CD28)结合后提供第二信号; B. CTLA-4通过与CD28竞争性结合CD80/86来抑制T细胞活化的第二信号,使之进入失能状态;抗CTLA-4抗体阻断CTLA-4与CD80/86结合,从而解除对T细胞活化的抑制; C. T细胞表面的PD-1通过与APC、肿瘤细胞表面PD-L1/2结合,抑制TCR信号通路上的关键分子,从而抑制T细胞功能,使其进入衰竭状态;抗PD-1/PD-L1抗体阻断PD-1/PD-L1的相互作用,使T细胞恢复功能。
1.2 PD-1
PD-1(即CD279)是免疫细胞表面另一个重要的ICR,也属于CD28免疫球蛋白超家族,主要表达于活化的CD4+和CD8+T细胞上,也可表达在B细胞、单核细胞、自然杀伤细胞、树突状细胞等细胞表面[7]。PD-1有PD-L1和PD-L2两种配体,PD-L1广泛表达于肿瘤细胞和肿瘤微环境中各种细胞表面,其表达量与许多类型肿瘤(如非小细胞肺癌[11]和黑色素瘤[12])的预后密切相关;而PD-L2的分布较局限,主要在巨噬细胞、树突状细胞和某些B细胞亚类的表面表达,在某些B细胞淋巴瘤(如原发性纵隔B细胞淋巴瘤、滤泡B细胞淋巴瘤和霍奇金病)的B细胞上高度上调[13]。
PD-1与配体结合后可通过免疫受体酪氨酸转换基序(immune-receptor tyrosine-based switch motif, ITSM)来募集含SH2结构域的酪氨酸蛋白磷酸酶[rc homology2(SH2)domain-containg protein tyrosine phosphatase(PTPase), SHP-2],使TCR/CD28信号通路上多个关键分子去磷酸化,抑制T细胞增殖[14]、诱导T细胞耐受和凋亡[15],使肿瘤微环境中T细胞效应功能降低,从而介导肿瘤免疫逃逸。高表达PD-1和PD-L1的Foxp3+Treg细胞通过抑制Akt/mTOR信号通路使初始CD4+T细胞分化为Treg细胞,并通过上调Foxp3来诱导和维持Treg细胞,从而抑制效应T细胞功能[16]。
针对PD-1和PD-L1的单克隆抗体阻断了PD-1/PD-L1相互作用,解除其对T细胞的抑制作用,从而恢复抗肿瘤功能(见图1C)。针对PD-L2的抗体目前还未用于临床。
2 ICI的种类及适应证
目前有以下几种ICI被批准用于治疗各种肿瘤。
Ipilimumab[17]是针对CTLA-4的全人源化IgG1单抗,在2011年被批准用于晚期黑色素瘤,开创了ICI在肿瘤免疫治疗中的先河,并在临床应用中取得令人瞩目的效果[18],是第1种被证实可以延长晚期黑色素瘤患者生存期的药物。
Pembrolizumab[19]和Nivolumab[20]是针对PD-1的IgG4,2014年被批准用于治疗晚期黑色素瘤,随后不断扩大适应证到许多实体瘤(如肺癌、胃癌、结肠癌、尿路上皮癌、宫颈癌等)以及血液系统肿瘤(如霍奇金淋巴瘤)。2015年Nivolumab被批准用于治疗非小细胞肺癌(non-small cell lung cancer, NSCLC)后,因其疗效显著已成为治疗转移性NSCLC的一线药物。另外,Nivolumab与Ipilimumab的联合使用已被批准用于治疗晚期黑色素瘤和肾细胞癌。
Atezolizumab[21],Durvalumab[22]和Avelumab[23]都是针对PD-L1的IgG1单克隆抗体。自2016年来,Atezolizumab和Durvalumab均被批准用于治疗NSCLC和尿路上皮癌,Avelumab被批准用于治疗默克尔细胞癌和尿路上皮癌。
3 ICI主要副作用——免疫相关不良事件
ICI通过阻断ICR与配体结合而解除对效应T细胞的抑制,提高其抗肿瘤免疫作用;然而,ICI在通过非特异性免疫激活而杀伤肿瘤的同时,也可能攻击全身各个脏器,导致一系列免疫相关不良事件(immune-related adverse events, irAEs)。irAEs可表现为全身性或器官特异性,常累及皮肤、胃肠道、肺、内分泌腺、肌肉骨骼等,而心血管、肾脏、眼、神经系统的irAEs相对少见[24]。尽管一般情况下ICI引起的irAEs程度较轻且可逆,但如果出现严重的肺炎、结肠炎、心肌炎、脑炎等并发症时可危及生命。
ICI引起irAEs的具体机制尚未明确,一般认为与阻断ICR后免疫稳态的破坏有关:①ICI阻断T细胞上的ICR导致T细胞功能过度上调,攻击正常组织[25];②肿瘤细胞和正常组织上表达的抗原有交叉,ICI与正常组织的ICR(如垂体组织上的CTLA-4)结合后激活补体系统,从而产生免疫病理损伤[26];③ICI可能导致自身抗体(如甲状腺抗体、抗核抗体等)增加,引起自身免疫反应[27];④ICI可导致炎性细胞因子的释放(如IL-17等),且细胞因子水平与irAEs的严重程度呈正相关[28]。irAEs的本质是免疫系统异常激活导致的非特异性免疫病理损伤,因此常需要糖皮质激素、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)抑制剂或其他免疫抑制剂进行治疗。
4 ICI相关的感染
ICI能够促进T细胞激活、增强效应T细胞功能,理论上不会增加感染的易感性,且目前没有证据表明ICI直接导致感染的风险增加。然而,使用ICI后出现感染的病例报告或回顾性研究并不少见,如Nivolumab治疗的肺腺癌患者出现水痘-带状疱疹病毒(varicella zoster virus, VZV)感染[29],Pembrolizumab治疗的黑色素瘤患者出现播散性芽生菌病[30],Atezolizumab治疗的尿路上皮癌患者出现脓毒症[31]等,尽管这些研究未明确ICI与感染的相关性,但是ICI相关的感染却因此逐渐受到重视。
4.1 ICI相关免疫抑制继发感染
4.1.1 使用免疫抑制剂治疗irAEs研究显示,使用免疫抑制剂治疗ICI引起的irAEs可增加继发感染的风险,例如接受Ipilimumab治疗的黑色素瘤患者由于出现irAEs而使用糖皮质激素或TNF-α抑制剂治疗后继发巨细胞病毒性肝炎[32]、肺孢子菌肺炎(pneumocystis pneumonia, PCP)等[33]机会性感染。一项评估748例接受ICI治疗的黑色素瘤患者出现感染的回顾性研究显示[34],严重感染包括细菌性肺炎、腹腔感染、艰难梭菌相关性腹泻、侵袭性肺曲霉病(invasive pulmonary aspergillosis, IPA)、PCP、巨细胞病毒性结肠炎等。主要危险因素是使用糖皮质激素或TNF-α抑制剂,这类患者发生严重感染的比例为13.5%,而在那些没有接受免疫抑制治疗的患者中仅为2%;与单药治疗者相比,接受Ipilimumab和Nivolumab联合治疗者感染率更高,可能是因为联合用药后irAEs的发生率增加,从而对进一步免疫抑制治疗的需求增加,提示ICI相关感染的风险与治疗irAEs的免疫抑制剂的使用高度相关。
因免疫抑制治疗ICI导致的irAEs是并发感染的主要危险因素,建议使用ICI治疗前先对机会性感染的病原体进行筛查[35],并用生物标志物预测irAEs,对高危人群进行预防以减少机会性感染的发生[26]。在irAEs发病初期,考虑使用新型细胞因子靶向药物以尽早抑制快速进展的病理损伤,缩短免疫抑制病程从而降低感染风险[36]。使用免疫抑制剂治疗irAEs时,可采取一定的预防感染措施,如预防PCP或VZV感染。
4.1.2 ICI导致血细胞减少与传统的细胞毒性化疗药物相比,ICI导致骨髓抑制的风险明显要小,但仍有部分患者使用ICI后出现血细胞减少症状。一项研究Nivolumab和Docetaxel(一种化疗药物)治疗NSCLC的随机对照试验发现,使用两种药物的患者出现淋巴细胞减少症的比例分别为1%和6%,中性粒细胞减少症的比例分别为1%和33%[37]。另外,ICI治疗时也会出现再生障碍性贫血(aplastic anemia, AA)[38-40],其中一名患者的骨髓中发现了T细胞浸润[39],提示ICI通过增强效应T细胞功能而杀伤骨髓造血干细胞,也可能由于T细胞活化而引起针对外周血细胞的自身免疫反应,最终导致相应的血细胞减少。出现血细胞减少症可并发感染,例如:使用Nivolumab治疗的胶质母细胞瘤患者出现AA后并发卡他莫拉菌菌血症[39];另一位使用Nivolumab治疗黑色素瘤的患者出现中性粒细胞减少症后死于感染性休克[41],提示ICI可通过减少白细胞从而降低患者的抗感染能力,进而导致机会性感染。因此,监测全血细胞计数对于使用ICI的患者非常重要,当出现血细胞减少时应及时纠正并酌情进行预防性抗感染治疗。
4.1.3 ICI相关糖尿病继发感染一项评估167名接受Nivolumab治疗的NSCLC患者出现感染并发症的回顾性研究发现[42]:19.2%患者出现感染,包括细菌性肺炎、肺脓肿、IPA等,其中2型糖尿病是独立危险因素;但是这部分患者接受ICI之前即患有糖尿病,其本身为合并感染的高危人群。既往有研究表明,接受ICI治疗的患者出现1型糖尿病(type 1 diabetes mellitus, T1DM)特异性自身抗体及T1DM特异性CD8+T细胞[43],提示ICI阻断ICR后可导致免疫系统非特异性激活,对胰岛β细胞产生自身免疫反应,从而进一步诱导T1DM。虽然ICI诱导T1DM的病例较罕见,但由于糖尿病是合并感染的独立危险因素,所以在使用ICI的患者中应重视监测和控制血糖,并警惕发生机会性感染的可能。
4.2 ICI引起的免疫过度激活
有报道显示,接受Nivolumab或Pembrolizumab治疗而未发生irAEs或无上述免疫抑制症状的患者出现潜伏性结核感染(latent tuberculosis infection, LTBI)的重新激活[44-46],表现为使用PD-1 抑制剂后活动性肺结核迅速进展,提示ICI可能通过增强结核特异性T细胞功能而产生过度免疫反应,使潜伏感染激活,类似于人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染者在开始抗反转录病毒治疗时出现的免疫重建炎症综合征(immune reconstitution inflammatory syndrome, IRIS)。动物实验显示[47],与野生型小鼠相比,PD-1 缺陷小鼠感染结核分枝杆菌后肺部炎症反应和坏死更严重、死亡率更高,提示PD-1/PD-L1通路在限制结核引起的免疫病理损伤中有重要作用,解释了PD-1抑制剂导致LTBI暴发的可能机制。
一名合并慢性进行性肺曲霉病(chronic progressive pulmonary aspergillosis, CPPA)的肺腺癌患者因对传统化疗不敏感而更换使用Nivolumab,肿瘤好转的同时出现CPPA进展[48],提示ICI引起免疫功能上调不仅起到了杀伤肿瘤的作用,还对病原微生物产生过度反应从而导致潜伏感染暴发。
5 结语
ICI作为一种新型免疫疗法,与传统化疗相比更能改善患者预后且安全性较高,是肿瘤治疗领域中革命性的进展。然而,一系列并发症的出现对ICI在临床中的使用提出了新的挑战,这些并发症主要为ICI所致的irAEs,以及随之而来的机会性感染,但ICI与感染的相关性和机制尚不明确。尽管有一些指南在临床实践中有重要的指导意义,但推荐的证据级别较低,未来应设计更多前瞻性实验来评估ICI与感染性疾病的关系,并探究其内在机制,进一步优化诊疗流程,在提高治疗效果的同时降低毒副作用,以造福更多肿瘤患者。

