结核分枝杆菌核糖体蛋白丙氨酸乙酰转移酶过表达菌株的构建及分析
陈润,白嘉诚,狄玉昌,钱嘉宁,毕静,张雪莲,2
1. 复旦大学生命科学学院遗传工程国家重点实验室,上海 200433; 2. 复旦大学上海工业菌株工程技术研究中心,上海 200433
结核分枝杆菌(Mycobacteriumtuberculosis,M.tb)是结核病的病原菌,具有潜伏感染率高和广泛耐药等特点,导致结核病治疗成为世界性难题[1]。此外,从新的角度揭示结核分枝杆菌致病机制也一直是研究难点。本课题组前期研究发现,结核分枝杆菌重要毒力因子异柠檬酸裂解酶(isocitrate lyase,ICL)的酶活性受其第322位和第392位赖氨酸的乙酰化水平调控,进而影响结核分枝杆菌的碳源代谢[2],而潜伏感染相关因子DosR的第182位赖氨酸乙酰化可调控其结合DNA的能力并进一步调控下游靶基因的转录[3],提示乙酰化等蛋白翻译后修饰在病原菌致病中发挥重要作用。
结核分枝杆菌基因组中有20多个具有编码乙酰转移酶结构域的基因,其蛋白乙酰化修饰分为N-ε-乙酰化修饰和N-α-乙酰化修饰,但后者在原核生物中研究较少。核糖体蛋白丙氨酸乙酰转移酶 (ribosomal-protein-alanine acetyltransferase,RimI)属于GCN5相关N-乙酰转移酶(GCN5-relatedN-acetyltransferase,GNAT)家族,携带保守的Q/RxxGxG/Ac CoA结合基序,先后在鼠伤寒沙门菌、大肠埃希菌(Escherichiacoli,E.coli)和结核分枝杆菌中被定性为N-α-乙酰转移酶[4]。RimI的编码基因Rv3420c、GroEL1的编码基因Rv3417c和GroES的编码基因Rv3418c同位于结核分枝杆菌alr-groEL1操纵子,GroEL1和GroES是与结核分枝杆菌毒力密切相关的重要伴侣蛋白[5],但RimI的生物学特性及其与结核分枝杆菌致病性的相关研究尚未见报道。
为探索RimI的生物学特性,本研究利用穿梭质粒pMV261在耻垢分枝杆菌(Mycobacteriumsmegmatis,M.sm)中过表达结核分枝杆菌rimI,通过分析过表达菌株Msm∷pMV261-rimI对细菌生物膜形成、耐胁迫能力及其在巨噬细胞内存活能力的影响,探讨RimI与结核分枝杆菌的毒力及致病性的相关性,期望为深入探究rimI基因在结核分枝杆菌致病中的作用奠定基础。
1 材料和方法
1.1 材料
1.1.1 细胞、菌种与相关质粒小鼠单核巨噬细胞白血病细胞RAW264.7购自中国科学院细胞库。大肠埃希菌DH5α、耻垢分枝杆菌mc2155为本实验室保藏菌种,pMV261质粒为本实验室保藏质粒。
1.1.2 试剂及培养基HindⅢ、BamHI限制性内切酶及T4连接酶、牛小肠碱性磷酸酶(alkaline phosphatase,calf intestinal,CIP)购自美国New England Biolabs公司;Plasmid DNA Extract Kit和DNA Gel Extraction Kit购自美国Axygen公司;聚合酶链反应(polymerase chain reaction,PCR)扩增所用试剂购自南京诺唯赞生物科技股份有限公司;牛血清白蛋白第5组分(bovine albumin fraction V)购自上海艾研生物科技有限公司;Middlebrook7H9、Middlebrook7H10培养基购自美国BD公司;改良杜氏伊格尔培养基(Dulbecco’s modified Eagle medium, DMEM)、胎牛血清、青/链霉素混合液(100×)购自美国ThermoFisher公司;庆大霉素、过氧化氢酶(catalase)购自美国Sigma公司;卡那霉素、葡萄糖、天门冬素、枸橼酸盐、磷酸氢二钾、七水合硫酸镁、枸橼酸铁铵、甘油、亚甲基蓝溶液(100×)、NaCl、油酸、LB固体培养基(Luria-Bertani culture, LB)和其他实验室常用试剂购自生工生物工程(上海)股份有限公司;氨水和盐酸购自中国医药集团有限公司。Middlebrook ADS增菌液为分枝杆菌增菌剂,由bovine albumin fraction V、NaCl、葡萄糖配制而成(本实验室配制)。anti-His tag单克隆抗体购自上海佑隆生物科技有限公司,抗鼠二抗购自美国Proteintech公司。
1.2 rimI过表达菌株的构建
1.2.1 引物设计与合成根据美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)中结核分枝杆菌H37Rv的基因位置及序列设计rimI基因的上下游引物,引物序列分别为:rimI-S 5′-ATAGGATCCGTGACG GCCGACACCGAGCC-3′;rimI-A 5′-TATAAGC TTTCAGTGGTGGTGGTGGTGGTGTGACGGG TCCCCCGAATCCCT-3′。引物的合成以及插入位点的测序由生工生物工程(上海)股份有限公司完成。
1.2.2 pMV261-rimI过表达质粒的构建以结核分枝杆菌基因组为模板扩增rimI基因,在3′端引物中引入6×His tag编码基因序列。目的基因及pMV261质粒经HindⅢ和BamHI酶切并连接后,转入大肠埃希菌DH5α感受态细胞,于含50 μg/mL卡那霉素的LB平板挑取阳性克隆,对酶切结果为阳性的质粒进一步测序验证。
1.2.3 Msm∷pMV261-rimI和Msm∷pMV261菌株的构建通过电转化方法将测序成功的pMV261-rimI质粒和pMV261质粒分别转入耻垢分枝杆菌感受态细胞,涂布于含30 μg/mL卡那霉素的7H10-ADS平板,37 ℃培养2~3 d。长出单克隆后,挑取多个单克隆分别接种于含30 μg/mL卡那霉素的7H9-ADS液体培养基,以100 rpm于振荡培养箱中37 ℃培养2 d。收集对数生长期的菌液10 mL,提取菌体全蛋白,使用anti-His tag抗体进行蛋白质印迹法检测RimI蛋白的表达。
1.3 rimI过表达菌株的生物学特性分析
1.3.1 菌落形态观察收集对数生长期(A600nm=0.6~0.8)的Msm∷pMV261和Msm∷pMV261-rimI菌株各10 mL,室温 3 750 rpm离心10 min,弃上清液,用无菌磷酸盐缓冲液(phosphate buffered saline,PBS)重悬并离心菌体2次。将菌体用 7H9-ADS(含卡那霉素)液体培养基重悬,调整菌悬液密度A600 nm至0.1,10倍梯度稀释至10-5。取100 μL稀释后的菌液涂布于7H10-ADS(含卡那霉素)固体培养基,37 ℃倒置培养4~6 d,用宏观变倍体式显微镜(SteREO Discovery. V20,德国卡尔蔡司公司)观察菌落形态。
1.3.2 生长曲线测定按上述方法制备菌悬液,调整密度A600nm至0.6,按1∶100转接入100 mL 7H9-ADS(含卡那霉素)液体培养基,以100 rpm于振荡培养箱中37 ℃培养。每隔2 h取样,测定细菌A600nm。实验设置3个复孔,重复3次。
1.3.3 生物膜形成按上述方法制备菌悬液,用苏通培养基重悬并离心清洗菌体2次,室温下 3 750 rpm离心10 min,再用苏通培养基(含卡那霉素)调整菌悬液密度A600nm至0.1,稀释20倍,接种于24孔板(1 mL/孔),每菌株设置3个重复孔。在24孔板四周的每孔加入2 mL无菌水,以防止实验孔培养基过度蒸发。最后用封口膜封住24孔板的边缘,于37 ℃培养箱静置培养,每24 h观察1次,于宏观变倍体式显微镜下观察生物膜形成过程。
1.3.4 抗胁迫能力检测按上述方法制备菌悬液,用无菌PBS洗涤,再用不同条件的7H9-ADS培养基[pH 3.0、5.0 mmol/L H2O2,1.0 mmol/L二硫苏糖醇(dithiothreitol,DTT),0.05%~1%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)]重悬菌体(菌悬液密度A600nm均为0.6),以100 rpm于振荡培养箱中37 ℃培养。在不同时间点取样,梯度稀释后涂布于7H10-ADS平板,37 ℃静置培养3 d后进行菌落形成单位(colony-forming units, CFU)计数。低氧处理方式为在15 mL离心管中加入14 mLA600nm为0.6的菌悬液,石蜡封口后于37 ℃静置培养。实验设置4个重复管,其中一个重复管加入终浓度为1%的亚甲蓝,通过观察亚甲蓝褪色来确定氧气耗尽[6]。热应激处理方式为用7H9-ADS培养基重悬菌体(菌悬液密度A600nm均为0.6),用42 ℃和55 ℃的恒温水浴箱分别处理45 min,10倍梯度稀释后涂布于7H10-ADS平板,于37 ℃培养箱倒置培养4~6 d,然后进行菌落计数。
1.3.5 细胞感染实验将培养至对数生长期的菌悬液感染小鼠巨噬细胞RAW264.7(MOI=10),4 h后弃培养基,用PBS洗1次,加入含20 μg/mL庆大霉素的新鲜DMEM培养基处理2 h以杀死胞外菌。弃培养基,用PBS洗3次,加入1 mL DMEM完全培养基,分别于0 h、6 h、1 d、2 d吸弃培养基,用PBS洗1次,再加入1 mL 0.025% SDS裂解细胞。充分裂解后,梯度稀释,涂板,于37 ℃培养箱倒置培养3 d后进行菌落计数。实验重复3次,每次每个样品做3个重复孔。
1.4 统计学方法
实验至少重复3次,所有实验数据均采用t检验统计分析,P<0.05为差异有统计学意义。
2 结果
2.1 RimI编码基因的生物信息学分析
RimI编码基因Rv3420c位于结核分枝杆菌alr-groEL1操纵子,包括Rv3417c(GroEL1)、Rv3418c(GroES)、Rv3419c(TsaD)、Rv3421c(TsaB)和Rv3422c(TsaE)。生物信息学检索发现,耻垢分枝杆菌基因组中也包含RimI的编码基因MSMEG_1579,两者氨基酸序列同源度为68%。耻垢分枝杆菌alr-groEL1操纵子比结核分枝杆菌alr-groEL1多2个独立编码基因,分别为MSMEG_1576和MSMEG_1581。由图1可见,alr-groEL1操纵子中基因的排列顺序在分枝杆菌属高度一致。
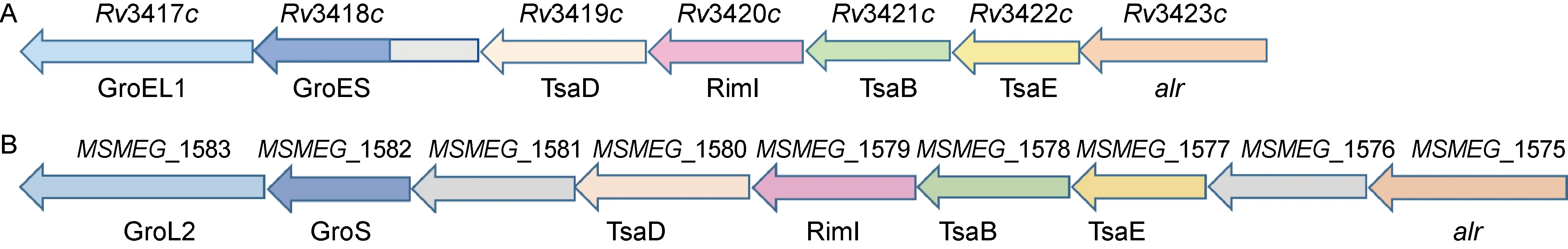
A: M.tb. B: M.sm.
2.2 Msm∷pMV261-rimI构建成功
2.2.1 重组质粒pMV261-rimI的构建采用HindⅢ和BamHI酶切重组质粒,1%琼脂糖凝胶电泳显示条带分别位于500 bp与 4 000 bp处,与目的基因rimI和载体大小一致(见图2)。重组质粒的测序结果与NCBI数据库中rimI序列完全匹配,提示重组质粒pMV261-rimI构建成功。
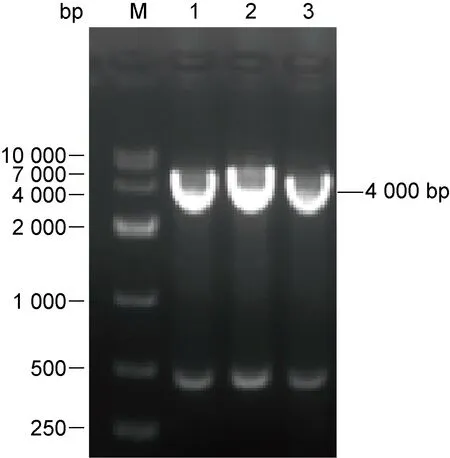
M: 10 000 bp marker; 1-3: Digestion products of recombinant plasmid by BamHI and HindIII. The rimI gene is 500 bp in length, and the plasmid is 4 000 bp in length.
2.2.2 重组耻垢分枝杆菌Msm∷pMV261-rimI的构建使用anti-His tag抗体鉴定Msm∷pMV261-rimI蛋白表达水平。根据考马斯亮蓝染色和蛋白质印迹试验结果(见图3),确定过表达结核分枝杆菌RimI蛋白的Msm∷pMV261-rimI菌株构建成功。
2.3 rimI过表达影响耻垢分枝杆菌的菌落形态
将培养至对数生长期的菌液涂布于7H10-ADS固体平板,培养6 d,待长出完整的单菌落,利用宏观变倍体式显微镜观察菌落形态。结果显示,对照组Msm∷pMV261的菌落边缘较光滑,褶皱和凸起明显变少,菌落呈米白色;而Msm∷pMV261-rimI的菌落表面较干燥,褶皱和凸起较多,整体呈现淡黄色(见图4)。
2.4 rimI过表达减缓耻垢分枝杆菌的生长速率
将Msm∷pMV261-rimI和Msm∷pMV261菌株转接于新的7H9-ADS培养基,15 h后每隔2 h测量培养基A600nm值。结果显示,接种后23~50 h,Msm∷pMV261-rimI菌株的生长速率显著低于Msm∷pMV261菌株 (P<0.000 1),到达稳定期的时间略延迟(见图5),提示外源转入rimI会降低耻垢分枝杆菌前中期的生长速率。
2.5 rimI过表达影响耻垢分枝杆菌的生物膜形成
用不含吐温80的苏通培养基静置培养Msm∷pMV261和Msm∷pMV261-rimI菌株,记录并分析其成膜情况。结果显示,相比于Msm∷pMV261菌株,Msm∷pMV261-rimI菌株的生物膜前期生长速率明显降低,3 d左右时虽然有初期的膜结构出现,但生物膜较薄,褶皱偏少;5 d后生物膜褶皱变多,但依然低于对照组;6 d后部分生物膜开始溶解塌陷,逐渐形成一层平坦的膜(见图6)。
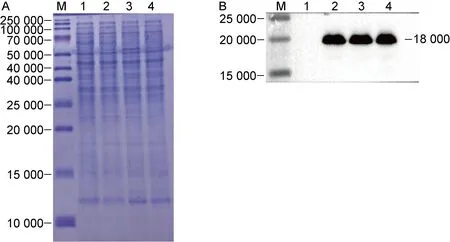
A: Coomassie brilliant blue staining. B: Immuno-localization of anti-His tag protein. M: Prestained protein ladder from 10 000 to 250 000. Line 1: cell lysate of Msm∷pMV261; Lines 2-4: cell lysate of Msm∷pMV261-rimI.
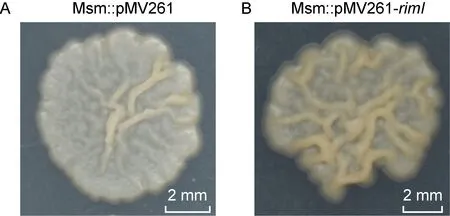
A: Msm∷pMV261. B: Msm∷pMV261-rimI.
2.6 rimI过表达增强耻垢分枝杆菌的抗逆性
模拟巨噬细胞的内环境,评价Msm∷pMV261-rimI菌株耐受低氧、pH 3.0、5.0 mmol/L H2O2、1.0 mmol/L DTT及0.05%~1% SDS的能力,同时评价其耐受高温环境的能力。在低氧条件下加入1%亚甲蓝溶液作为溶解氧指示剂,结果观察到相比于7H9-ADS培养液,两个实验组封闭培养4 h后深蓝色褪为淡青色,封闭培养30 h后基本无色,表示溶解氧基本耗尽,但两组菌株耗氧时间无显著差异(见图7A)。与Msm∷pMV261菌株相比,Msm∷pMV261-rimI菌株耐低氧 (P<0.000 1)、耐酸(P<0.000 1)、耐高温(P<0.001)、抗表面活性剂(P<0.000 1)、抗氧化的能力(P<0.000 1)显著增强(见图7B~7F),但耐受还原剂DTT的能力无明显变化 (P>0.05)(见图7G)。结果提示,结核分枝杆菌rimI过表达增强了分枝杆菌抵抗不利环境的能力。
2.7 rimI过表达增强耻垢分枝杆菌在巨噬细胞内的生存能力
为验证rimI是否与结核分枝杆菌的胞内生存能力相关,将Msm∷pMV261和Msm∷pMV261-rimI菌株分别接种于鼠巨噬细胞RAW264.7。结果显示,在相同感染条件下,Msm∷pMV261-rimI菌株的侵染效率明显高于Msm∷pMV261菌株(P<0.000 1),且在感染2 d内Msm∷pMV261-rimI菌株的胞内存活能力显著强于Msm∷pMV261菌株(P<0.001)(见图8),提示rimI过表达能够显著增强耻垢分枝杆菌感染及胞内生存能力。
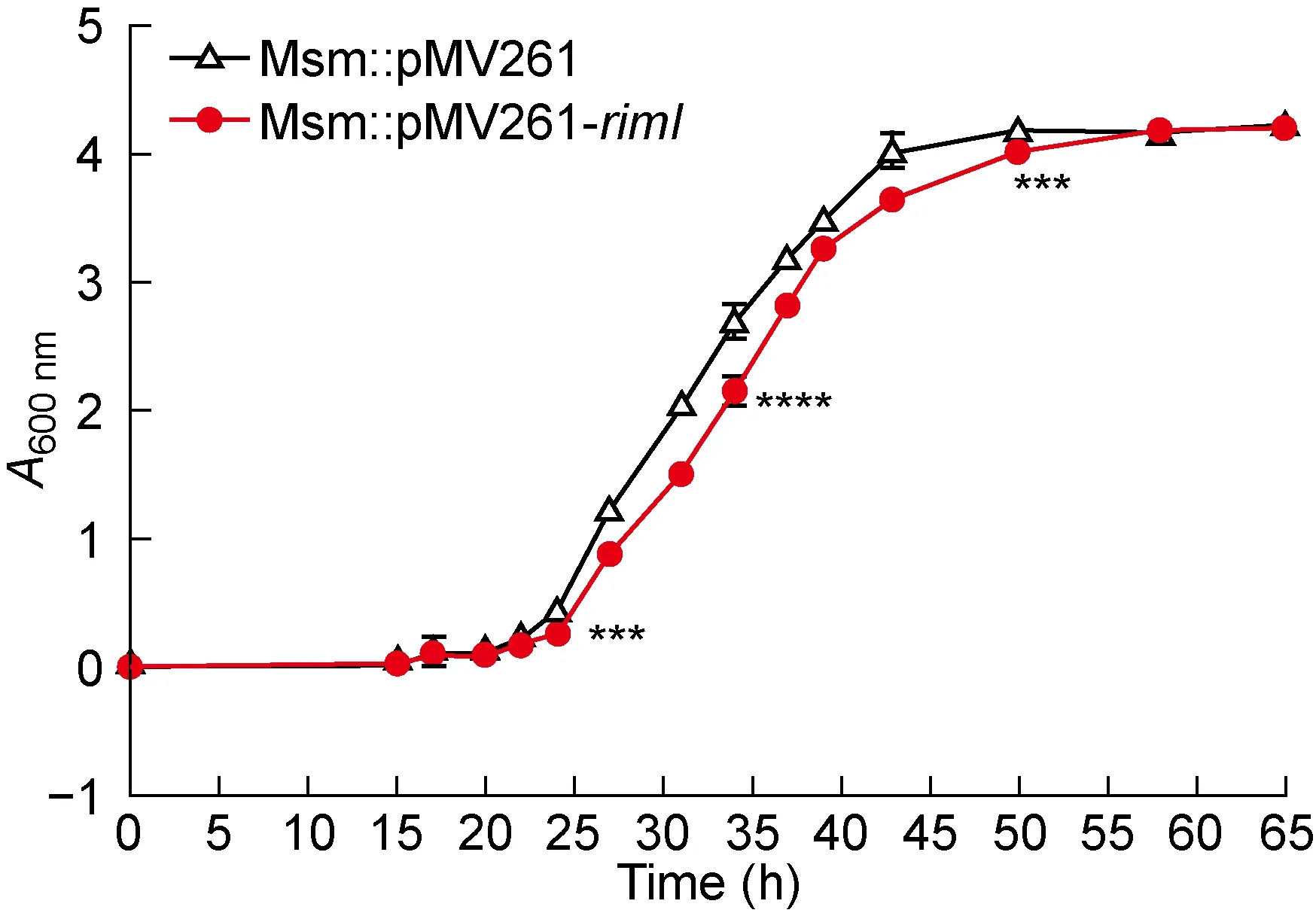
The data presented were expressed as the mean (±SD). Statistical significance was determined by using two-way ANOWA. ****P<0.000 1, ***P<0.001.

A: Biofilm formation of Msm∷pMV261 and Msm∷pMV261-rimI in standing Sauton’s medium at different time. B: Biofilm formation of Msm∷pMV261 and Msm∷pMV261-rimI in standing Sauton’s medium on 3 d, 5 d and 6 d. Images above and below for each strain represent ×1 and ×2.5 magnification, respectively.
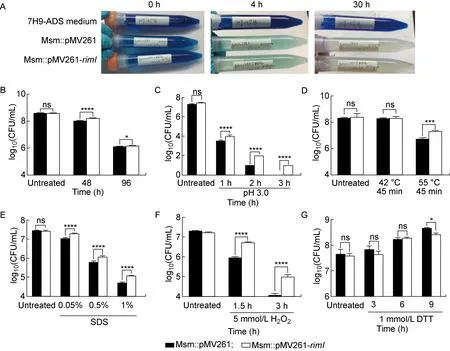
A: Oxygen consumption rate. From top to bottom three centrifuge tubes contained pure 7H9-ADS medium, 7H9-ADS medium with Msm∷pMV261 strain and 7H9-ADS medium with Msm∷pMV261-rimI strain, respectively, which were indicated by 1% methylene blue at 0 h, 4 h and 30 h. B: Hypoxia. C: pH 3.0. D: Heat shock. E: SDS. F: H2O2. G: DTT. The data presented in B-G were expressed as the mean (±SD). Statistical significance was determined by using two-way ANOWA. ****P<0.000 1, ***P<0.001, **P<0.01, *P<0.05.
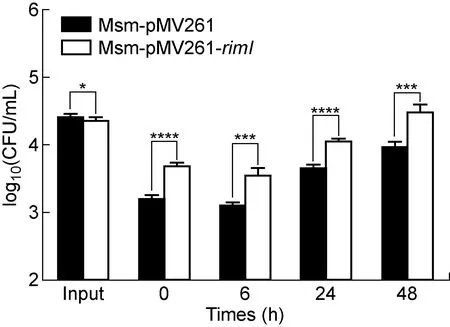
The data presented were expressed as the mean (±SD). Statistical significance was determined by using two-way ANOWA. ****P<0.000 1, ***P<0.001, **P<0.01, *P<0.05.
3 讨论
结核分枝杆菌作为一种“成功”的胞内菌,其进化出一系列机制来逃避宿主的免疫攻击并适应胞内寄生生活。复杂的菌落形态和生物膜结构是分枝杆菌属特有的两种与毒力密切相关的表型,生物膜的形成有助于细菌适应环境,抵抗巨噬细胞的吞噬作用,耐受和逃避宿主不利微环境和免疫攻击,并增强细菌的耐药能力[7]。早期研究表明,鸟分枝杆菌中菌落形态的变化会影响菌体代谢及毒力[8]。生物膜结构异常的鸟分枝杆菌和海分枝杆菌的转座子突变体存在耐药性及毒力变化,且分枝杆菌中毒力因子功能的丧失往往伴随着体外生物膜表型的变异[9]。与Msm∷pMV261菌株相比,本研究构建的重组Msm∷pMV261-rimI菌株形成的菌落形态表面褶皱更多,虽然早期生物膜形成能力下降,但后期生物膜成熟进程加快,推测rimI过表达可能有助于增强分枝杆菌耐受不利环境的能力。
结核分枝杆菌作为胞内侵染菌,可以抵抗宿主巨噬细胞微环境并达到胞内生存的目的。结核分枝杆菌侵入机体后,耐受和适应巨噬细胞内的低氧、低pH值、氧自由基及饥饿等不利环境是其胞内生存的关键[10],特别是耐受吞噬溶酶体内低pH值环境的能力与其毒力密切相关[11-12]。本研究中系列胁迫实验结果显示,与Msm∷pMV261菌株相比,Msm∷pMV261-rimI菌株耐低氧、耐酸、抗表面活性剂、抗氧化、耐高温的能力显著增强,表明rimI过表达增强了分枝杆菌抵抗不利环境的能力。巨噬细胞感染实验结果也显示,结核分枝杆菌rimI过表达可以增强耻垢分枝杆菌在巨噬细胞内的存活能力,进一步提示RimI可能与结核分枝杆菌的胞内生存和致病性密切相关。
RimI蛋白属于GNAT家族。与大肠埃希菌不同,结核分枝杆菌中的RimI有不严格的底物特异性,不能高效催化核糖体蛋白S18的N-α-乙酰化修饰,但可以催化同一alr-groEL1操纵子相邻蛋白GroEL1、GroES、TsaB的N-α-乙酰化修饰[13]。alr-groEL1操纵子与结核分枝杆菌抵抗SDS、H2O2、热击和低pH值等多种环境压力密切相关[5],分子伴侣蛋白GroEL1功能丧失会严重影响其生物膜形成及错误蛋白的重折叠能力,进而导致其致病性和肉芽肿形成能力受损[14]。本研究中,过表达rimI的耻垢分枝杆菌早期生物膜形成能力下降,后期生物膜成熟加快,抗逆性及巨噬细胞内存活能力显著增强,提示RimI蛋白可能通过调控GroEL1等靶蛋白的N-α-乙酰化修饰,改变靶蛋白的表达水平或生物学功能,进而影响菌体生长及其致病能力。另一研究表明,结核分枝杆菌毒力蛋白EsxA(ESAT-6,early secreted antigenic target,相对分子质量 6 000)中也存在N-α-乙酰化修饰[15]。此外,在海分枝杆菌中发现EsxA的N-α-乙酰化修饰水平受MMAR_0039调控,且N-α-乙酰化修饰水平与其致病性密切相关[16]。因此,N-α-乙酰化修饰可能与结核分枝杆菌的致病性密切相关。作为结核分枝杆菌的N-α-乙酰化转移酶,RimI参与调控靶蛋白的乙酰化修饰进而影响细菌致病力的机制还在深入研究中。
本研究仅通过在耻垢分枝杆菌中过表达结核分枝杆菌RimI而开展实验,但耻垢分枝杆菌中也存在内源性的RimI,其存在对过表达RimI菌株的表型及功能是否有影响仍须进一步探索。此外,rimI敲除对分枝杆菌蛋白的乙酰化修饰以及致病性的影响也有待深入研究。

