抗糖尿病药物的“肠道机制”
冯雨薇,张烽,,王雪松3,4,,夏艳萍,华皎5,,曹宏,6,
1. 江南大学无锡医学院,江苏 无锡 214122; 2. 江南大学附属医院营养科,江苏 无锡 214122; 3. 江南大学附属医院功能食品临床评价中心,江苏 无锡 214122; 4. 江南大学附属医院骨科,江苏 无锡 214122; 5. 江南大学附属医院感染控制科,江苏 无锡 214122; 6. 江南大学附属医院内分泌科,江苏 无锡 214122
随着经济的快速发展和生活方式的不断西化,我国的肥胖、2型糖尿病(type 2 diabetes mellitus, T2DM)和心脑血管疾病等慢性代谢性疾病发病率急剧上升,已成为影响国民健康的主要威胁。2017年,世界糖尿病联盟发布的世界糖尿病地图显示,全世界共有4.25亿人罹患糖尿病,到2045年将有6.29亿人成为糖尿病患者[1]。目前,中国内地糖尿病人口已经达到1.14亿,位居世界首位[1]。根据2013年发表在JAMA上的数据,我国成年人T2DM发病率已达到11.6%,而成年人中糖尿病前期人群达到50.1%。糖尿病患者中仅有25.8%的人接受了治疗,而只有39.7%的患者血糖得到完全控制[2]。在糖尿病所有种类中,T2DM占了90%。T2DM最大的危害来源于其并发症,其中心血管疾病是与T2DM关系最密切、致死率最高的并发症[3]。肥胖、缺乏运动和摄入高热量食物是导致T2DM发病率逐年上升的原因[3]。T2DM的流行同时受到遗传和环境因素的影响。但据基因组相关研究发现,遗传因素对T2DM的发病只有不超过10%的作用[4]。
越来越多的研究表明,肠道菌群与T2DM的发生、发展密切相关,T2DM患者一般存在着较为严重的胰岛素抵抗,而且还时常表现为系统性的低度炎症。大量研究显示,肠道菌群失调导致肠道中能释放脂多糖(lipopolysaccharide, LPS)的革兰阴性菌被富集,肠道通透性增加,LPS入血到达全身各个靶器官,引起全身性的低度炎症,导致胰岛素抵抗和糖尿病。肠道菌群中的有益菌能够分解复杂碳水化合物产生短链脂肪酸(short chain fatty acids, SCFAs),从而抵抗炎症及引起肠道L细胞分泌更多的胰高血糖素样蛋白1(glucagon-like protein 1, GLP-1)[5]。另外,初级胆酸能被肠道菌群代谢为次级胆酸。后者结合G蛋白偶联胆汁酸受体Gpbar1(TGR5),引起肌肉能量消耗和肠道L细胞分泌GLP-1增加。这两种机制都能改善胰岛素抵抗和糖代谢异常[5]。
随着糖尿病患者的增多,针对T2DM治疗药物的作用机制也越发引起关注。T2DM的治疗药物品种众多,有双胍类、磺脲类、α-糖苷酶抑制剂、噻唑烷二酮类、胰岛素类、GLP-1受体激动剂、二肽基肽酶-Ⅳ(dipeptidyl peptidase-Ⅳ, DPP-Ⅳ)抑制剂、钠-葡萄糖协同转运蛋白2(SGLT-2)抑制剂等,其作用机制各异。近年来,人们逐渐发现许多糖尿病药物除了原先经典的作用机制外,还可能通过调节肠道菌群达到改善糖尿病的作用[6-8]。鉴于此,本综述就近年来国内外报道的有关抗糖药物与“肠道机制”相关的研究进行分析、总结,期望对糖尿病药物的作用机制研究以及以完善肠道菌群为靶点的药物干预方案的研究提供参考。
1 肠道菌群简介
人的肠道与人类健康以及包括T2DM在内的疾病之间存在着密切的联系,在漫长的进化史中,人类肠道中有一群伴随人类共同进化的共生微生物——肠道微生物组,也叫肠道菌群。成年人肠道菌群种类繁多,但肠道80%~90%的细菌都是由厚壁菌门和拟杆菌门组成。而有些类群,虽在大多数个体的肠道菌群中都有发现,但通常丰度都很低,如放线菌门和变形菌门。另外,肠道微生物还包括一些古菌——如产甲烷菌(主要是史氏甲烷短杆菌,Methanobrevibactersmithii)、真核生物以及病毒[9]。肠道菌群与宿主的消化、营养、代谢、免疫等方面密切相关,是人体“内化了的环境”因素,其地位与作用相当于后天获得的一个重要“器官”[10]。肠道微生物与宿主之间进行着紧密的相互作用,肠道菌群可以通过代谢或其他途径与宿主之间建立“分子对话”机制:宿主的健康状况以及膳食结构发生变化,体内共生微生物的组成就会发生变化;反过来,体内共生微生物组成的变化也会影响人体的健康[11]。宿主和肠道菌群之间进行着活跃的代谢交换过程,共同形成一个完整的代谢系统。
肠道菌群会受到宿主遗传和环境因素的影响。一项包含了 1 812 例样本的针对德国北部地区人群的研究显示,遗传因素和非遗传因素各自能导致肠道菌群约10%的变异。该研究发现编码维生素D受体的基因(VDR基因)的变异明显影响宿主菌群共代谢和肠-肝轴。研究还发现宿主许多生理及病理指标,包括许多疾病敏感基因与肠道菌群及肠-脑轴有关[12]。一项动物实验发现,饮食和遗传因素均能对肠道菌群产生影响。然而,受环境影响改变后的菌群对129S6/SvEvTac小鼠的代谢产生影响,而另一遗传背景的C57Bl/6J小鼠的代谢表型却能维持不变,提示部分遗传因素可能直接影响宿主的代谢,并且这种遗传因素的影响可能在调节宿主代谢过程中占据了主导地位[13]。但有研究认为环境因素对菌群的影响强于宿主遗传因素,肠道菌群的结构与宿主遗传因素没有显著关联,但是超过20%的人与人之间的微生物组变异与饮食、药物等因素有关。对英国一项Twins UK队列的 2 252 名双胞胎菌群数据重新分析后发现,宿主基因对肠道菌群结构影响很小[14]。
肠道菌群对宿主的代谢也产生了重要的影响。肠道菌群在食物的消化、维生素合成和宿主代谢中发挥了非常重要的作用。宿主和肠道菌群之间进行着活跃的代谢交换与共代谢过程,形成一个完整的代谢系统,共同响应环境因素(包括饮食、药物等),从而影响宿主的健康[11]。肠道菌群能通过代谢未被小肠消化吸收的食物、黏液、脱落的肠道细胞或黏膜产生一系列生物活性物质,从而对宿主健康产生影响。某些肠道微生物产生的酶能将复杂碳水化合物解聚为可发酵糖类,并进一步发酵这些糖类产生能量供给自身生长使用,而发酵产物则可被宿主利用[15]。例如盲肠和近端结肠中的厌氧菌能通过对食物——主要是对膳食纤维的无氧分解产生SCFAs(发酵蛋白和肽也会产生少量的SCFAs)。SCFAs,尤其是肠道中含量最丰富的3种SCFAs——乙酸、丙酸和丁酸,能对脂代谢、糖代谢和胰岛素敏感性产生影响。作为重要的信号分子,胆汁酸(bile acids, BAs)能通过在不同器官与核激素法尼酯X受体(FXR,NR1H4)、G蛋白耦联受体(TGR5,GPBAR1)的结合控制血糖、血脂和能量代谢,影响肠道激素分泌、肝糖异生、能量消耗、炎症和肠道菌群结构的调节[16]。
药物对于肠道菌群的调节也基于“分子对话”这一机制,不同的药物对肠道菌群的作用机制不同(见表1)。
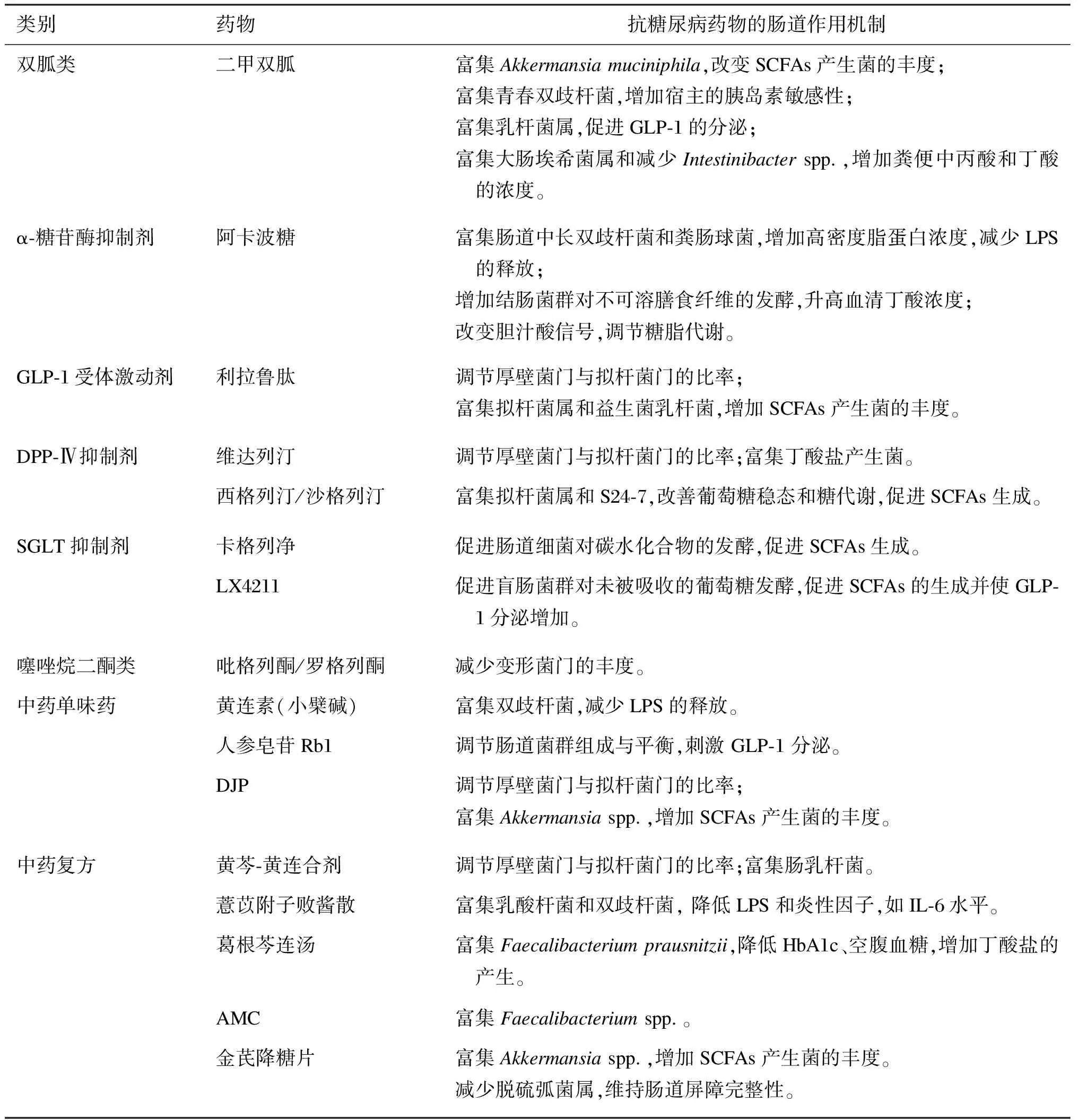
表1 抗糖尿病药物在糖代谢中的肠道作用机制
2 肠道菌群在抗糖尿病药物使用过程中的作用
2.1 双胍类
根据美国糖尿病协会(American Diabetes Association, ADA)推荐的T2DM药物治疗方案,双胍类药物是治疗T2DM的一线用药,临床上最常用的双胍类药物是二甲双胍。患者一旦开始使用二甲双胍,便可以一直使用到对该药产生耐受,但长期使用二甲双胍会引起维生素B12缺乏[17]。过去认为二甲双胍主要是通过活化肝脏和骨骼肌AMP依赖的蛋白激酶(adenosine 5′-monophosphate-activated protein kinase, AMPK)发挥降糖作用。近来人们逐渐认识到,二甲双胍还能通过改变钠依赖性肠道胆汁酸转运体来抑制胆汁酸的重吸收,同时调节肠道菌群并促进GLP-1的分泌[6]。将经二甲双胍重塑后的肠道菌群移植给无菌小鼠后,这些小鼠糖代谢状况得到显著改善。二甲双胍能直接影响菌群结构,对于饲喂高脂饮食(high fat diet, HFD)的小鼠来说,二甲双胍能富集Akkermansiamuciniphila和Clostridiumcocleatum的丰度,而前者可以保持黏液层的完整性并能改变SCFAs产生菌的丰度;除此以外,它还能富集肠道中的青春双歧杆菌和某些SCFAs产生菌。青春双歧杆菌被证明与糖化血红蛋白(glycosylated hemoglobin,HbA1c)负相关,并能增加宿主的胰岛素敏感性[18]。无论是T2DM、糖耐量受损或正常糖耐量者,使用二甲双胍者的菌群结构与未使用者不同。另有研究发现,服用二甲双胍可以使HFD小鼠小肠富集乳杆菌属,而乳杆菌属已被证实可促进GLP-1的分泌,改善HFD喂养小鼠的胰岛素抵抗[19];二甲双胍还能降低Intestinibacterspp.丰度并提高大肠埃希菌属的丰度,增加粪便中丙酸和丁酸的浓度。从功能角度看,二甲双胍能使革兰阴性菌丰度增加导致LPS的释放增多、调节SCFAs的生成和肠道细菌金属蛋白编码基因的表达。LPS释放增加并未引起系统性炎症,SCFAs的生成增加能改善糖代谢,而金属蛋白则参与了T2DM的发生[18,20]。有文献报道,二甲双胍部分可通过脆弱拟杆菌-甘氨熊脱氧胆酸 (glycoursodeoxycholic acid,GUDCA)-FXR轴发挥降糖作用,二甲双胍可以降低脆弱拟杆菌的丰度,从而使肠道内胆汁酸组成发生变化,导致FXR抑制剂GUDCA的水平上调,抑制FXR信号传递进而改善葡萄糖不耐受,因此也提示了GUDCA和FXR抑制剂作为治疗T2DM的可能性[21]。综上所述,二甲双胍可以通过调节血糖摄取和利用、增加GLP-1和胆酸水平并改变肠道菌群,从而影响肠道微环境。但由于二甲双胍调节菌群的作用强大,以至于在开展肠道菌群与T2DM关系研究时,必须考虑和排除患者使用二甲双胍对实验结果的干扰[22]。
2.2 α-糖苷酶抑制剂
阿卡波糖是一种α-糖苷酶抑制剂,它能抑制淀粉在小肠吸收,使更多的淀粉进入大肠,从而降低餐后血糖水平。一项包含784人的大型人群试验研究称,经过阿卡波糖24周和48周的干预,HbA1c分别平均下降1.17%和1.11%,均与二甲双胍组无显著差异,且发生严重不良事件的比例仅为2%,发生低血糖的比例仅1%,也均与二甲双胍组无显著差异[7]。近来研究发现,阿卡波糖也能调节糖尿病前期患者肠道菌群的多样性和组成,肠道菌群的这种变化又与许多代谢表型强相关[23]。阿卡波糖能够增加T2DM患者肠道中长双歧杆菌和粪肠球菌丰度,长双歧杆菌丰度与高密度脂蛋白的浓度正相关,粪肠球菌丰度与LPS浓度负相关[7]。阿卡波糖能调节T2DM患者的肠道菌群,并由此调节胆汁酸代谢,对机体代谢产生有益影响。阿卡波糖很可能还通过增加结肠菌群对不可溶膳食纤维的发酵,增加糖耐量受损患者血清丁酸浓度[24]。也有文献报道,阿卡波糖治疗在增加丁酸产生的同时,降低了乙酸和丙酸的产生[25]。
2.3 GLP-1受体激动剂
GLP-1是机体在摄入食物后,由肠道L细胞分泌的肠道激素[26]。它是一种生物活性肽,由于极易被DPP-Ⅳ降解而失活,半衰期仅几分钟[27]。GLP-1促进胰岛素分泌的作用使其类似物和DPP-Ⅳ抑制剂被用作抗糖尿病药物[28-30]。对于大部分想要通过使用注射疗法更大幅度降低血糖的患者来说,选用GLP-1受体激动剂效果甚至好于胰岛素[17]。作为一种GLP-1类似物,利拉鲁肽能通过调节肠道菌群结构改善单纯性肥胖和糖尿病引起的肥胖。它能降低菌群α-多样性,并在各分类地位上影响单纯性肥胖和糖尿病肥胖小鼠模型的菌群,而且它对菌群的调节可能独立于大鼠血糖水平这一因素[31]。另有研究显示,在利拉鲁肽处理的雄性糖尿病大鼠中,厚壁菌门与拟杆菌门的比率(F/B比率)向正常水平恢复,并且使一些SCFAs产生菌,包括拟杆菌属和益生菌乳杆菌等的产生增加,而F/B比率与系统性低度炎症密切相关,乳杆菌与空腹血糖呈负相关[8]。除此之外,艾塞那肽和利拉鲁肽还能够增加胰岛素的分泌、降低胰高血糖素水平、减缓胃排空、增加饱腹感、减重和降低低血糖风险[32]。
2.4 DPP-Ⅳ抑制剂
西格列汀是DPP-Ⅳ抑制剂,能改善肠道菌群,目前虽其作用机制不明,但发现西格列汀能减轻肠道壁水肿、减轻肠道炎症并维持肠道黏膜完整性[33]。维达列汀亦是DPP-Ⅳ抑制剂,能显著减少糖尿病大鼠菌群多样性,富集丁酸盐产生菌,并使F/B比率恢复正常[34]。近来有研究发现DPP-Ⅳ抑制剂能逆转由于HFD饮食诱导的小鼠肠道菌群显著变化,并且这种变化不由GLP-1介导。西格列汀使HFD 诱导的小鼠24 个属 (68.6%) 的菌丰度发生逆转,并且12 个丰度较高的属与HFD 小鼠之间存在相反的变化,其中以拟杆菌属丰度增加和S24-7的富集为主要特点,拟杆菌属可被白藜芦醇富集,并在白藜芦醇诱导葡萄糖稳态改善的潜在机制中发挥重要作用。S24-7部分介导了运动在预防肥胖发生中的作用,并且这两个属丰度的增加都可以促进糖代谢。在功能上,西格列汀可以促进SCFAs 的生成,并且琥珀酸——糖异生改善葡萄糖代谢的关键底物的含量也有所增加。有趣的是,沙格列汀与西格列汀结构相似性仅为26.6%,但是其导致的HFD小鼠菌群结构及功能变化与沙格列汀组无明显差异,所以DPP-Ⅳ抑制剂对肠道菌群的影响可能并不局限于其中一个家族,而是涵盖了整个类别[35]。
2.5 SGLT抑制剂类药物
当T2DM患者同时罹患动脉粥样硬化性疾病时,推荐将SGLT-2抑制剂或者GLP-1受体激动剂作为降血糖药物治疗的一部分。而一旦这类病人出现心力衰竭或存在心力衰竭高风险时,SGLT-2抑制剂就应作为首选药。那些同时罹患慢性肾脏疾病的患者,应该考虑使用SGLT-2抑制剂或GLP-1受体激动剂[15]。有文章显示卡格列净作为SGLT-2抑制剂,经其处理的肾衰竭小鼠盲肠SCFAs的分泌显著增多,促进了肠道细菌对碳水化合物的发酵[36]。LX4211能通过抑制SGLT1、刺激GLP-1和酪酪肽(peptide tyrosine-tyrosine,peptide YY, PYY)分泌以减少糖的吸收,这些作用可能是通过盲肠发酵未被吸收的葡萄糖产生SCFAs而实现的[37]。
2.6 噻唑烷二酮类
吡格列酮是噻唑烷二酮类药物,其能通过与过氧化物酶体增殖物激活受体-γ(PPAR-γ核受体)结合,减少胰岛素抵抗。吡格列酮能改善KKAy小鼠的肠道菌群结构,但会降低菌群多样性[38]。吡格列酮能降低HFD 喂食大鼠中变形菌门的丰度[39],罗格列酮作为噻唑烷二酮类药物,能逆转HFD诱导的肠道微生态失调[40]。这些研究表明,肠道菌群与噻唑烷二酮类药物之间存在相互作用,可能参与了抗糖尿病作用。但目前针对噻唑烷二酮类药物的“肠道降糖机制”研究有限,其具体机制须进一步完善。
2.7 中药
近年来发现一些治疗糖尿病的中药也有明显调节肠道菌群的作用。
2.7.1 中药单味药黄连素的主要成分小檗碱有治疗糖尿病的功效。动物实验揭示,它至少部分是通过调节肠道菌群的结构而改善肥胖和胰岛素抵抗的[41]。陈玲玲等[42]的研究显示,黄连素干预后,T2DM患者肠道内双歧杆菌出现明显富集,而双歧杆菌的丰度与LPS、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)及HbA1c的浓度呈负相关;人参皂苷Rb1(ginsenoside Rb1)可以提高口服生物利用度,调节肠道菌群组成与平衡,增加肠道通透性并刺激 GLP-1 分泌发挥潜在的降糖和抗糖尿病作用[43]。石斛是一种包含多种化合物(多酚、多糖、生物碱等)的中药,在中医临床上石斛植物多被用于治疗T2DM及其并发症。为了探索石斛多酚的抗糖尿病作用,以罗勒石斛为原料制备的富集多酚的提取物D.loddigesii(DJP),用于治疗糖尿病db/db小鼠,结果发现通过DJP干预后,db/db小鼠的肠道菌群结构发生变化,使由于T2DM导致的F/B比率失调得到改善,并且出现Akkermansiaspp.的明显富集。在功能上,DJP干预组小鼠SCFAs产生菌增加,并且负责丁酸/脂肪酸代谢的细菌显著减少,负责脂肪酸生物合成/花生四烯酸代谢的细菌显著增加[44]。这些都表明肠道微生物组的变化对DJP抗高血糖产生有益影响。
2.7.2 中药复方黄芩-黄连合剂(scutellaria-coptis herb couple, SC)是用于治疗糖尿病著名的中国传统复方制剂,其主要成分为黄连碱、小檗碱、黄芩苷和黄芩素等。据文献报道SC可以调节T2DM KKAy小鼠肠道中的菌群结构,拟杆菌门和厚壁菌门的丰度在实验组和对照组之间存在显著差异,其中肠道中的肠乳杆菌在对照组中被耗尽,相反在高剂量SC组中被富集,而肠乳杆菌作为一种益生菌可以对糖尿病产生有效的调控[45]。薏苡附子败酱散是临床上应用较广泛的抗炎药,研究显示其能够富集小鼠肠道中乳酸杆菌和双歧杆菌数量, 降低炎性因子LPS、白细胞介素-6(interleukin-6,IL-6)水平,改善糖尿病小鼠的糖脂代谢而发挥治疗糖尿病的作用[46]。葛根芩连汤是《伤寒论》中的一个中药方剂,具有解表清里之功效。近来发现,葛根芩连汤改善T2DM患者胰岛素抵抗作用可能与其调节肠道菌群结构有关[47]。在服用葛根芩连汤进行干预后,T2DM患者的肠道菌群结构发生显著变化,共146种微生物与它们的生化指标存在相关性,其中Faecalibacteriumprausnitzii与HbA1c、空腹血糖、2 h餐后血糖负相关,而且F.prausnitzii是一种重要的丁酸盐产生菌[48]。另外一种包含8味中药的方剂AMC与二甲双胍一样,能够显著改善高血糖和高血脂,同时都能改变T2DM患者的肠道菌群结构。它们显著增加以Blautiaspp.为代表的共变化群的细菌,这群细菌与糖脂代谢的改善显著相关。然而相较于二甲双胍,AMC改善胰岛素抵抗指数和血浆甘油三酯的作用更强,并且调节菌群作用更大。AMC还能富集以Faecalibacteriumspp.为代表的共变化群细菌,而之前的报道发现Faecalibacteriumspp.与T2DM的改善显著相关[49]。金芪降糖片是治疗糖尿病的一个中药组方,它能使小鼠肠道发生明显的菌群结构变化,提高胰岛素敏感性。在细菌属水平上,金芪降糖片给药后Akkermansiaspp. 的丰度显著增加,脱硫弧菌属丰度显著降低。Akkermansiaspp.与炎症密切相关[50],并在肥胖和T2DM患者中丰度低得多。有研究证明Akkermansiaspp. 相对丰度增加可能是二甲双胍的一种新的抗高血糖机制[51],而脱硫弧菌属与肠道屏障密切相关。除此之外,金芪降糖片对肠道菌群的调节可促进乙酸、丙酸和丁酸等SCFAs的产生,为肠上皮提供能量和营养,改善糖代谢,对维持肠道屏障的完整性有重要意义[52]。
综上所述,T2DM药物除了经典调节机制外,还可以通过调节肠道菌群产生有益的代谢产物与宿主进行“分子对话”,调节机体的糖脂代谢等进而达到降血糖的目的,这为研究抗糖尿病药物的作用机制提供新的思路,也为完善以肠道菌群为靶点的药物干预方案提供理论依据。

