高中化学速率与平衡试题的解题技巧
陈志刚
(甘肃省靖远县第一中学 730699)
化学作为高中教育体系中的一门关键科目,化学速率和平衡在高考化学中所占据着较大的分值比例,由于无法单独成题,通常同其它题目综合起来,解题时难度较大,对学生的解题水平要求较高,他们很难顺利求得正确答案.高中化学教师应深入研究速率与平衡类试题,帮助学生理清解题的思路,使其掌握正确的解题方法与技巧,切实提高他们的解题水平.
一、运用极端分析思想,结合极限方法求解
在高中化学反应速率与平衡类的试题中,主要研究的对象就是可逆反应,而可逆反应无法进行到底,解决这类试题时,教师可以鼓励学生进行逆向思考,使其结合极限的方法来求解,让他们顺利求得答案.对此,高中化学教师在速率与平衡解题训练中,可以指导学生根据题目实际情况灵活自如的运用极端分析思想,使其找准解题的切入点,让他们在极限法的辅助轻松、正确的解决试题.

A.20% B.22.2% C.17% D.11.1%
分析在原平衡混合物中含有的二氧化碳与氢气均是0.6mol,一氧化碳与水蒸气则都为0.4mol,当达到平衡后又加入3mol的水蒸气,平衡将往反应的正方向移动,一氧化碳的转化率变大,二氧化碳的体积分数变大,不过无法求出具体数值.此时,学生可以采用极端分析思想展开分析,一氧化碳转化率增大的最大极限是100%,最小极限值是原转化率,即为0,不发生任何变化,随后通过化学平衡计算的基本模式能够求出两种情况下二氧化碳的体积分数分别为20%与12%,则能够判断出当再次达到平衡以后,二氧化碳的体积分数应该处于12%与20%之间,由此得出正确答案是C选项.
在上述案例中,教师指引学生运用极端分析思想,找准题目中进行极端假设的突破口,让他们根据一氧化碳的最大极限与最小极限转化率来计算二氧化碳的体积分数,使其确定出数值的大概取值范围,然后加以判断,最终求出正确答案.
二、采用粗略估算思想,学生快速解答试题
在高中化学课程教学中,部分化学速率与平衡类的试题,虽然说依据基本公式展开计算,能够求出正确答案,不过因为这类题目较为特殊,无需采用计算的方法,通过计算反而容易出现错误.这时高中化学教师在速率与平衡类解题教学中,可以提示学生以平衡移动的方向与结果来判断题目中某些量之间的关系,让他们通过粗略估算思想的采用快速解答试题,从而将繁琐的计算步骤省略掉.

A.6 B.5 C.4 D.3
分析假如本题采用化学平衡计算的基本模式展开计算,将会显得异常繁琐,不仅步骤较多,还容易出现错误.教师可要求学生认真阅读题目内容,提取出关键信息,提示他们使用粗略估算的思想进行求解,具体解答方法如下:根据题意可知该反应是在一个恒压、恒温的密闭容器内进行的,一定要从正反应的方向来建立化学平衡,由于达到平衡以后容器的体积有所变大,这表明在恒压、恒温下该容器内气体的总物质的量也有所变大,即为正反应是一个气体体积增大的反应,所以得出不等式2+n>4+3,解之得n>5,只有A选项符合题意.
对于上述案例,学生没有直接按照化学平衡计算的基本模式进行,避免因计算失误而导致错误现象的出现,而是合理采用粗略估算的思想方法,准确确定出题目中n的取值范围,然后他们根据题目中给出的几个选项快速找到正确答案.
三、应用平均分割思想,准确求得试题答案
在高中化学解题训练中,速率与平衡是一类较为特殊的题目,这类试题中出现的题型也不少,不过考察方向比较一致,当遇到这样类型的题目时,即为:往几个不同的起始状态中加入一样的物质,当初始量成倍数关系时,教师可以引导学生巧妙应用平均分割思想,将量多者设计成多个同量少者等同的平衡,由此得到量多着的平衡,使其找到正确的解题思路,让他们准确推断出某些量的具体值.

分析由于题目中的密闭容器没有明确指出是恒容还是恒压的,所以本题要进行分类讨论:(1)当密闭容器恒压时,第二次加入气体的物质的量是第一次的2倍,容器的体积也变成第一次的2倍,可以将第二次的容器进行分割变成两个一样的第一次容器,那么Z的物质的量是1mol×2=2mol;(2)当密闭容器为恒容容器时,则要先将其看作恒压容器,以上述分析为基础,通过加压把其变成原体积,由于加压以后该反应将往正方向发生移动,那么Z的物质的量大于2mol.
针对上述案例,教师引领学生巧妙应用平均分割的思想,将题目中的情况先分类讨论,再对密闭容器进行适当的分割处理,使其解题思路变得简单化与清晰化,并简化解题步骤,只需对容器分割后进行简单计算即可,准确求出试题答案.
四、运用先拐先平方法,轻松求出试题结果
在一些高中化学速率与平衡类的试题中,会搭配有图像,而图像中又会出现拐点,像在浓度和时间图中,依据拐点出现时间的先后顺序,能够将温度和压强高低展开对比,在图像中先出现拐点曲线则表示先达到平衡,这时通过逆向分析能够得出这一变化对应的压强、温度均比较高,浓度也相对较大.高中化学教师可指导学生运用先拐先平方法分析速率与平衡题目,辅助他们轻松求得结果.

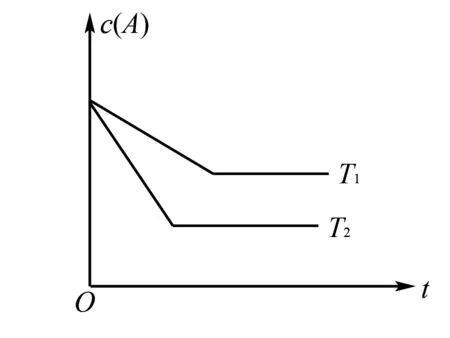
图1
解析学生通过认真阅读题目内后审题后能够发现,在先拐先平的图像曲线中,拐点代表刚刚达到平衡时的状态,根据图像信息可知T2达到平衡状态使用的时间比T1少,这就说明T2的速率比T1大,所以温度比T1高;而温度高,c(A)更小,那么能够推断出这一化学反应的正反应是一个吸热反应,温度上升K将会持续增大,所以,最后得出的结果为反应的温度T1小于T2,平衡常数K(T1)小于(T2).
上述案例,教师指引学生运用先拐先平的解题方法,通过对图像的分析可以准确提取出题目中的信息,使其展开合理的推理与判断,将大量、繁琐的计算步骤省略掉,从而降低出现错误的几率,最终帮助他们轻松、正确的求得试题结果.
总而言之,在高中化学速率与平衡解题教学中,常考点有判断平衡状态、判断平衡移动的原因和方向、分析平衡移动的结果、比较或计算化学平衡状态等,教师应当指导学生根据实际情况灵活利用解题技巧,逐步提高他们的解题水平.

