肉桂精油微胶囊对小鼠抗氧化活性与肠道菌群的影响
宋晓秋,徐亚杰,肖 瀛*,王一非,陈佳昊
(上海应用技术大学香料香精技术与工程学院,上海 201418)
肉桂作为一种常见的香料和传统草药,其提取物肉桂精油在世界各地有着悠久且广泛的使用历史[1],肉桂精油中的主要成分为肉桂醛(55%~75%)、丁香酚(5%~10%)等[2-3]。近年来,肉桂精油常被报道具有强抗氧化活性以及抗肥胖、抗高血糖、抗炎和抗癌等能力[4-6],且因其天然无毒而在食品添加剂领域备受青睐[7]。已有研究表明,肉桂精油能有效地防止棕榈油的脂质氧化,可作为抗氧化剂用于食品加工[8],而肉桂精油中的醛类和酚类化合物能够在中和自由基和过氧化物分解中起重要作用[9];此外,肉桂精油能够在体外对多种有害菌表现出抗菌和抗生物膜活性[10];Li Aili等[11]研究表明,肉桂精油能够改善小鼠肠道菌群的多样性和丰富度,并改变菌群结构,抑制肠道内有害菌(如Ruminococcaceae_UCG-014、Helicobacter等)的增殖,并增加了益生菌(如Alloprevotella、Blautia)和产短链脂肪酸(short-chain fatty acids,SCFAs)菌的丰度。
然而肉桂精油具有易挥发、易降解的特性,其主要组分肉桂醛容易在空气中被氧化成为肉桂酸[12],从而导致其功效降低。近年来,随着微交囊技术的日益成熟,精油微交囊在食品加工领域中得到了广泛应用[13],将肉桂精油包埋在壁材内,可使其避免因光、热及氧导致的降解,有效减少环境变化对芯材的影响,稳定其理化性质,并能够通过缓释作用控制芯材在特定环境下的释放[14-15]。目前关于肉桂精油微交囊的研究主要集中在其理化性质和体外抑菌材料的应用上[16-17],而肉桂精油微交囊缓释作用对于肠道菌群的影响尚鲜有报道。
因此,本研究以β-环糊精包埋的肉桂精油微交囊为研究对象,采用二代测序Illumina MiSeq技术,探究肉桂精油微交囊对小鼠体质量,脏器指数,肝、十二指肠、结肠组织抗氧化能力及肠道菌群组成的影响作用,为进一步阐释精油类物质调节肠道菌群作用规律提供参考,亦为微交囊技术在功能性食品领域的应用提供理论依据。
1 材料与方法
1.1 动物、材料与试剂
6 周龄SPF级健康雄性C57BL/6小鼠24 只,体质量(22±1)g,购自上海灵畅生物科技有限公司,实验动物生产许可证号:SCXK(沪)2018-0003。
AIN-93G标准饲料购于南通特洛菲饲料科技有限公司;实验垫料、饲料经过辐照杀菌处理,饮用水经高压灭菌处理,符合SPF级动物使用标准。
肉桂精油(纯度99%,经气相色谱-质谱(gaschromatography-mass spectrometry,GC-MS)分析其组成包括肉桂醛65.9%(相对含量,后同)、可巴烯8.4%、丁香酚7.8%、杜松-3,9-二烯3.8%、17-戊烷酮2.8%、杜松-4,9-二烯2.3%等) 上海博湖生物科技有限公司;吐温-80 上海阿拉丁生化科技股份有限公司;肝素钠、无水硫酸钠、无水乙醚、无水乙醇、氯化钠、氢氧化钠、盐酸、磷酸二氢钾、乙酸、丙酸、丁酸、胃蛋白酶、胰蛋白酶 国药集团上海化学试剂有限公司;所有化学试剂均为分析纯。总抗氧化能力(total antioxidant capacity,T-AOC)、总超氧化物歧化酶(total superoxide dismutase,T-SOD)、过氧化氢酶(catalase,CAT)、丙二醛(malondialdehyde,MDA)测定试剂盒 南京建成生物工程研究所;QIAamp DNA Stool Mini Kit 德国Qiagen公司;荧光定量试剂SYBR Premix ExTaq、DNA纯化试剂盒、DL2000 DNA Marker 天根生化科技公司。
1.2 仪器与设备
BIOBASE-EL10A型酶标仪 山东博科生物产业有限公司;XMTD-204型数显式电热恒温水浴锅 天津市欧诺仪器表有限公司;XW-80型混合器 海门其林贝尔仪器公司;K280R型冷冻离心机 英国森特恩公司;TQ8040型GC-MS联用仪 日本岛津公司;Miseq PE300型高通量测序平台 美国Illumina公司;TGL-16M型台式高速冷冻离心机 湖南湘仪实验室仪器开发有限公司。
1.3 方法
1.3.1 肉桂精油微交囊的制备
肉桂精油微交囊制备方法参考陈海生等[18]的方法并进行适当修改,采用包结络合法,以芯壁质量比8∶5制备肉桂精油微交囊。具体方法:称取8.0 gβ-环糊精溶解于100 ℃的100 mL去离子水中,500 r/min搅拌至完全溶解,得到壁材溶液。同时,称取5.0 g肉桂精油溶解于16.0 g丙醇中,搅拌至完全溶解,得到芯材溶液。室温冷却壁材溶液至80 ℃,将芯材溶液逐滴加入其中,滴加结束后持续搅拌2 h,随后于4 ℃环境下静置24 h。取出后经抽滤并烘干,得到的白色固体粉末即为肉桂精油微交囊,固形物含量为78%,包埋率为30.2%。
1.3.2 肠内模拟释放曲线测定
根据Hou Fangli等[19]描述的体外模拟胃肠液消化方法稍作修改。人工模拟胃液的配制:将2 g氯化钠和3.2 g胃蛋白酶溶于950 mL水中,再加入7.0 mL浓盐酸,将所得混合液的体积调节至1 000 mL并将pH值调节至1.2,过滤除菌备用。人工模拟肠液的配制:将6.8 g磷酸二氢钾完全溶解在250 mL水中,再加入190 mL氢氧化钠溶液(0.2 mol/L),随后加入400 mL水和10 g胰蛋白酶,完全溶解后定容至1 000 mL并调节pH值至7.5±0.1,过滤除菌备用。为了模拟消化过程,将相等肉桂精油含量的肉桂精油和肉桂精油微交囊样品与人工模拟胃液以1∶15(m/m)的比例混合,并置于120 r/min、37 ℃的振荡培养箱模拟胃环境消化4 h,随后取经人工胃液消化后的样品和人工模拟肠液以1∶15(m/m)的比例混合,置于120 r/min、37 ℃的振荡培养箱模拟肠道消化24 h(每隔2 h取样检测一次)。
释放曲线的测定参考Sarjono等[20]的方法稍作修改。将肉桂精油标准品用无水乙醇稀释到不同浓度梯度,以无水乙醇作为空白对照,于292 nm波长处测定吸光度,以吸光度与样品质量浓度建立线性回归方程。随后通过无水乙醇洗涤消化不同时间后的样品,根据洗涤液的吸光度计算出样品中的肉桂精油含量并以此计算出释放率,以时间为横坐标、释放率为纵坐标作肠内模拟释放曲线图。
1.3.3 动物分组及处理
6 周龄实验小鼠饲养在室温(22±2)℃、相对湿度50%~55%、12 h/12 h昼夜交替条件的SPF级动物房内,自由饮食、饮水适应一周,随后随机分为3 组,每组8 只,分为2 笼饲养,分别为对照组、肉桂精油组、微交囊组。3 组分别灌胃对应灌胃溶液,灌胃剂量为0.2 mL/只,连续灌胃4 周,灌胃前4 h禁食、禁水,具体灌胃溶液配方见表1。肉桂精油组与微交囊组肉桂精油灌胃剂量均为100 mg/(kgmb·d),各组均含有相同量的β-环糊精与吐温-80。
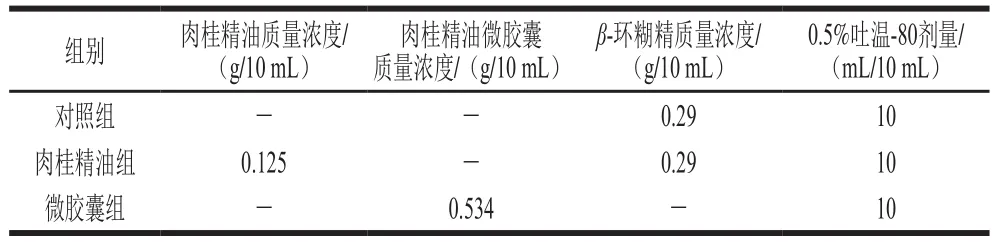
表1 实验小鼠灌胃溶液配方Table 1 Formulation of intragastric solution for experimental mice
1.3.4 体质量测定
自适应期开始至灌胃结束,每天灌胃前观察小鼠状态,每周固定时间称取并记录小鼠体质量。
1.3.5 肠道菌群样品采集
实验最后1 周开始每天早上将小鼠按组转移到干净的铺有无菌滤纸的空鼠笼中,采用应激性排便法,固定小鼠,将尾部提起,随后用湿润的棉签或手指从上至下按压小鼠腹部,收集粪便于无菌的离心管中。每0.5 g为一管,取好的样本转入-80 ℃冰箱冻存。
1.3.6 组织样品采集
肠道菌群样品采集完毕后,将小鼠禁食、禁水12 h,次日早晨将小鼠用无水乙醚麻醉,使用颈椎脱臼法处死,并迅速打开腹腔,取出小鼠的腹脂、肝、结肠、十二指肠、肾、心和脾并称质量,其中肝、结肠和十二指肠取固定位置0.1 g,并在冰浴条件下用生理盐水匀浆,制成质量分数10%的组织匀浆,4 ℃、3 500 r/min离心10 min,取上清保存于-80 ℃冰箱。
1.3.7 组织抗氧化指标及脏器指数的测定
肝、十二指肠及结肠组织样本的抗氧化水平测定按照T-AOC、T-SOD、CAT和MDA试剂盒说明书进行相关操作。脏器指数按下式计算。

1.3.8 粪便DNA的提取与测序
称取0.2 g粪便样品于2 mL离心管中,对24 管小鼠粪便样品按照试剂盒说明书提取DNA,将DNA样品寄送至上海美吉生物医药科技有限公司,按照V3~V4区域设计引物序列(338F、806R),采用MiSeq PE300平台对小鼠粪便肠道菌群进行高通量测序,获得16S rDNA数据。
1.3.9 粪便中SCFAs的测定
取0.1 g粪便样品置于2 mL离心管中,加入500 μL饱和NaCl溶液,在冰浴下用粉碎机均质至无明显块状,加入20 μL体积分数10% H2SO4进行酸化,漩涡振荡30 s,于通风橱中加入500 μL无水乙醚以萃取SCFAs,振荡30 s混匀后于14 000 r/min条件离心15 min,取上清液加入装有0.25 g无水硫酸钠的2 mL离心管中,再以同样的条件离心,除去上清液中残留的水分,转入气相瓶中待测。
GC-MS条件:色谱柱采用Rtx®-WAX(30 m×0.25 mm,0.25 μm);进样口温度250 ℃、柱温100 ℃、离子源温度220 ℃、接口温度250 ℃;升温程序:100~140 ℃升温速率为7.5 ℃/min,保持4 min,再以60 ℃/min升温至200 ℃;样品进样量1 μL、载气He、分流比10∶1、流速2 mL/min、溶剂延迟1.5 min;以Q3 Scan方式采集1.5~9.5 min,m/z20~300。
1.3.10 粪便中SCFAs的鉴定
根据GC-MS检测到的质谱信息,通过与标准谱图对照,结合质谱图检索数据库及各物质碎片离子的m/z进行定性分析;采用外标法绘制乙酸、丙酸、丁酸的标准工作曲线,根据GC-MS检测到的峰面积进行粪便中SCFAs的定量分析。
1.4 数据统计与分析
体质量、脏器指数、组织抗氧化水平、粪便SCFAs含量变化结果以±s表示,采用SPSS 22.0软件,运用邓肯氏差异分析进行单因素方差分析,P<0.05表示有显著差异。
对Illumina MiSeq测序得到的16S rDNA数据进行优化处理,采用RDP classifier贝叶斯算法,按照97%相似性对不含单序列的非重复序列进行操作分类单元(operational taxonomic unit,OTU)聚类分析和物种分类学分析,将序列按照相似性分为各个小组,每个小组定义为一个OTU。使用美吉生物云平台(www.majorbio.com)在OTU分类的基础上进行多样性分析,在分类学基础在各个分类水平上进行物种群落结构组成分析,对多样本的群落组成和差异显著性检验等进行统计学和可视化分析。
2 结果与分析
2.1 肉桂精油微交囊的肠道模拟释放曲线
肉桂精油及肉桂精油微交囊在模拟肠道环境下的释放情况见图1。肉桂精油组在经过2 h的快速释放后,释放率增长变缓并逐渐保持基本不变;而微交囊组在初期快速释放后缓慢释放6 h,随后释放速率增加,直至逐渐释放率达到稳定。结果表明肉桂精油微交囊可在模拟消化道环境中具有缓释的作用。
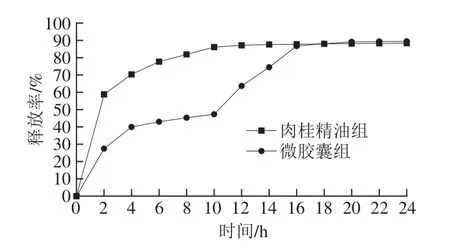
图1 肉桂精油微胶囊肠道模拟释放曲线Fig.1 Simulated intestinal release curve of cinnamon oil microcapsules
2.2 肉桂精油微交囊对小鼠体质量和脏器指数的影响
各组小鼠的体质量与脏器指数变化如表2所示,摄入肉桂精油微交囊对小鼠的体质量和心、脾、肾、肝、结肠、十二指肠、腹脂的脏器指数无显著性影响(P>0.05)。
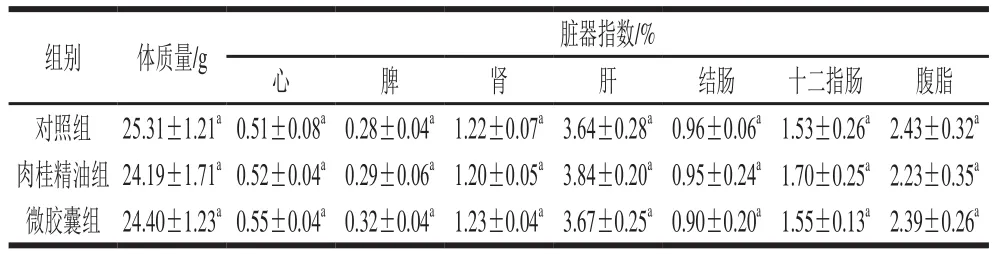
表2 肉桂精油微胶囊对小鼠体质量和脏器指数的影响Table 2 Effects of cinnamon oil microcapsules on body mass and visceral organ indexes of mice
2.3 肉桂精油微交囊对小鼠肝、十二指肠、结肠组织抗氧化水平的影响
肉桂精油微交囊对组织抗氧化水平的影响见表3。与对照组相比,肉桂精油组小鼠肝组织的CAT活力显著上升,MDA含量显著降低;十二指肠的T-AOC,T-SOD、CAT活力和MDA含量显著降低;结肠的T-SOD活力显著降低,CAT活力显著上升。与肉桂精油组相比,微交囊化的肉桂精油摄入后肝组织的T-AOC显著上升;十二指肠的T-AOC,T-SOD、CAT活力和MDA含量显著降低;结肠中抗氧化指标无显著差异。结果表明微交囊化的肉桂精油能够干预氧化损伤。
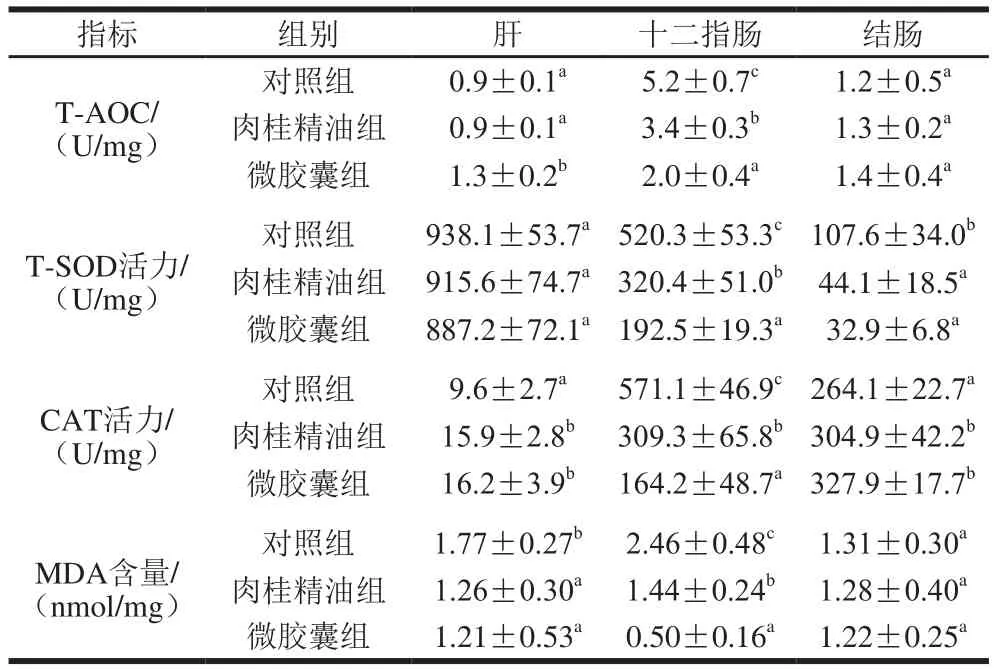
表3 肉桂精油微胶囊对小鼠抗氧化水平的影响Table 3 Effects of cinnamon oil microcapsules on antioxidant capacity in mice
2.4 肉桂精油微交囊对小鼠肠道菌群多样性的影响
如图2所示,为研究各组之间的相关性,本研究采用RDP classifier贝叶斯算法计算将共3 组24 个样本在97%相似水平上进行OTU聚类,共获得了381 个OTU。图2A中Rank-Abundance曲线表明样本的丰富度足够高,且它们之间的物种分布均匀;图2B显示,对照组独有的OTU为24 个,肉桂精油组独有的OTU为22 个,微交囊组独有的OTU为30 个;图2C、D显示,与对照组相比,肉桂精油组和微交囊组Sobs指数和Shannon指数均升高,且微交囊组与对照组的Shannon指数有显著差异(P<0.05)。结果表明肉桂精油微交囊能够提高肠道菌群的丰富度和多样性。

图2 小鼠肠道菌群分类学多样性分析Fig.2 Taxonomic analysis of gut microbiota in mice
基于OTU水平的主坐标分析(principal co-ordinates analysis,PCoA)如图3所示,PC1(49.43%)、PC2(22.94%)的权重最高。3 组间区别明显,表明肉桂精油和肉桂精油微交囊的摄入均能够影响小鼠肠道菌群的组成和结构,而与肉桂精油组相比,微交囊组和对照组在PC1水平上的距离更远,说明肉桂精油微交囊能够明显调节小鼠体内肠道菌群的组成和结构。
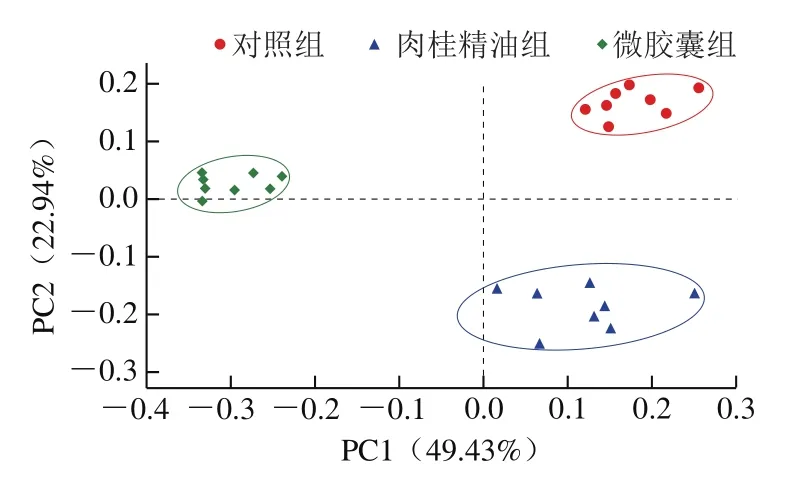
图3 OTU水平PCoA分析Fig.3 PCoA analysis of OTU levels
2.5 肉桂精油微交囊对小鼠肠道菌群物种组成的影响
基于门水平样本物种组成结构和差异性聚类分析可以发现,摄入肉桂精油后,小鼠粪便中拟杆菌门(Bacteroidetes)和疣微菌门(Verrucomicrobia)相对丰度增加明显,厚壁菌门(Fimicutes)和放线菌门(Actinobacteria)相对丰度减少;微交囊组较肉桂精油组的Bacteroidetes和变形菌门(Proteobacteria)相对丰度增加明显,Fimicutes、Verrucomicrobia和Actinobacteria相对丰度减少(图4A)。
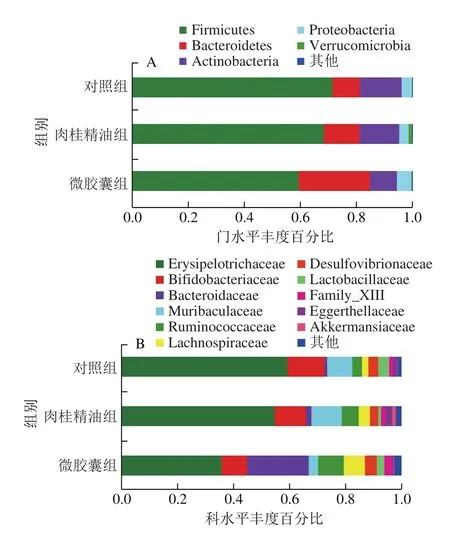
图4 小鼠肠道菌群门水平与科水平物种组成分析Fig.4 Analysis of bacterial community composition at the phylum and family levels in mice
由图4B可知,3 组小鼠肠道菌群的科水平群落变化,在摄入肉桂精油后,拟杆菌科(Bacteroidaceae)、Muribaculaceae、瘤胃菌科(Ruminococcaceae)、毛螺菌科(Lachnospiraceae)、伊格尔兹氏菌科(Eggerthellaceae)、阿克曼科(Akkermansiaceae)相对丰度上升,韦荣球菌科(Erysipelotrichaceae)、双歧杆菌科(Bifidobacteriaceae)、脱硫弧菌科(Desulfovibrionaceae)、乳杆菌科(Lactobacillaceae)相对丰度下降;此外,与肉桂精油组相比,微交囊组Bacteroidaceae、Ruminococcaceae、Lachnospiraceae、Desulfovibrionaceae、Lactobacillaceae和Family_XIII相对丰度上升,Erysipelotrichaceae、Bifidobacteriaceae、Muribaculaceae、Eggerthellaceae和Akkermansiaceae相对丰度下降。
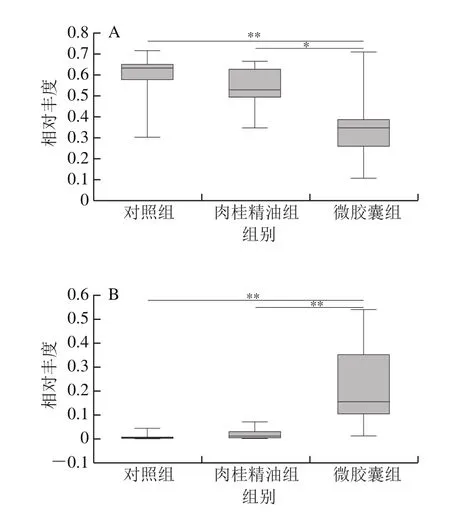
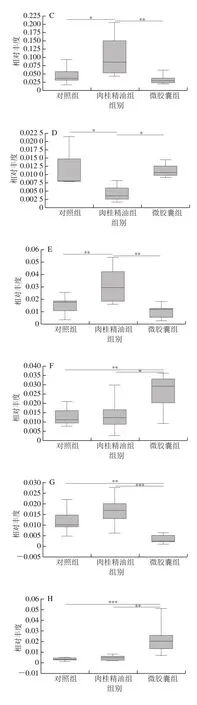
同时,采用单因素方差分析,对属水平下3 组样本中丰度前15的菌属差异性进行比较分析,共12 种菌属存在显著性差异,得到结果如图5所示。与对照组相比,摄入肉桂精油主要导致norank_f__Muribaculaceae、Ruminococcaceae_UCG-014和毛螺菌属(Lachnoclostridium)相对丰度显著增加,乳杆菌属(Lactobacillus)相对丰度显著降低(P<0.05);微交囊组与肉桂精油组相比,拟杆菌属(Bacteroides)、Lactobacillus、Family_XIII_AD3011_group、unclassified_f__Lachnospiraceae、布劳特氏菌属(Blautia)、瘤胃梭菌属(Ruminiclostridium)、norank_f__Lachnospiraceae相对丰度显著增加,而Faecalibaculum、norank_f__Muribaculacea、Ruminococcaceae_UCG-014、戈登氏杆菌属(Gordonibacter)相对丰度显著降低(P<0.05)。

图5 小鼠肠道微生物差异性菌属Fig.5 Differential genera of gut microbiota in mice
2.6 肉桂精油微交囊对小鼠粪便中SCFAs的影响

由图6可知,肉桂精油组较对照组相比,总SCFAs含量显著降低(P<0.05),而微交囊组中丙酸、丁酸、总SCFAs水平较对照组和肉桂精油组显著性提高(P<0.05),结果表明摄入肉桂精油微交囊可以提高肠道中产SCFAs微生物的丰度水平。

图6 3 组小鼠粪便SCFAs含量变化Fig.6 Changes in contents of fecal short-chain fatty acids in three groups of mice
3 讨 论
当机体自由基数量增多时会产生氧化应激,并造成肠道微生物的结构紊乱[21],而功能性膳食补充剂(如多酚和醛类等)的摄入可以有效清除自由基,促进益生菌的增殖并抑制条件致病菌的生长,提高抗氧化能力,从而维持机体健康[22-23]。微交囊技术由于能够维持芯材物理状态和生理活性、控制其可持续性释放等作用,已被广泛应用于食品与医药领域。目前,对于微交囊的研究多集中于制备方法和壁材种类的选择,而肉桂精油微交囊对于对小鼠抗氧化活性与肠道菌群影响的变化研究鲜有报道。Li Liang等[24]的研究表明,不同的制备方法和壁材种类会对微交囊的包埋率产生显著影响。本研究以价廉易得、无任何毒性、易生物降解的β-环糊精为壁材,采用包结络合法制备肉桂精油微交囊,β-环糊精能够对芯材特异性识别,在包埋的过程中选择性包合,本研究所得微交囊包埋率与文献[18,25]报道均在同等水平,制备出的微交囊释放效果均匀稳定,在使用的过程中能够缓慢在肠道释放发挥作用。
此外,本研究发现肉桂精油微交囊的摄入可显著增强小鼠肝T-AOC,表现出强抗氧化活性,而十二指肠CAT活力、T-SOD活力、T-AOC与氧化损伤指标MDA水平也下降,表明微交囊化肉桂精油在肠道缓释,可能延长其抗氧化作用时间从而导致机体内源性的抗氧化水平代偿性降低,而机体仍具有较强的干预氧化应激能力。因此,微交囊化的肉桂精油具有更强的干预氧化损伤的作用。
肉桂精油微交囊对机体氧化还原状态平衡的调节功能可能与小鼠肠道菌群的动态平衡密切相关[26],因此,可以通过16S rRNA V3~V4区域测序来探究其对肠道菌群的调节作用。肠道菌群门水平的研究结果表明,摄入肉桂精油可以增加小鼠肠道Bacteroidetes的相对丰度,减少Fimicutes的相对丰度,且能够提高肠道微生物的丰富度和多样性,这与文献[27]的结果相似。本研究中微交囊化的肉桂精油导致的Bacteroidetes丰度增加和Fimicutes丰度减少更为明显,且多样性指数提高。Bacteroidetes是肠道微生物群维持机体健康状态和稳态的主要参与者,在免疫失调、代谢综合征等疾病中具有积极作用[28],Fimicutes丰度的降低会导致肝脂质代谢增强[29],而肠道菌群的丰富度和多样性水平与肠道相关疾病的发生往往呈现负相关性[30]。因此,肉桂精油微交囊能够调节Bacteroidetes和Fimicutes丰度,提高肠道菌群的多样性,从而可能促进机体健康。
在属水平上,进一步通过差异分析,筛选出了肉桂精油微交囊显著调控的菌群,从而探究肠道菌群与抗氧化活性之间更胜层次的关联。本研究结果表明,微交囊组相比肉桂精油组,Bacteroides、Lactobacillus、Family_XIII_AD3011_group、unclassified_f__Lachnospiraceae、Blautia、Ruminiclostridium、norank_f__Lachnospiraceae相对丰度显著增加,而Faecalibaculum、norank_f__Muribaculacea、Ruminococcaceae_UCG-014、Gordonibacter相对丰度显著降低。Bacteroides和Lactobacillus是一类益生菌,Bacteroides可以抑制肠上皮细胞促炎核因子κB信号传导,并产生大量应激蛋白,从而抑制氧化应激的发生[31-32];Lactobacillus可以促进肠道内T细胞的生成,避免炎症性肠病的产生[33],此外,Liu等[34]的研究表明,Lactobacillus产生的胞外多糖可以刺激巨噬细胞产生细胞因子,表现出体外的自由基清除功能,而这种体外的强抗氧化能力与体内实验中氧化应激的缓解程度呈现正相关性[35]。
Faecalibaculum作为革兰氏阳性专性厌氧菌,被认为是肠道中Lactobacillus的主要替代物,能够促进乳酸的产生和碳水化合物的代谢[36]。norank_f_Muribaculaceae、Ruminococcaceae_UCG-014、Gordonibacter属于机会致病菌,其丰度的增加与高血压、肠炎等疾病的发生有关[37-38]。Wang Hao等[39]对肠道菌群与氧化应激关联分析研究表明,Ruminococcaceae_UCG-014的丰度与机体抗氧化能力呈负相关性。此外,Family_XIII_AD3011_group、unclassified_f__Lachnospiraceae、Blautia、Ruminiclostridium是一类产SCFAs菌属[40]。SCFAs作为重要的菌群代谢产物,可以驱动宿主与肠道微生物组之间的相互作用[41],并与G蛋白偶联受体结合促进宿主免疫力,为上皮细胞提供能量以刺激细胞增殖、分化和成熟,减少细胞凋亡[42]。本研究中,微交囊组SCFAs水平均增加,其中丙酸和丁酸水平较肉桂精油组显著增加。而丙酸已被证实可以抑制胆固醇合成,有利于碳水化合物和脂质的代谢[43],丁酸对于维持肠上皮屏障具有正向作用,并且能够通过调节T细胞的分化,来抵抗克罗恩病等肠炎疾病症状的发生[44-45],临床研究表明,结肠微生物发酵产生的丁酸还能够有效缓解肠炎患者肠道的低水平炎症和氧化应激[46]。
肉桂精油微交囊对于肠道菌群的调控也可能与其缓释作用有关。本研究表明肉桂精油微交囊可在模拟消化道环境缓释,可能是微交囊化使得各阶段释放的包埋物质位于微交囊空腔的不同位置,从而延缓了包埋物质的释放[47]。这种缓释作用可能避免肉桂精油对肠道内有益菌微生物(Bacteroides、Lactobacillus等)的抑制作用,同时,Janatova等[48]的研究表明,包埋后的微交囊在持续释放期间仍具有较强抑制有害菌的活性。而最近的研究表明,不同微生物对肉桂精油的敏感性有所不同[49]。因此,微交囊化的缓释作用可能降低进入肠道初期释放肉桂精油的剂量,延长了肉桂精油作用的时间,避免了对敏感度较高的有益菌群产生抑制,同时增强了部分有害菌的抑制作用,从而具有更强的调节肠道菌群平衡的作用,相关直接证据有待后续的进一步的研究证实。
本研究表明,肉桂精油微交囊能够提高肠道菌群多样性,维持肠道稳态,调控肠道菌群结构,通过促进Bacteroides和Lactobacillus等有益菌的丰度,抑制Ruminococcaceae_UCG-014等条件致病菌的增殖,提高机体抵御氧化应激的能力,并促进肠道SCFAs的产生,发挥丙酸和丁酸促进机体代谢、维持机体健康的正向功能。

