梨Shaker基因家族的鉴定及其响应低钾和盐胁迫的表达分析
金雨濛,李岩,杨晗,阚丽平,徐阳春,董彩霞*,沈其荣
(1.南京农业大学资源与环境科学学院/江苏省固体有机废弃物资源化研究重点实验室/江苏省有机固体废弃物协同创新中心/教育部资源节约型肥料工程技术研究中心,江苏 南京 210095;2.湖北工程学院生命科学学院,湖北 孝感 432000)
钾通道是以多聚体蛋白的形式起作用,根据α亚基构型差异将钾通道划分为3个家族:Shaker、TPK和Kir-like钾离子通道家族。Shaker家族是最早通过生物分子技术鉴定出来的钾离子通道家族,在植物根系的钾吸收、K+的长距离运输、细胞生长、花粉管伸长和气孔运动等方面都起着重要作用[1]。Shaker钾离子通道的第4个跨膜片段S4含有大量带正电荷的氨基酸残基,是响应膜电势变化的电压感受器[2]。根据电压的依赖性及K+运输方向的不同,可将Shaker钾离子通道家族成员分为3类:内向整流型IR钾离子通道(inward rectifier K+channel)、外向整流型OR钾离子通道(out-ward rectifier K+channel)、弱整流型WR钾离子通道(weakly inward rectifier K+channel)[3]。Shaker家族在不同的植物中广泛存在,在马铃薯(Solanumtuberosum)[4]、水稻(Oryzasativa)[5]、烟草(Nicotianatabacum)[6]、玉米(Zeamays)[7]、草莓(FragariaananassaDuch)[8]和葡萄(Vitisvinifera)[9]中已鉴定出该家族成员。此外,Shaker家族第1个报道的钾离子通道蛋白基因AKT1是在拟南芥(Arabidopsisthaliana)中克隆到的,不仅在钾离子吸收和耐低钾胁迫中起重要作用,还能通过维持细胞质内K+/Na+来适应高盐环境[10]。同样,Rdenas等[11]指出,AtSKOR钾离子通道不仅能介导钾向木质部的运输,而且在盐胁迫下显著上调,从而提高植物的耐盐能力[12]。
全球超过9.5亿hm2的农业用地土壤盐分过高,土壤盐渍化已成为影响园艺作物种植面积和产量的重要因素之一[13]。杜梨(Pyrusbetulaefolia)根系发达、适应环境能力强,具有抗寒、抗涝、耐旱和耐盐等优良特性,是我国优良的梨砧木资源[14]。钾被称为“品质元素”,在梨树生长发育中起重要作用。本研究通过比对梨和拟南芥基因组数据,对梨中的Shaker钾离子通道家族进行系统鉴定,利用生物信息学和荧光定量分析其家族成员在低钾和盐胁迫下的表达模式,为培育钾高效及耐盐砧木提供理论依据。
1 材料与方法
1.1 植物材料、生长条件和处理
杜梨(Pyrusbetulifolia)种子经2.5%次氯酸钠(氯有效浓度:11.92 g·L-1)消毒后置于砂土中低温层积2个月,将露白的种子播种于基质(蛭石与营养土质量比为1∶1)中,置于光照培养箱培养,培养温度(25±0.5)℃,光/暗周期为16 h/8 h,相对湿度为75%,光照强度为300 μmol·m-2·s-1。生长期间对幼苗进行常规管理并以清水浇灌,待幼苗长到4~6片,将长势一致的杜梨苗移至1/4霍格兰营养液中培养缓苗[霍格兰营养液成分组成:Ca(NO3)2·4H2O 945 mg·L-1、KNO3506 mg·L-1、NH4NO380 mg·L-1、KH2PO4136 mg·L-1、MgSO4241 mg·L-1、FeNaEDTA 36.7 mg·L-1、KI 0.83 mg·L-1、H3BO36.2 mg·L-1、MnSO4·H2O 16.9 mg·L-1、ZnSO4·7H2O 8.6 mg·L-1、Na2MoO4·2H2O 0.25 mg·L-1、CuSO4·5H2O 0.025 mg·L-1、CoCl2·6H2O 0.025 mg·L-1,pH(25 ℃)=5.8±0.2]。待幼苗适应良好后,选长势一致的幼苗进行不同处理:适钾处理(CK)营养液中的K+浓度为3 mmol·L-1,低钾处理(LK)营养液中K+浓度为0.1 mmol·L-1;盐处理(NaCl)营养液中K+浓度为3 mmol·L-1,轻度盐胁迫NaCl浓度为50 mmol·L-1,重度盐胁迫NaCl浓度为200 mmol·L-1。每个处理 30株,处理15 d后,每个处理取9株杜梨幼苗的根于液氮中速冻,保存于-80 ℃冰箱中备用。
1.2 梨Shaker基因的鉴定
根据中国白梨(Pyrusbretschneideri)测序数据,从网站(http://peargenome.njau.edu.cn/)下载梨基因组序列信息[15];苹果(Malusdomestica)、碧桃(Prunuspersica)和草莓(Fragariavesca)的序列信息来源于蔷薇科基因组数据库(GDR)(http://www.bioinfo.wsu.edu/gdr/);拟南芥(Arabidopsisthaliana)基因组序列信息来源于拟南芥信息资源库(http://www.arabidopsis.org/);水稻(Oryzasativa)基因组序列信息下载于网站(http://rice.plantbiology.msu.edu/);毛果杨(Poplustrichocarpa)基因组序列信息下载于网站(http://www.plantgdb.org/PtGDB/);番茄(Solanumlycopersicum)基因组序列信息来源于番茄基因组数据库(SGN)(http://solgenomics.net/);葡萄(Vitisvinifera)、云杉(Piceaabies)、洛矶山耧斗菜(Aquilegiacoerulea)、黄瓜(Cucumissativus)、无油樟(Amborellatrichopoda)、蒺藜状苜蓿(Medicagotruncatula)、荷花(Nelumbonucifera)、大叶藻(Zosteramarina)和小立碗藓(Physcomitrellapatens)的基因组序列信息均来源于Phytozome数据库(https://phytozome.jgi.doe.gov/pz/portal.html)。
根据拟南芥和水稻中已鉴定的Shaker成员的蛋白序列,对梨的基因组数据进行BLAST筛选,将其比对获得的梨Shaker家族蛋白序列文件保存为候选序列。使用HMMER(http://www.hmmer.org/)、Pfam(http://pfam.xfam.org/)及SMART(http://smart.embl-heidelberg.de)进一步对候选基因进行筛查,选择具有完整Shaker保守结构域的序列进行后续分析。
1.3 梨Shaker钾通道蛋白的序列分析
从梨基因组序列数据库中检索到Shaker-like基因的登录号、序列数据和染色体定位。用ExPASy Protparam(http://web.expasy.org/protparam/)预测编码蛋白的理化性质,利用WoLF-PSORT预测PbShaker的亚细胞定位,并使用TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)预测蛋白跨膜结构。利用Gene Structure Display Server(GSDS)(http://gsds.cbi.pku.edu.cn/)分析基因外显子/内含子结构。利用MEME软件(http://meme-suite.org/)分析梨Shaker蛋白中的保守基序(motif)。设置参数如下:最大数目为20;最小宽度为6 bp;最大宽度为50 bp。利用SMART数据库(http://smart.embl-heidelberg.de/)分析拟南芥和梨Shaker蛋白的结构域。
1.4 梨Shaker蛋白进化分析
利用梨等植物的Shaker蛋白序列与已报道的水稻、拟南芥等植物的Shaker蛋白序列进行进化树分析。通过Clustal W同源序列比对,利用MEGA 5.0软件,采用邻接法(neighbor-joining)构建系统进化树,参数设置为:bootstrap 1 000次重复、泊松修正(Poission model)和配对删除(pairwise deletion)。
1.5 直系同源基因和旁系同源基因的鉴定和基因复制分析
利用OrthoMCL(v2.0.3)从拟南芥、水稻与梨的Shaker基因家族中搜索直系同源基因和旁系同源基因[16]。利用BLASTp比对和OrthoMCL查找同源基因,比对阈值设置为l×10-5。利用可视化软件Circos(http://circos.ca/)将找到的直系同源基因和旁系同源基因显示于染色体上。利用kaks_Calculator 2.0计算核苷酸的非同义替换速率(nonsynonymous substitution rate,ka)、同义替换速率(synonymous substitution rate,ks)及两者比率ka/ks。
基因复制在基因组进化过程中起着重要作用,MCScanX被用于分析拟南芥、水稻和梨中Shaker基因的基因复制事件,并将每个基因归为全基因组/片段复制(WGD/segmental duplication)、串联复制(tandem duplication)、分散复制(dispersed duplication)、近端复制(proximal duplication)和单态性复制(singleton duplication)。
1.6 梨Shaker基因启动子顺式作用元件的鉴定
通过梨全基因组数据获得PbShaker的起始密码子ATG上游2 000 bp的序列作为Shaker家族的启动子序列,利用在线软件PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测,并分析不同成员启动子顺式作用元件特性。
1.7 杜梨根部RNA提取与实时荧光定量PCR分析
采用CTAB方法提取不同处理杜梨根部的RNA。使用DNAMAN 6.0软件对Shaker成员设计qPCR引物(表1),以18S rRNA为内参基因,引物由北京擎科新业生物技术有限公司合成。用反转录试剂盒(Prime Script RT reagent Kit,TaKaRa)合成cDNA;用实时荧光定量PCR仪(Lighycler®96 Real-Time PCR System,Roche)和SYBR GreenⅠ试剂盒(TaKaRa)进行该家族基因在不同处理下表达量的分析。反应体系(20 μL):cDNA 3 μL,ddH2O 5μL,上、下游引物各1 μL、SYBR 10 μL。反应程序为:94 ℃ 5 s,60 ℃ 30 s,72 ℃ 30 s,40个循环。以对照Actin(Pbr024344.1)为内参基因,采用2-ΔΔCT法计算各基因的相对表达量,每个样品重复3次。
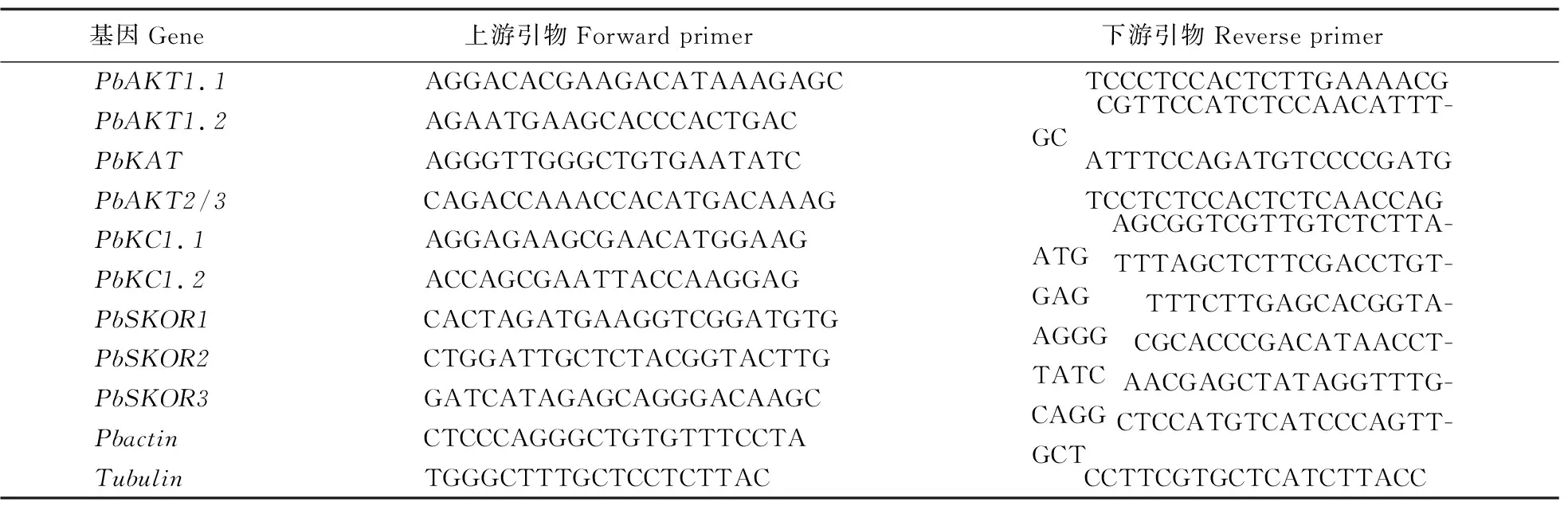
表1 梨Shaker基因所用定量引物Table 1 Quantitative primers of PbShaker
2 结果与分析
2.1 梨Shaker候选基因的确定及染色体的定位
根据拟南芥和水稻中已鉴定的Shaker序列进行BLAST序列分析,最终从梨基因组中鉴定了9个Shaker基因,用类似的方法,又从其他14个植物基因组中共鉴定出131个Shaker基因。梨Shaker基因家族成员根据与拟南芥中对应的同源基因命名。将这9个PbShaker基因进行染色体定位分析,发现其并不是均匀分布在染色体上,其中8个PbShaker基因定位在7个染色体上,1个基因定位于染色体骨架Scaffold 1090.0上(图1)。

图1 梨Shaker基因在染色体上的分布Fig.1 Distribution of Shaker genes in pear chromosomes
由表2可见:梨Shaker蛋白长度为587~1 481个氨基酸残基,相对分子质量为(67.91~168.80)×103,pI为6.23~8.80。TMHMM预测结果显示:所有梨Shaker蛋白含有3~7个跨膜结构域。梨Shaker蛋白主要分布在质膜、液泡膜、内质网、叶绿体、高尔基体和核膜上。
2.2 植物Shaker基因家族的遗传进化分析
对来自17种植物中的共151个Shaker氨基酸序列进行进化分析,结果(图2)表明:梨Shaker家族基因可分为5个亚族,其中Ⅰ亚族包括AKT1、SPIK和AKT5,Ⅱ亚族包括KAT1和KAT2,Ⅲ亚族包括AKT2,Ⅳ亚族包括KC1,Ⅴ亚族包括SKOR和GORK基因。如图2-A所示:Shaker蛋白在植物中分布不均匀。17种植物中Shaker基因在染色体上的分布频率差异较大。Shaker基因分布频率最高的物种为拟南芥(6.7×10-2/Mb),分布频率最低的物种是挪威云杉(6.7×10-4/Mb)。此外,Ⅴ亚族在17种植物基因组中都存在,而Ⅰ—Ⅳ亚族分别在挪威云杉、大叶藻、毛果杨及无油樟中缺失,这表明Ⅴ亚族在进化过程中最为保守。
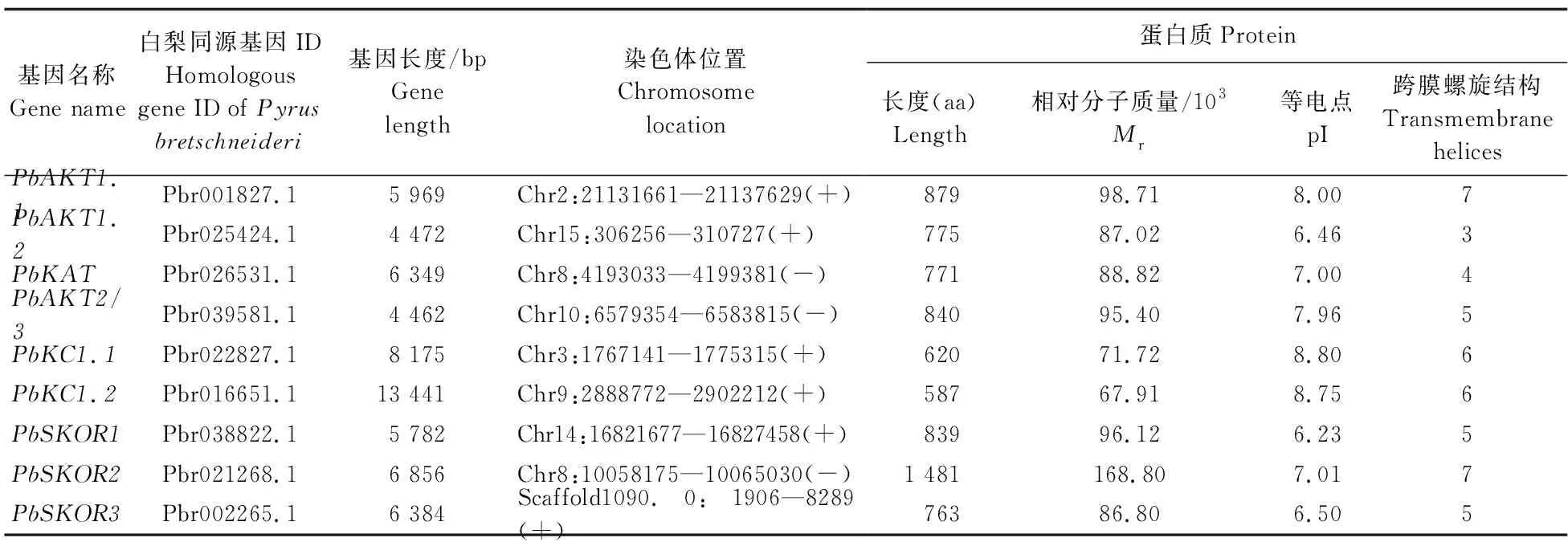
表2 梨Shaker家族成员的理化性质Table 2 Physical and chemical properties of PbShaker family member
根据进化树(图2-B),Ⅰ—Ⅴ亚族分别含有2、1、1、2及3个梨Shaker蛋白。此外,拟南芥的1个Shaker蛋白通常只对应1个梨、葡萄、草莓的同源蛋白,但却对应3个苹果的同源蛋白,这表明Shaker家族在苹果基因组中明显扩张。同一个分支下的梨与拟南芥的Shaker蛋白节点处的bootstrap值都较高,由此推测它们起源相同且在进化过程中变化不大。与其他植物Shaker蛋白分为多个亚族不同,4个小立碗藓(Physcomitrellapatens)中的Shaker蛋白构成一个独立的分支。由此推测,Shaker基因家族可能在由苔藓植物向陆生植物进化的过程中出现功能分化。低等的苔藓植物不需要功能复杂的钾转运系统,而高等陆生植物需要多样的钾转运系统以适应复杂的外界环境。

图2 梨Shaker基因家族在植物中的进化分析和分布改图Fig.2 The evolutionary analysis and distribution of the different type PbShaker genes in plantsA. Shaker基因家族在植物中进化分析;B. 不同类型Shaker基因在植物中的分布。A. Evolutionary analysis of Shaker gene family in plants;B. The distribution of different types of Shaker genes in plants.
2.3 共线性分析梨Shaker基因家族的起源及扩张方式
利用OrthoMCL在梨、拟南芥和水稻的Shaker基因中发掘直系同源基因对和旁系同源基因对,结果(图3)发现:在拟南芥和水稻中鉴定出31对直系同源基因对和11对共直系同源基因对;在拟南芥和梨中共发现27对直系同源基因对和5对共直系同源基因对;在水稻和梨中共鉴定23对直系同源基因对和9对共直系同源基因对。
2.4 梨Shaker家族成员的基因结构和基序分析
为进一步了解梨Shaker家族成员的结构,对获得的梨Shaker家族成员的CDS序列和对应的基因序列进行内含子和外显子结构分析,并确定保守的基序(图4)。内含子长度略有不同,但各组内Shaker基因的内含子数目和位置相似。在梨的Shaker基因中有9个内含子,且内含子长度比外显子长度更长(图4-A)。梨Shaker家族共鉴定出20个保守基序(图4-B,图5)。其中,motif 1、motif 4和motif 10是梨Shaker家族典型的保守基序,在每个亚家族中均存在。此外,一些基序只存在于某些特定的亚族中,例如,在梨Shaker家族中第Ⅳ亚族含有特异的motif 16和第Ⅴ亚族中特异的motif 19(图4-B)。多序列比对表明,T/sxtxxgxg基序位于孔(P)域,这对K+的选择起重要作用,在S5和S6跨膜段之间高度保守。S4段保守的重复碱基残基(R和K)可能将膜电压的变化与孔的打开和关闭相耦合。
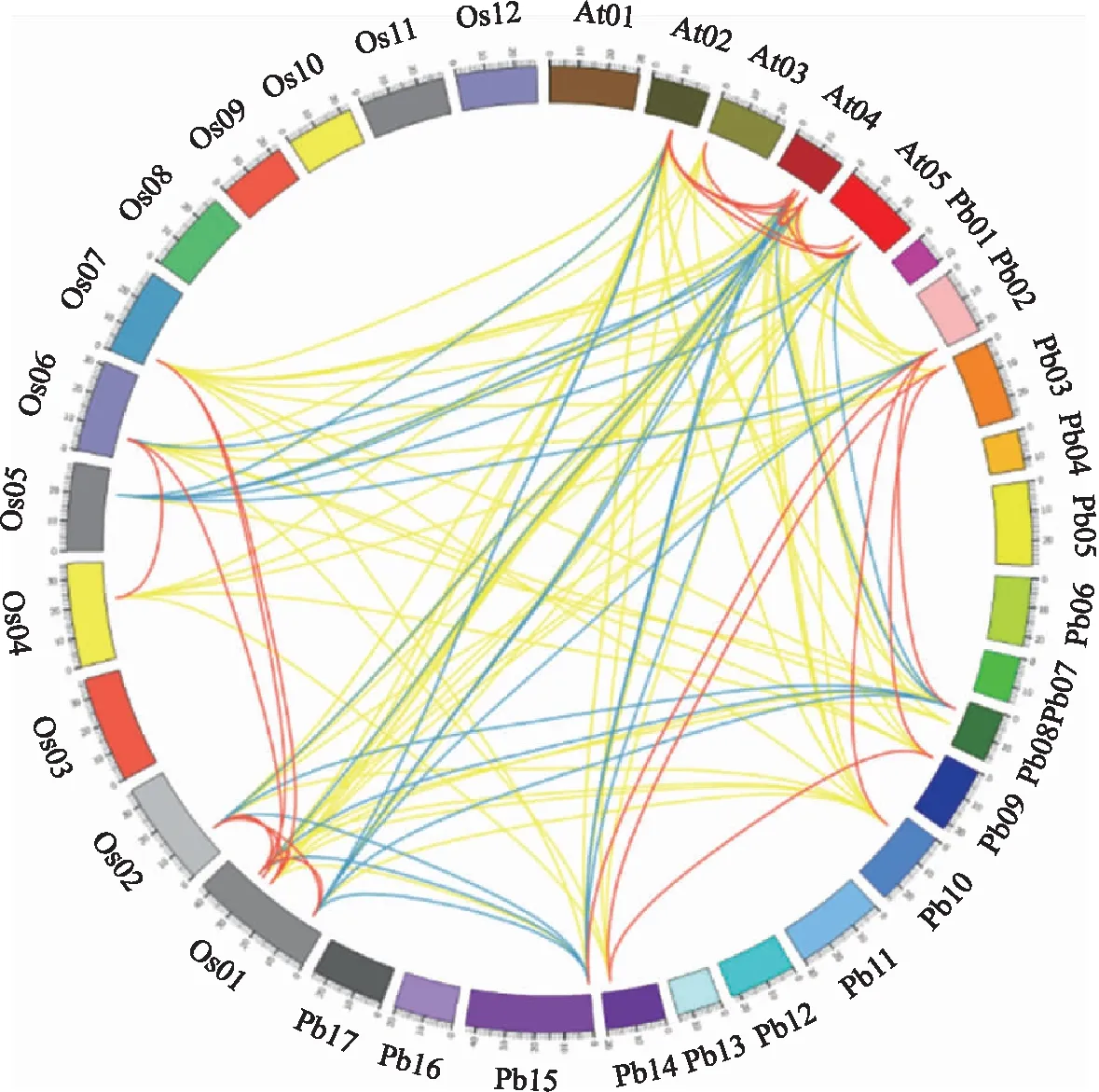
图3 梨、拟南芥和水稻中Shaker基因的共线性分析Fig.3 Synteny of Shaker genes in pear,Arabidopsis and rice genomes

图4 梨Shaker家族成员基因结构Fig.4 The exon/intron structure of pear Shaker family members A. 黄条、黑线和蓝条分别表示外显子、内含子和UTR区,线条长度与基因的长度呈一定比例。0、1、2代表不同的内含子相位。B. 保守基序(motif 1~20)在梨Shaker蛋白上的分布。A. Exons are indicated by yellow boxes,introns by black lines,and untranslated regions(UTR)by blue boxes. The lengths of the boxes and lines are showed based on the length of the genes. 0,1 and 2 indicate intron phase. B. Distribution of conserved motifs(1-20)of Shaker in pear.
如图6-A所示:梨和拟南芥中的大多数Shaker蛋白包含1个K+跨膜转运的离子结构域_trans_2、1个环核苷酸结合(cNMP)结构域、几个用于与其他调节蛋白相互作用的ankyrin结构域(ANK),在亚基四聚反应的极端C端有1个KHA结构域(富含疏水性和酸性残基)。但在PbSKOR3中没有KHA结构域,而在Ⅱ亚族和Ⅳ亚族中没有ANK结构域。除PbSKOR2和PbSKOR3外,所有梨Shaker家族基因按结构可分为3类(图5)。同一亚族的Shaker家族基因具有相似的结构模型,可能反映了每个Shaker基因家族的功能保守性。PbShaker蛋白中除了第Ⅳ亚族外,其他亚族都含有多个锚蛋白结合位点(ANK),该结构的差异可能影响蛋白之间的互作。此外,AKT亚族一般具有5个锚蛋白重复序列,这是植物内向整流K+通道AKT子家族的显著特征(图6-B)。

图5 梨Shaker家族保守基序分析Fig.5 Conservative motif analysis of PbShaker family
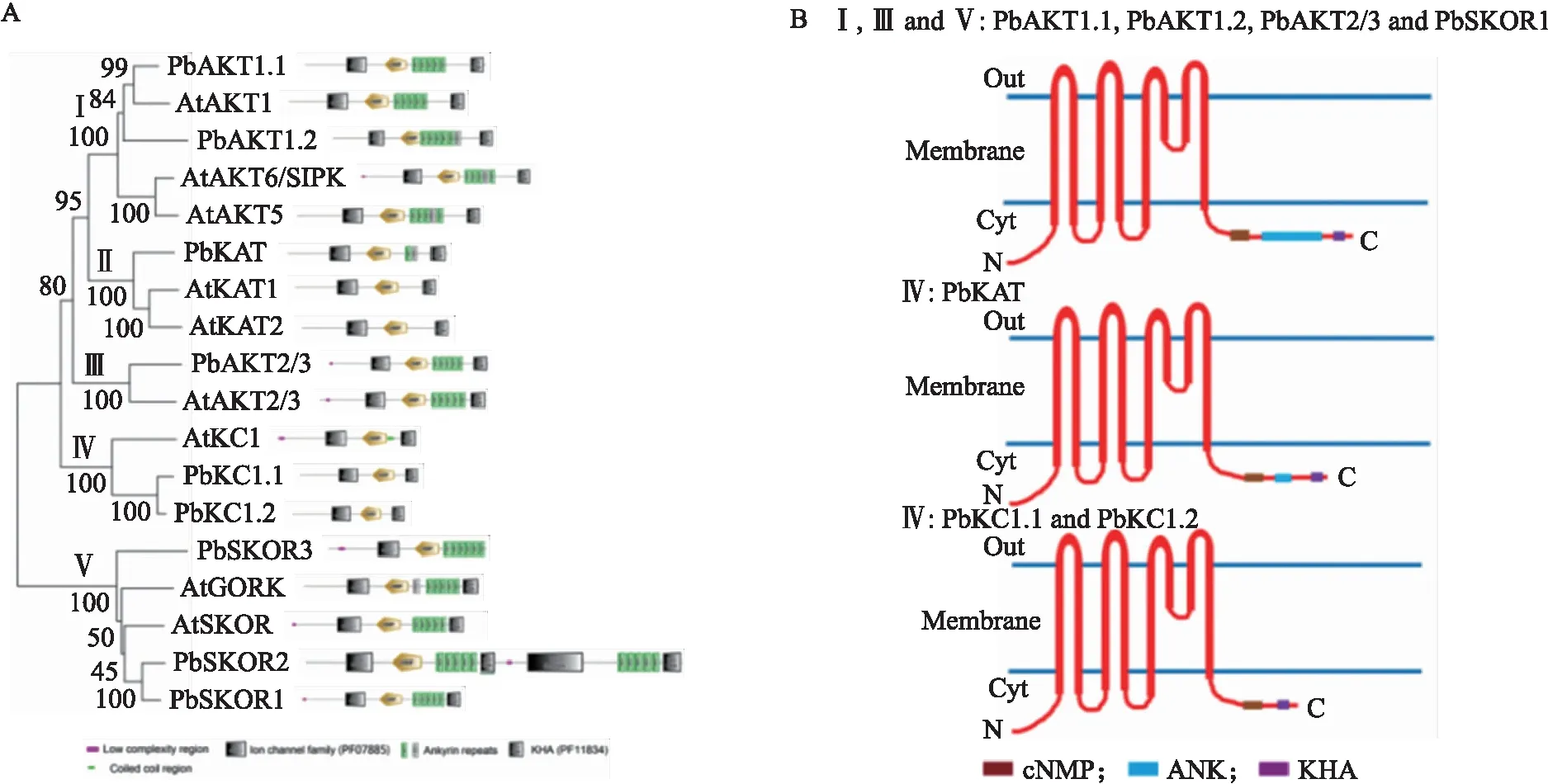
图6 梨Shaker蛋白的结构域(A)和结构模型(B)Fig.6 Domain organization(A)and structure model(B)of PbShaker cNMP:环核苷酸结构域Cyclic nucleotides domain;ANK:锚定蛋白结构域Ankyrin;KHA:钾离子通道蛋白二聚体结构域Potassium channel dimer domain.
2.5 梨Shaker基因启动子分析
对梨Shaker家族所有基因转录起始位点上游2 000碱基对的启动子序列进行分析,结果(表3)表明:大多数Shaker成员具有胁迫响应元件,包括ABA响应元件(ABRE)、生长素响应元件(TGA-element)、低温响应元件(LTR)、乙烯响应元件(ERE)、防御与应激元件(TC-rich repeats)、MeJA响应元件(CGTCA-motif、TGACG-motif)、干旱响应元件(MBS)、抗氧化响应元件(ARE)、赤霉素响应元件(P-box、TATC-box)和受伤响应元件(WUN-motif),推测该家族成员可能参与抵御干旱、低温、盐、受伤胁迫及响应脱落酸、生长素、乙烯和茉莉酸脂等激素调控过程。其次还包括光信号元件(BOX-4),表明该家族可能参与光周期调控。另外,某些家族成员还含有许多调控分生组织表达(CAT-box)、昼夜节律、细胞周期等生长发育相关元件。
2.6 梨Shaker家族基因在低钾和盐胁迫下的表达模式
如图7-A所示:根系中9个梨Shaker家族成员在低钾胁迫下,PbAKT1.1和PbKC1.2的表达量分别上调41%和50%,PbAKT2/3的表达量在低钾处理下均上调290%,而PbSKOR1/2在低钾处理下下调53%和46%。在盐胁迫下,PbShaker家族基因的表达量均发生不同程度的上调(图7-B),表明钠离子可以促进PbShaker家族基因的表达。其中,PbSKOR1/2/3表达量在轻度盐胁迫(50 mmol·L-1NaCl)和重度盐胁迫(200 mmol·L-1NaCl)下都明显上调,PbSKOR1在轻度盐胁迫和重度盐胁迫下表达量分别上调45和48倍。PbAKT1.1和PbAKT1.2在轻度盐胁迫下的表达量均高于在重度盐胁迫下的表达量,重度盐胁迫抑制PbAKT1.1/1.2的转录丰度。PbKC1.2表达量则随盐胁迫增加而显著增加。

表3 PbShaker基因启动子顺式作用元件的种类与数目Table 3 Types and numbers of cis-elements of PbShaker gene promoter
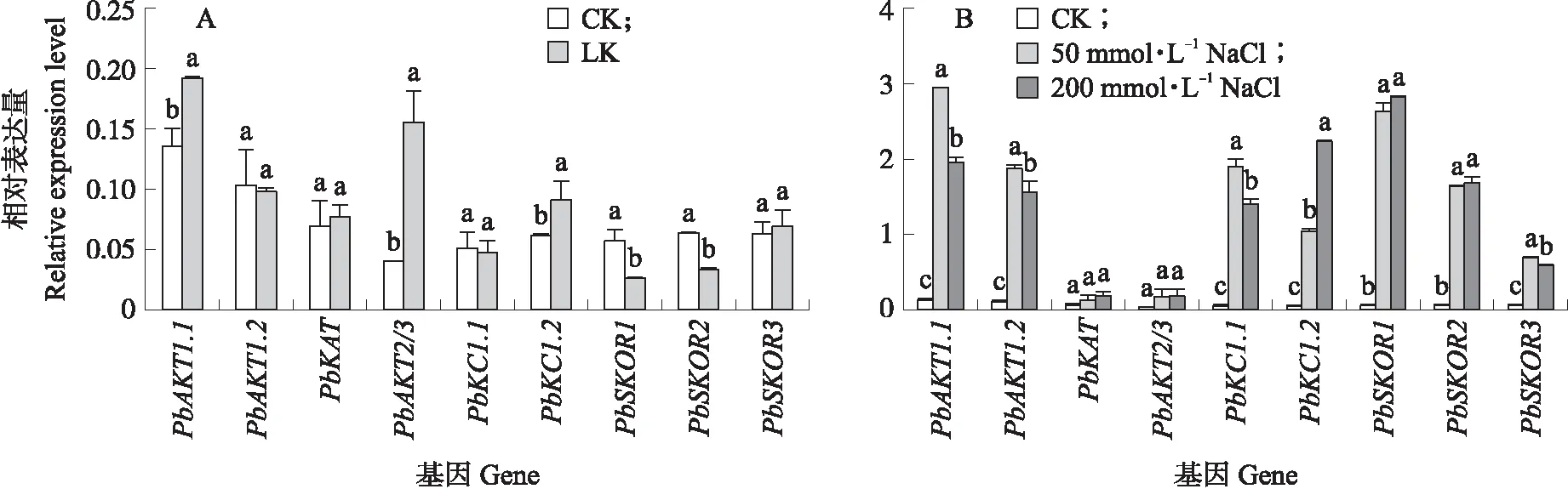
图7 杜梨Shaker基因家族在低钾胁迫(A)和盐胁迫(B)下的表达分析Fig.7 Expression analysis of PbShaker gene family under low potassium stress and salt stress A. CK为适钾处理(3 mmol·L-1 K+),LK为低钾处理(0.1 mmol·L-1 K+)。B. CK为适钾处理(3 mmol·L-1 K+),50 mmol·L-1 NaCl为轻度盐胁迫,200 mmol·L-1 NaCl为重度盐胁迫。不同小写字母表示同一个基因在不同处理间差异显著(P<0.05)。A. CK is suitable potassium treatment(3 mmol·L-1 K+),LK is low potassium treatment(0.1 mmol·L-1 K+). B. CK is suitable potassium treatment(3 mmol·L-1 K+),50 mmol·L-1 NaCl was mild salt stress,200 mmol·L-1 NaCl was severe salt stress. Different lowercase letters indicated that the same gene had significant difference at 0.05 level among different treatments.
3 讨论
3.1 梨Shaker基因序列结构与进化特征
在植物中Shaker钾离子通道家族对调节植物体内钾稳态有重要作用,大量的Shaker通道基因参与K+的吸收和转运[17]。然而,人们对Shaker的研究主要集中在模式植物拟南芥和一些大田作物如烟草和水稻中,这对充分诠释这类基因的功能具有很大的局限性。由于梨基因组测序的完成,从全基因组的角度研究梨Shaker基因家族成为可能[15]。本研究通过对梨基因组序列分析,确定9个PbShaker钾通道基因,又从其他15种植物中鉴定131个Shaker钾离子通道基因,根据系统进化树分析,PbShaker家族被分为5个亚族,Ⅰ亚族成员数目最多,Ⅲ亚族成员数量最少,这与前人的研究结果[18]一致,其中Ⅴ亚族在17个植物基因组中都存在,这表明该亚族在植物中较保守。梨中Shaker基因的数量(9个)与桃(7个)、拟南芥(9个)和水稻(11个)中的数量相近,但低于苹果(18个)和番茄(22个),因此Shaker基因在植物中的分布是不均匀的,可以调整基因组大小的差异。大多数来自单子叶植物和双子叶植物的Shaker基因进化在同一分支,表明这些基因在这些亚族分化之前就发生了变异。多数的梨Shaker旁系同源基因具有相似的基序(motif),这说明它们之间功能的保守性,也有部分旁系同源基因具有不同的基序,这部分基因可能在进化过程中产生了功能分化。通过MEME分析共鉴定20个基序,且大部分被预测为K+转运域的组成部分。共线性分析可以提供对基因功能和进化的见解,当一个分类学谱系分裂时产生的同源基因可能在不同的基因组中保留相同的功能[19]。梨与拟南芥之间的同源Shaker基因多于水稻,这与植物之间的系统发育关系一致。基因复制在产生新基因和扩展基因家族中起着至关重要的作用[20]。梨中Shaker基因家族的扩展可能是蔷薇科苹果亚科WGD和基因组复制的结果[15,21]。梨、拟南芥和水稻中与旁系同源Shaker基因相关的ka/ks比值均低于1.0,这表明这些基因在复制后的进化过程中经历了净化选择[19]。PbShaker基因启动子中含有与胁迫相关的元件,表明PbShaker蛋白不仅在植物生长发育过程中发挥重要作用,且在逆境胁迫中也发挥重要作用。其中,AKT1.2含有较多调控脱落酸元件(ABRE),在干旱、寒冷、高温、盐渍和水涝等逆境中增强植物抗逆性。PbAKT2/3、PbSKOR2和PbKC1.2基因可能是受伤响应基因。
3.2 梨Shaker基因在低钾和盐胁迫下的响应特征
钾是维持植物生长和产量所必需的营养元素[22]。Shaker钾离子通道家族基因在根中表达量的变化可以调控K+的积累和地上部K+的浓度[23]。在拟南芥根细胞中,AtKC1的表达受低钾瞬时诱导,AtKC1亚基可以与AKT1通道亚基组装,还可以与其他内向整流K+通道亚基AtKAT1、AtKAT2和AKT2/3发生异源聚合,异聚体通道对外部低钾表现出更强的敏感性,防止K+损失[24]。本研究中,在低钾胁迫下杜梨幼苗根系中PbAKT1.1、PbAKT2/3和PbKC1.2的表达量显著上调,可能直接在转录水平上响应低钾胁迫。Pilot等[18]和吴娟娟等[25]研究指出低钾胁迫条件下拟南芥AKT1基因和柑橘同源基因CsKT1地上部和地下部转录水平均无变化。本研究中,梨在低钾胁迫下PbAKT1.1表达量上调,推测其通过对低钾胁迫的转录调控来影响其功能。植物缺钾时,除了通过上述机制来促进钾吸收外,一些顺式作用元件在调控植物对胁迫耐性中起关键作用,PbAKT1.1、PbAKT2/3和PbKC1.2均含有生长素响应元件(TGA-box)、乙烯响应元件(ERE)、光反应元件(BOX-4)和抗氧化响应元件(ARE)。有研究表明,乙烯和活性氧在调控植物对缺钾胁迫耐性中具有重要作用[26],可协同诱导防御相关基因的表达和调节植物的抗性[27]。转录因子RAP2.11可以在低钾条件下与AtHAK5启动子中的ERE结构域相结合,从而启动基因表达,使植物充分吸收外界环境中有限的钾离子[28],推测富含ERE元件的PbAKT1.1、PbAKT2/3和PbKC1.2基因可能参与植物对钾的吸收。拟南芥中的Shaker钾通道SKOR在K+从根部柱细胞释放到木质部汁液中及地下部运输过程中起重要作用[29]。本研究中,PbSKOR1/2在低钾胁迫下表达量明显下调。因此,推测杜梨根部K+浓度可调节PbSKOR1/2向木质部运输K+,低钾胁迫降低K+从地下部向地上部的运输,增加韧皮部K+的再循环,更有助于K+在根部的积累。
近几年来,有学者认为钾离子通道和钠离子通道是关联的。在本研究中,轻度和重度盐胁迫下,多数PbShaker基因表达量显著上调,可能行使钾离子和钠离子的同向转运和双向转运,有利于维持细胞内Na+/K+的平衡,在糖原植物耐盐机制中起着重要作用[13]。盐胁迫下的外整流K+通道蛋白SKOR可能是唯一对木质部汁液中钾分泌起作用的Shaker钾离子通道,它的活性可由木质部薄壁细胞中Na+不断积累引起的薄壁细胞质膜去极化而被激活,进而将K+装载到木质部运往地上部。本研究中,PbSKOR1/2/3的表达量在盐胁迫下均上调,这与木本植物霸王中同源基因ZxSKOR[30]和烟草中同源基因NtSKOR研究结果一致[31],推测重度盐胁迫诱导SKOR表达,向地上部转运更多K+,在根中表达量主要受低钾处理抑制和高盐诱导。水稻OsAKT1在盐胁迫下被诱导转录[32]。本研究中,PbAKT1.1/1.2在轻度盐胁迫下转录水平高于重度盐胁迫,推测通过反馈调节刺激位于表皮、皮层和内皮层的PbAKT1表达,能促进更多的K+积累。轻度盐胁迫下,PbSKOR的转录水平降低,从而负反馈调节PbAKT1的表达,增加根系对K+的吸收,从而提高植物的抗逆性,这与盐生植物小花碱茅研究结果一致[33]。PbKAT主要在叶片中表达,受外源Na+调控,可能在梨耐盐性调控中起重要作用[34]。本研究中,PbKAT的表达量在根中较低,且随盐浓度的增加而增加。

