新生儿B族链球菌感染的临床分析
金兰,赖静,张小霞,王僖
云南省滇南中心医院儿科,云南蒙自661199
B族链球菌通常指无乳链球菌。无乳链球菌(streptococcus agalactiae,GBS)是一种革兰阳性链球菌,B族链球菌主要是细胞壁中存在多糖物质,属于条件致病菌体[1],一般情况下在阴道和直肠中寄存,还会上行到泌尿系统中发生宫内感染,菌血症等[2]。其中B族链球菌的感染和产褥感染、胎儿窘迫、胎膜早破、晚期流产以及新生儿败血症的发生有关联。B族链球菌所造成的女性生殖系统感染,会进一步导致围生期感染率提升[3]。因此目前B族链球菌已经被外国列入到围生期感染的重要病原菌之一。根据不完全统计分析,将近有30.00%的孕妇感染B族链球菌,且统计证实,美国、英国等国家的感染率最高,病死率能达到50.00%[4]。所以合理科学地预防和积极的治疗对策,对于降低新生儿GBS感染具有十分重要的价值。基于此,该院择取2013年1月—2019年2月新生儿359例,进一步分析新生儿B族链球菌感染情况。现报道如下。
1 资料与方法
1.1 一般资料
选入2016年2月—2019年2月该院产科接收的B族链球菌感染孕妇,予以产时抗生素预防治疗后分娩的新生儿265例,将其设定为研究组。同时纳入2013年1月—2016年1月该院B族链球菌临床标本培养为阳性的新生儿94例,将其设定为对照组。265例产妇中,最大年龄值43岁,最小年龄21岁。该次研究征得伦理委员会批准,患者和家属签订同意书。两组基本数据等核算,组间差异无统计学意义(P>0.05)。具有可比性。
1.2 方法
研究组产妇在临产前或者胎膜破裂时均予以抗生素预防性救治,并根据《2010年美国GDC围产期GBS预防指南》[5],予以新生儿管理;对照组临产前或者胎膜破裂时不采用抗生素预防性救治。两组新生儿均予以血液和呼吸道标本的采集。
GBS细菌培养:应用消毒棉拭子放置阴道内1/3处,旋转1周,停留10~30 s后,取阴道或者在肛门括约肌上2~3 cm位置,旋转提取肛周分泌物质。送往实验室检查后,进行GBS测定,分泌物的标本接种在血琼脂平板培养基中,在35~37℃的环境下培养18~24 h后对菌落观察[6]。B溶血性疑似菌落予以纯培养后建立涂片,实施革兰染色检查。
药敏测定(K-B)法,选取疑似菌落配置菌溶液均予以涂抹血MH平板,同时加入进青霉素、氨苄西林、克林霉素等。
抗菌药物首选青霉素类,注射用青霉素剂型为2 g/支(国药准字H19993622)加入20 mL生理盐水静脉注射,在随后2 d内行1 g/6 h静脉注射,直到分娩,对青霉素过敏患者行克林霉素(国药准字H20020281)静脉注射,900 mg/8 h,直到分娩。
1.3 统计方法
采用SPSS 17.0统计学软件处理数据,计数资料以频数及百分比表示,组间差异比较以χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组基本情况对比
研究组平均胎龄(37.95±0.20)周,其中顺产71.32%(189/265)、剖宫产28.68%(76/265);对照组平均胎龄(37.90±0.77)周,其中顺产60例(63.83%)、剖宫产34例(36.17%)。两组平均胎龄值对比差异无统计学意义(t=0.973,P=0.331)。两组顺产率对比差异无统计学意义(χ2=1.832,P=0.175)。
2.2 两组B族链球菌感染发生情况对比
对照组新生儿肺炎、败血症和脑膜炎等发生率高于研究组,两组对比差异有统计学意义(P<0.05)。见表1。研究结果记录,49株新生儿血液或脑脊液分离的GBS菌株中,红霉素中介5株。四环素、克林霉素1株中介。全部菌株对内酰胺类药物中,包括青霉素、氨苄西林、头孢曲松、头孢克罗、头孢唑啉、头孢呋辛钠等全部敏感。
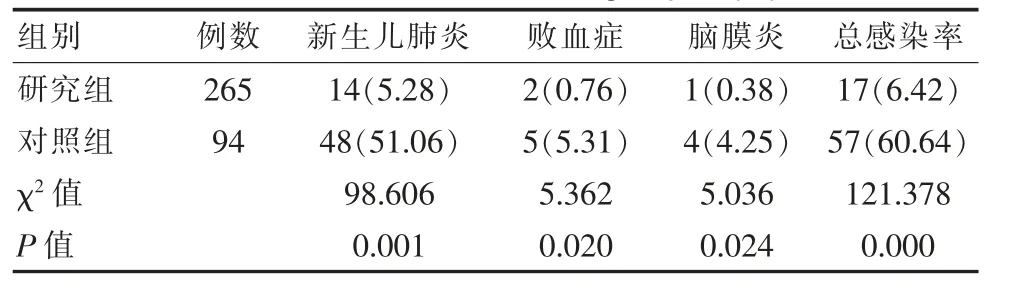
表1 两组B族链球菌感染发生情况对比[n(%)]Table 1 Comparison of the occurrence of group B streptococcal infections between the two groups[n(%)]
2.3 两组各位置B族链球菌阳性测定情况对比
两组呼吸道样本、血液样本阳性检出率对比,差异有统计学意义(P<0.05)。见表2。

表2 两组各位置B族链球菌阳性测定情况对比[n(%)]Table 2 Comparison of the positive determination of group B streptococci in each position of the two groups[n(%)]
2.4 B族链球菌感染患儿药敏分析
该次研究共进行49株GBS分离株药敏结果处理,其中体外药敏研究结果记录,49株新生儿血液或脑脊液分离的GBS菌株中,红霉素中介5株。四环素、克林霉素1株中介。全部菌株对内酰胺类药物中,包含青霉素、氨苄西林、头孢曲松、头孢克罗、头孢唑啉、头孢呋辛钠等全部敏感。
3 讨论
临床将BGS称之为无乳链球菌,属于革兰阳性球菌,大量寄居在生殖道和胃肠道,且带菌率会因种族、地域以及年龄存在差异[7]。BGS是导致欧美等国家新生儿败血症、化脓性脑膜炎发生的主要致病菌,发病凶险且病死率极高,更为严重的情况将引发神经系统后遗症。在我国新生儿BGS感染的发生率相对较小,但是就目前来看,发病率呈逐年上升趋势。所以对BGS感染的孕妇采取适当的措施,从而降低新生儿感染率对于我国公共医疗安全的保障以及新生儿生命安全提升十分关键。
新生儿GBS感染的主要表现[8]:依据发病时间分成早发型和晚发型。早发型感染多是出生后1周内引发的感染,一般在出生后的1 d或者3 d内,通过母婴垂直传播,病原菌多来自于母亲感染或者泌尿生殖系统定植,败血症和肺炎是最显著的临床反应,其次为脑膜炎[9]。晚发型感染主要是出生7~90 d,和产科引发的危险因素无关联,其病原菌多分布于母亲的生殖道中,并在其中定植,主要表现为细菌性脑膜炎[10]。该次研究的数据中,其中有4例属于早发型,均属于GBS败血症,有3例在出生后的1 d内发病,其中2例在出生后的60 min发病;另外晚发型均在出生后1周发病,均出现发热反应。
该文数据证实,对照组新生儿肺炎51.06%、败血症5.31%和脑膜炎4.25%发生率高于研究组5.28%、0.76%、0.38%(P<0.05)。吴静[11]专家的相关研究中,也进一步分析观察组肺炎11.11%、败血症0.00%、脑膜炎0.00%发病率低于对照组,和该文研究结果相符。
通过这一数据也进一步说明,GBS感染阳性孕妇可以在分娩时予以抗生素预防性治疗,对新生儿肺炎、败血症和脑膜炎的降低有所帮助。目前应用于临床中,预防新生儿GBS感染的对策主要包括:①孕妇分娩时应用抗生素,也就是IAP,预防对策应开始于分娩发动或者胎膜破裂时。②对新生儿予以预防性救治,确保药物在新生儿的体内杀菌,但是对分娩过程中出现的菌血症则失去了预防治疗价值。分娩过程中的新生儿菌血症多由宫内感染引发,宫内感染的发生是孕期阶段的危险要素。所以预防新生儿GBS-EOD[12]最关键的预防对策是对出现危险要素的孕妇予以筛查。
临床认为针对抗生素预防性治疗应用对象,提出两种筛选模式,分别为高危因素评定以及普通筛查模式。高危因素的评定方式是在分娩过程中孕妇出现的危险因素,作为主要判定依据,其中分娩过程中胎龄<37周;胎膜破裂≥18 h;产妇的体温≥38℃;第一胎存在GBS感染情况;孕期阶段存在GBS菌尿症。但是有数据分析认为有将近40.00%的GBS-EOD患儿以及产妇没有危险因素。在常规筛查方式中,采集妊娠35~37周孕妇的阴道或者直肠拭子予以评定,培养阳性或者存在下列任何一个情况实施抗生素救治:胎龄<37周进行分娩;孕产妇GBS菌尿症或者前一胎存在GBS感染情况;不具有上述情况但是未予以细菌培养。这两种方式在外国均有所采用,且应用率十分相似。
新生儿GBS感染的发生率和预后分析:根据外国的相关数据分析,90 d内活产婴儿的发病率将近0.050%左右,而病死率将近高达10.00%,早发型发病率在0.040%左右,高于晚发型患儿。且在存活的婴儿中,有将近30.00%会出现后遗症。在将近20年的时间中,外国新生儿GBS感染率逐年提升,甚至占围生期细菌感染的60.00%以上,病死率也将近占到50.00%。但是我国目前来看依然缺少大数据的临床分析。
新生儿GBS感染中,重症肺炎的病死率占比在50.00%,研究人员认为因GBS感染引发的新生儿肺炎,比率高达26.00%,所以强化对孕妇的孕中、晚期GBS筛查十分关键,强化对高危产妇的检测和预防,分娩过程中预防性采用抗生素治疗是新生儿GBS预防性对策。通过该文分析,研究组与对照组呼吸道样本(0.38% vs 96.81%)、血液样本阳性检出率(0.76 vs 5.32%)对比差异有统计学意义(χ2=338.535、5.362,P=0.001、0.020)。在美国疾病预防控制中心(疾控中心)CDC(P):Centers for Disease Control)研究中,对妊娠35~37周的孕产妇予以阴道以及直肠GBS测定,对于阳性患者采用预防性治疗,能降低新生儿早发GBS感染率。
对于感染的患儿临床可应用大剂量青霉素联合三代头孢(头孢曲松或头孢他啶)抗感染,对于行大剂量青霉素联合美洛培南治疗患儿,如果出现体温持续不稳定以及出现发热的反应,则可以实施万古霉素联合美培洛南治疗,对于体温稳定的患儿口服利奈唑胺。
综上所述,随着物质生活水平不断提升,人们的健康需求也更高,对医疗服务的要求也随之提升,医疗纠纷也逐年增多。作为纠纷发生的重点科室,产科和儿科承担着重大责任和使命。为了进一步降低医疗纠纷发生率,同时降低新生儿GBS感染率,产前科学筛查不容忽视。

