对比原发性肺腺样囊性癌与黏液表皮样癌CT表现
邓靓娜,张国晋,刘显旺,张 斌,景梦园,林晓强,韩 涛,周俊林*
(1.兰州大学第二医院放射科,甘肃 兰州 730030;2.兰州大学第二临床医学院,甘肃 兰州 730030;3.甘肃省医学影像重点实验室,甘肃 兰州 730030;4.四川省人民医院放射科,四川 成都 610072)
原发性肺涎腺肿瘤起源于气管-支气管树黏膜下腺体导管上皮,在肺原发恶性肿瘤中占比不足1%[1-3]。原发性肺涎腺肿瘤包括腺样囊性癌(adenoid cystic carcinoma,ACC)、黏液表皮样癌(mucoepidermoid carcinoma,MEC)、上皮肌上皮癌和多形性腺瘤[4]。ACC和MEC是原发性肺涎腺肿瘤最常见的组织学类型[3]。研究[5]表明,ACC与MEC的生物学行为不同,ACC侵袭性较强,且确诊时多已处于中晚期而错失最佳治疗时期,预后差。CT是评估气道病变的非侵入性检查手段。本研究回顾性分析ACC和MEC的CT表现。
1 资料与方法
1.1 一般资料 回顾性分析2016年12月—2020年10月于兰州大学第二医院经手术病理证实的22例ACC(ACC组)和18例MEC(MEC组)。ACC组男12例,女10例,年龄34~67岁,平均(51.5±6.7)岁;MEC组男12例,女6例,年龄13~66岁,平均(36.8±16.8)岁。纳入标准:①病理组织学类型为ACC或MEC;②接受胸部CT检查,且检查前未接受任何抗肿瘤治疗;③纵隔窗CT图像显示肿瘤良好;④CT检查与手术间隔时间<2周。排除标准:①临床及影像学资料不全;②碘对比剂过敏史及禁忌证;③图像质量欠佳。
1.2 仪器与方法 采用Philips Brilliance 256层iCT机行胸部扫描,扫描范围自胸廓入口至肋膈角水平,管电压120 kV,管电流150 mA,螺距1.5,转速0.5 s/r,准直器宽度128×0.625 mm,层厚5 mm。平扫后经肘正中静脉以流率3.5 ml/s注射对比剂碘海醇(300 mgI/mL)1.3~1.5 ml/kg体质量,于注射后30 s及60 s采集动脉期及静脉期增强图像,并进行图像重建,重建层厚和层间距均为1.25 mm。
由具有5年及10年胸部影像学诊断经验的2名主治医生采用双盲法阅片,意见不一致时经讨论达成共识。观察肿瘤CT表现,包括:①位置,分为中央型或周围型;②病灶类型[6-7],分为腔内肿块型、腔内外肿块型、管壁浸润型及周围结节型;③肿瘤均质性,有无囊变、坏死及钙化;④淋巴结肿大,指肺门或纵隔淋巴结短轴直径>1 cm;⑤气道阻塞征象,指阻塞性肺炎、肺不张或支气管扩张;⑥增强扫描动、静脉期CT值;⑦强化程度,强化幅度(增强扫描CT峰值-平扫CT值)<20 HU为轻度强化,20~40 HU为中度强化,>40 HU为明显强化;⑧有无胸腔积液;⑨邻近组织是否受侵;⑩有无远处转移;中央型病灶纵向浸润范围,以冠状位或矢状位CT图像中肿块沿气管壁纵行延伸范围>3 cm为阳性;中央型病变环周范围,以轴位CT图像中肿瘤浸润范围>气管壁周长1/2为阳性。记录临床症状、有无吸烟史及肿瘤标志物检测等临床资料。
1.3 统计学分析 采用SPSS 26.0统计分析软件。以±s表示计量资料,行独立样本t检验。采用χ2检验或Fisher确切概率法比较计数资料。绘制增强扫描动脉期及静脉期肿瘤CT值鉴别MEC与ACC的受试者工作特征(receiver operating characteristic,ROC)曲线,评估其诊断效能,计算曲线下面积(area under the curve,AUC),并以DeLong检验分析AUC差异。P<0.05为差异有统计学意义。
2 结果
MEC组与ACC组患者年龄、神经元特异性烯醇化酶及癌胚抗原差异均有统计学意义(P均<0.05),其余临床资料差异均无统计学意义(P均>0.05),见表1。
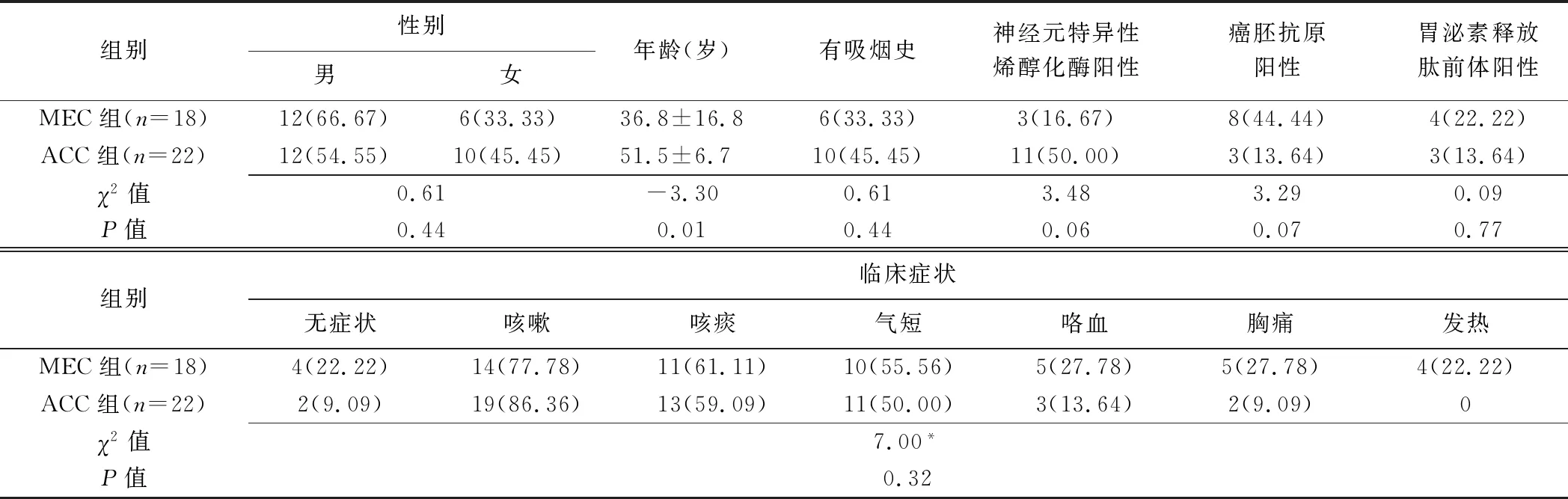
表1 MEC组与ACC组临床资料比较[例(%)]
ACC组与MEC组病灶类型(病灶均单发)、增强扫描动脉期及静脉期CT值和病灶强化程度差异均有统计学意义(P均<0.05),其余征象差异均无统计学意义(P均>0.05)。ACC组与MEC组间中央型病变发生部位、纵向浸润范围及病变环周范围差异均有统计学意义(P均<0.05),见图1、2及表2、3。
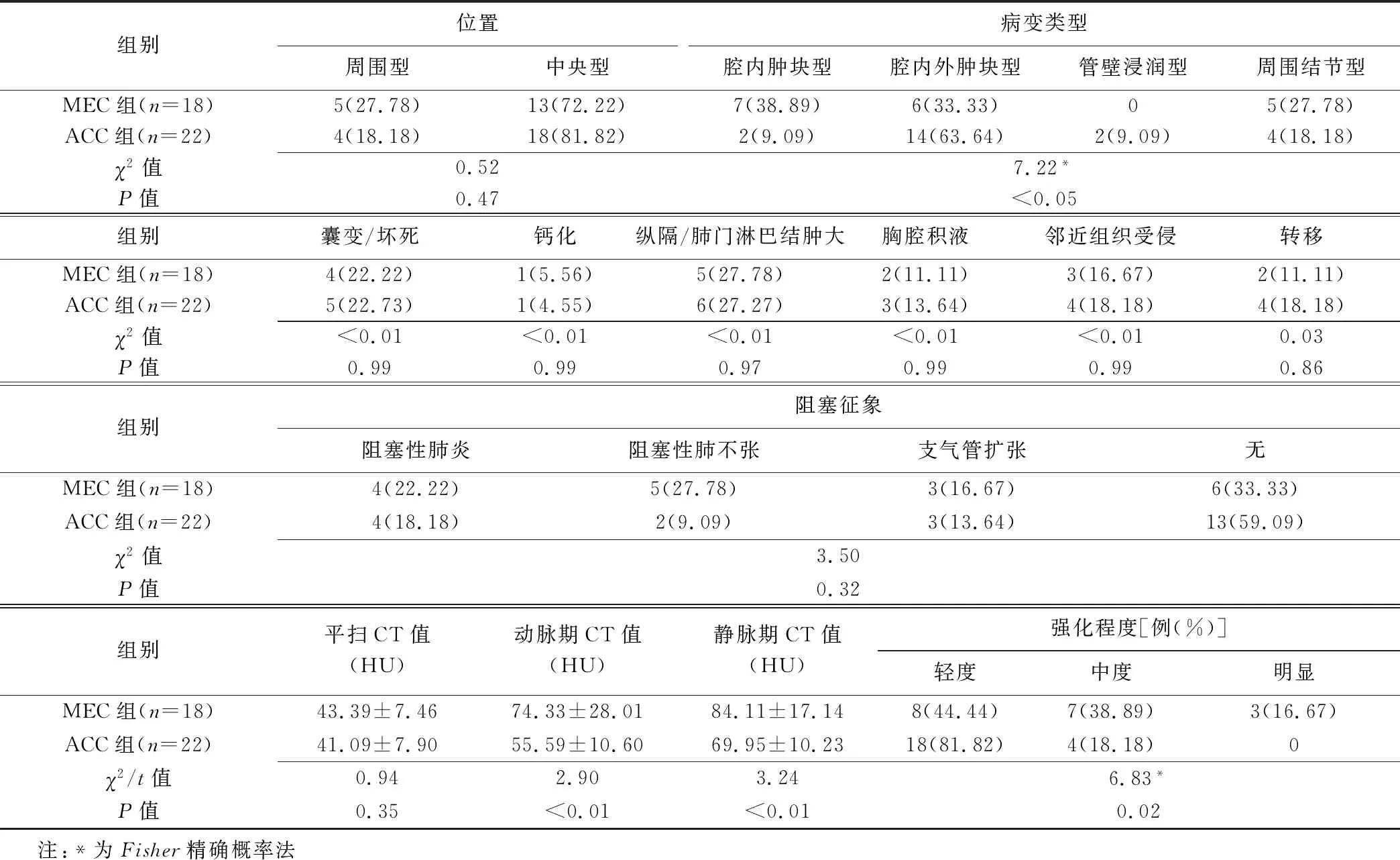
表2 MEC组与ACC组间CT征象比较[个(%)]
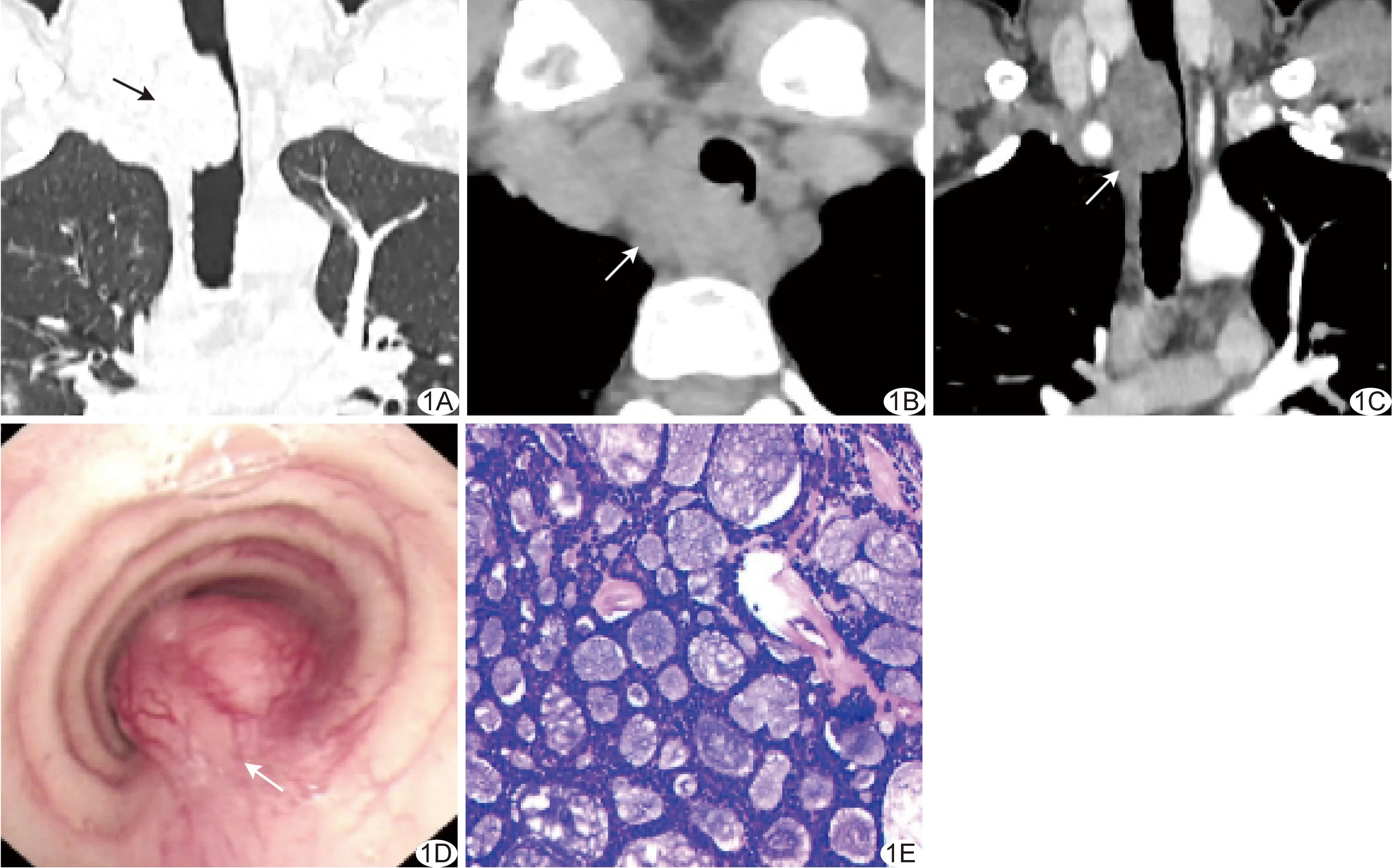
图1 患者女,42岁,气管上段ACC A.冠状位CT平扫肺窗图像示气管上段不规则肿块凸向气管腔内;B.轴位CT平扫纵隔窗图像示肿瘤呈腔内外肿块型,气管壁不规则环形增厚,管腔狭窄,环周浸润范围>管腔周长1/2,局部食管受侵;C.冠状位增强CT动脉期纵隔窗图像示肿瘤纵向浸润范围>3 cm,呈轻度强化;D.电子支气管镜图示气管上段菜花样新生物,阻塞气管腔,表面光滑,血供丰富;E.病理图(HE,×200) (箭示病灶)
ROC曲线显示,动脉期和静脉期CT值鉴别ACC与MEC的AUC分别为0.78及0.75;以66.50 HU为动脉期CT值的阈值,其诊断敏感度和特异度分别为66.67%和81.82%;以81.50 HU为静脉期CT值阈值,其诊断敏感度和特异度分别为61.11%和90.91%,见图3。DeLong检验结果显示,动脉期与静脉期CT值的AUC差异无统计学意义(Z=0.80,P=0.42)。
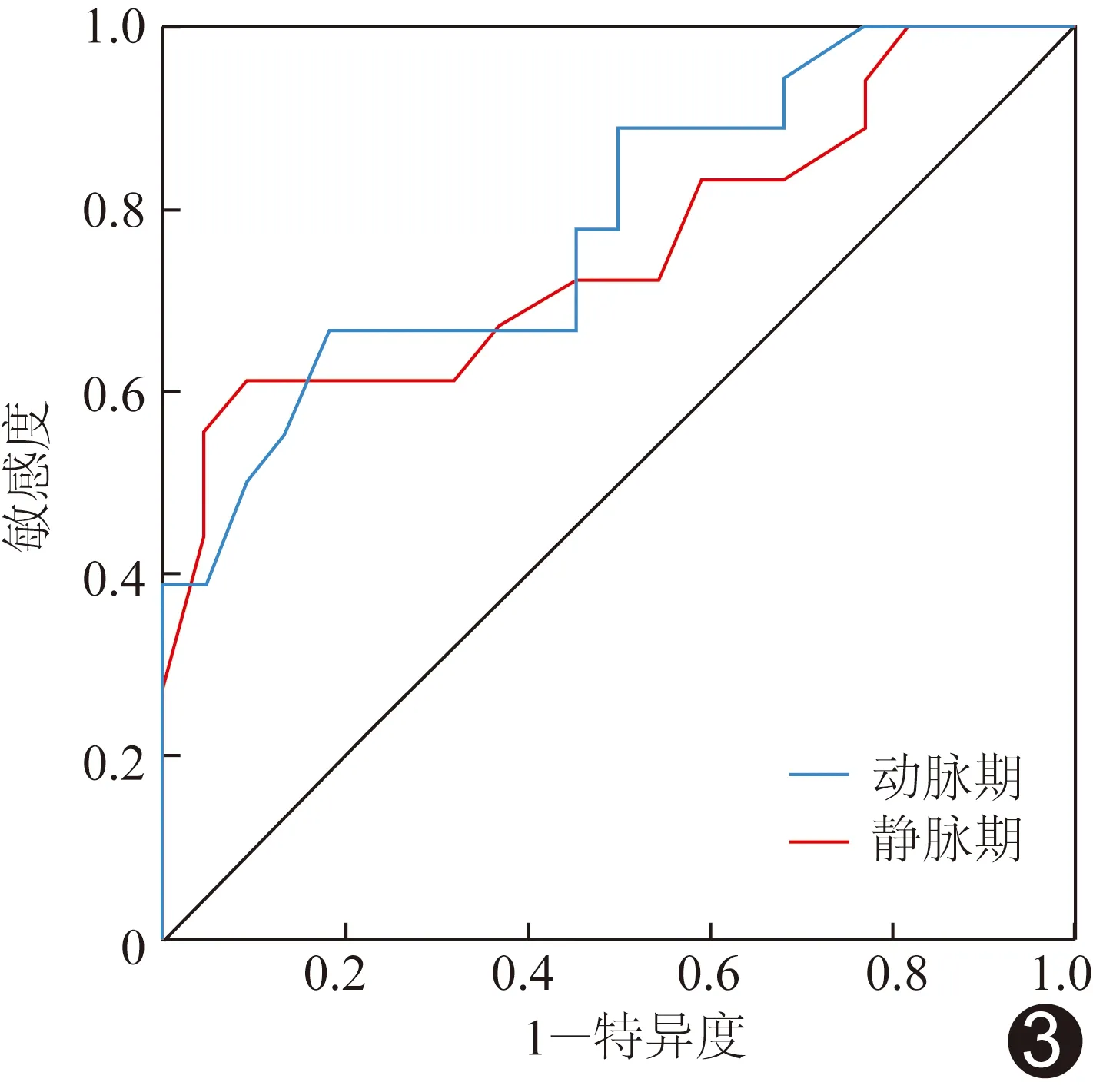
图3 增强CT动脉期及静脉期CT值鉴别MEC与ACC的ROC曲线
3 讨论
ACC是发病率仅次于鳞状细胞癌的气管源性恶性肿瘤,但其发病年龄偏低,为40~50岁[8]。MEC仅占所有胸部恶性肿瘤的0.1%~0.2%[9],发病年龄多在30岁以下[10]。本研究MEC组患者年龄低于ACC组,与文献[8-10]报道相符。ACC和MEC临床症状与肿瘤位置和气道阻塞情况相关,周围型肿瘤常无明显症状,而中央型主要以咳嗽、咳痰和气促为主。原发性肺涎腺肿瘤起源于气管及支气管的黏膜下腺,ACC好发于气管和主支气管[11],而MEC好发于叶支气管和段支气管[12-13]。本研究中ACC和MEC均以中央型为主,与文献[9]报道一致。ACC及MEC的好发部位和生长方式有所不同,既往研究[14]认为MEC更易引起阻塞性病变;但本研究阻塞性病变组间差异无统计学意义,可能与样本量小有关。
ACC多有沿黏膜下延伸及气管外侵犯趋势,而MEC常局限于支气管腔内生长[11]。ACC主要CT表现为管壁结节状或均匀增厚,软组织肿块凸向气管腔内或包绕气管,纵向浸润范围>3 cm,环周浸润范围>管腔周长1/2[15];MEC多表现为结节状软组织肿块向腔内隆起,纵向浸润范围<3 cm,环周浸润范围<管腔周长1/2[16]。周围型ACC及MEC常表现为孤立性肺结节或肿块[5]。本研究所见与ZHU等[2]基本一致。
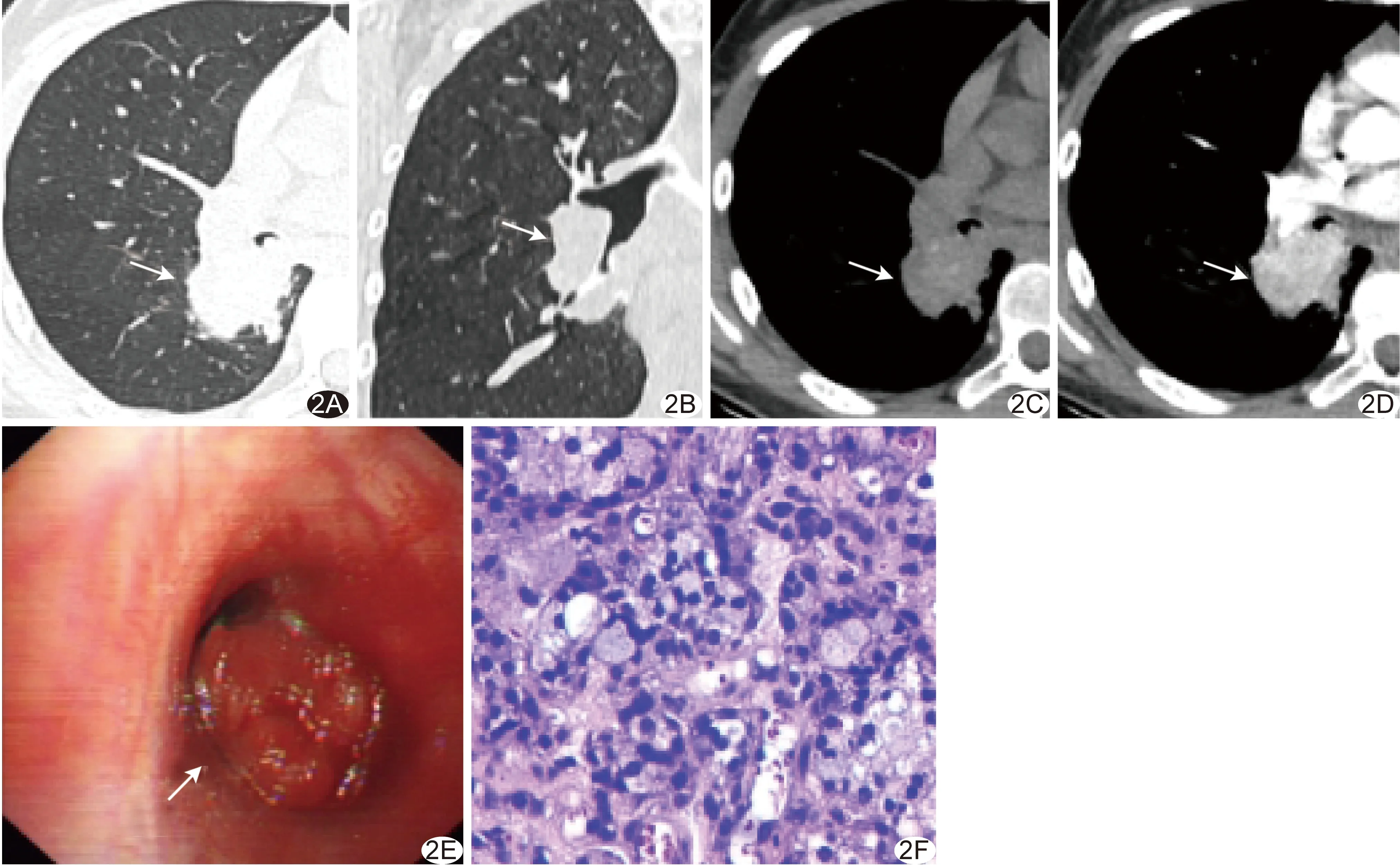
图2 患者女,42岁,右肺中间段支气管MEC A、B.平扫CT轴位肺窗(A)及冠状位肺窗(B)图像示右肺中间段支气管不规则肿块,向腔内外生长,致管腔狭窄;C.平扫CT轴位纵隔窗图像示肿瘤呈腔内外肿块型,环周浸润范围>管腔周长1/2,密度不均,内见点状钙化;D.增强CT轴位动脉期纵隔窗图像示肿瘤明显强化;E.电子支气管镜图示右肺中间段支气管开口处菜花样新生物阻塞管腔,表面凹凸不平,血供丰富;F.病理图(HE,×400) (箭示病灶)
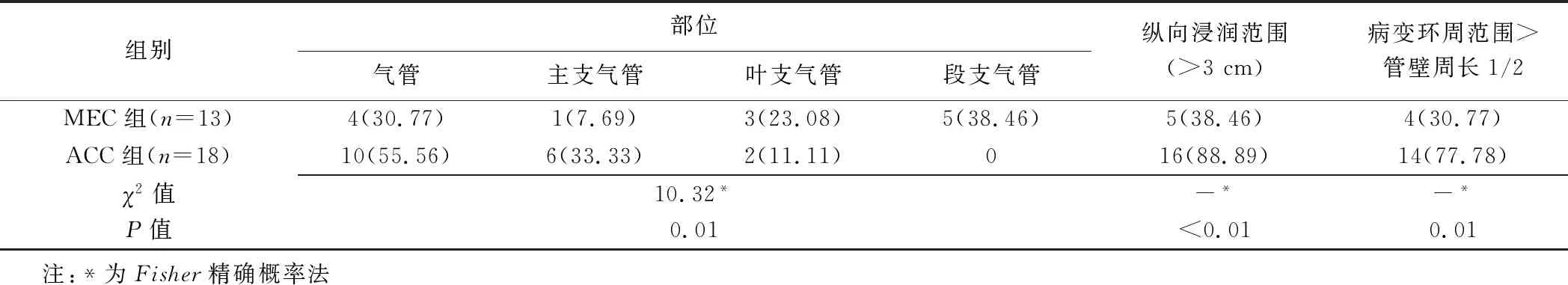
表3 组间中央型病变CT表现比较[个(%)]
CT平扫中,ACC及MEC密度均接近或低于肌肉。相比ACC,MEC更易发生坏死、囊变,随病情发展可形成空洞[17],病灶内钙化发生率较高,可能为黏液吸收不足所致[16]。本研究ACC组和MEC组均仅1例发生钙化,囊变/坏死发生率分别为22.73%和22.22%;增强扫描后ACC多呈轻度强化,而MEC表现为不同程度强化,且ACC组增强动脉期和静脉期CT值均低于MEC组;可能原因在于ACC是由导管上皮及肌上皮细胞构成的腺体,呈小管状或筛状结构,间质内血管成分较少[18],而MEC肿瘤内部黏液分泌区与非黏液分泌区血管成分比例不同、分布不均,故其强化方式多样[19]。本研究中ACC与MEC增强CT动、静脉期CT值鉴别诊断的AUC差异无统计学意义,提示二者诊断效能相当。
综上所述,ACC与MEC的CT征象存在一定差异,结合临床有助于鉴别诊断。但本研究为回顾性分析,且样本量少,所获结果有待进一步验证。

