儿童房间隔缺损介入封堵术后早期高度房室传导阻滞处理策略
纪志娴, 泮思林, 罗 刚, 杜占慧
经导管介入封堵术已成为近年治疗儿童房间隔缺损(atrial septal defect,ASD)首选方式[1]。 术后早期新发心律失常, 尤其是高度房室传导阻滞(advanced atrioventrieular block,AAVB) 虽然少见,但一直是临床关注的重点。 术后早期AAVB 可引起患儿循环状态不稳定,甚至Adams-Stokes 综合征发作,危及生命。 AAVB 发生机制和相应处理策略,尤其是手术取出封堵器时机,仍困惑着儿科心脏介入医师。 本研究回顾性分析单中心采用介入封堵术治疗的ASD 患儿临床资料, 探讨AAVB 发生的可能机制和处理策略。
1 材料与方法
1.1 一般资料
收集2010 年1 月至2019 年12 月青岛大学附属妇女儿童医院采用经导管介入封堵术治疗的312例ASD 患儿临床资料。其中男113 例,女199 例,年龄7 个月~17 岁,体质量6.5~66.0 kg。患儿入组标准均符合2011 年《常见先天性心脏病介入治疗中国专家共识》[1]。术前排除患儿伴有瓣膜疾病、感染性心内膜炎、心肌炎、遗传综合征等基础疾病。 AAVB 指房室传导比例≥2∶1 的Ⅱ度房室传导阻滞[2]。本研究已获医院伦理委员会批准。
1.2 经导管介入封堵术
术前所有患儿常规禁食、 禁饮水并适当补液。全身麻醉下穿刺右股静脉, 常规静脉推注肝素(50~100 U/kg), 维持目标活化凝血时间(activated clotting time,ACT)为220~300 s;根据术前经胸超声心动图评估ASD 位置、 大小及残端边缘情况,选择合适型号封堵器,多切面评估封堵器位置,确认封堵器腰部牢固骑跨在缺损边缘, 无残余分流,未影响周围组织(腔静脉、房室瓣)功能后释放封堵器,推拉试验确认封堵器位置固定良好。 术后常规口服阿司匹林(3~5 mg·kg-1·d-1)预防血栓,当天持续心电监护,此后每日行心电图检查直至出院。
1.3 AAVB 处理措施
一旦出现AAVB 则持续心电监护, 同时静脉滴注甲泼尼龙(2~4 mg/kg)以减轻心肌水肿,持续泵 入异 丙肾 上腺 素(0.02~0.1 μg·kg-1·min-1)以维持生理心室率,间断利尿以减轻心脏负荷,并予营养心肌药物支持治疗。 观察患儿一般状况:精神、饮食、呼吸和循环状态,重点是每日评估患儿心律对药物治疗的反应, 分析AAVB 可能的发生机制。
2 结果
ASD 介入封堵术后312 例患儿中2 例早期发生AAVB, 发生率为0.6%。 2 例患儿术前心电图均提示窦性心律伴不完全性右束支传导阻滞,见表1;手术过程顺利,术后超声心动图显示左心室射血分数正常,封堵器位置固定,心房水平未见残余分流。

表1 2 例ASD 介入封堵术后AAVB 患儿基本临床资料
患儿1:ASD 封堵器释放后即刻发生Ⅱ度Ⅱ型房室传导阻滞,立即给予静脉滴注甲泼尼龙和持续泵入异丙肾上腺素(0.03 μg·kg-1·min-1),心室率升至130 次/min,窦性心律和节性心律交替出现。 返回病房后患儿自主心率逐渐减慢(60~70 次/min),上调异丙肾上腺素剂量至0.06 μg·kg-1·min-1,药物反应性欠佳,密切观察24 h,床旁心电图提示Ⅱ度房室传导阻滞进展(3∶1 传导)。 略有烦躁和呼吸急促,四肢末梢偏凉,征求患儿家属同意后,于术后1 d 全身麻醉低温体外循环下行封堵器取出和ASD 修补术,术中见封堵器下缘紧靠Koch 三角顶点,取出封堵器术后即刻患儿恢复窦性心律。 随访至今已6 年余,末次随访心电图示窦性心律。
患儿2: 术中心电监护未发现心律失常, 术后2 h心电监护提示心率慢,床旁心电图提示心率58 次/min,Ⅱ度Ⅱ型房室传导阻滞(2∶1 传导), 给予甲泼尼龙、异丙肾上腺(0.03~0.06 μg·kg-1·min-1)、利尿剂和营养心肌药物等综合治疗, 药物反应性良好,心率可维持90 次/min 以上;无临床症状,经与患儿家属沟通,继续保守治疗,逐渐转变为Ⅰ度房室传导阻滞,术后5 d 恢复窦性心律,出院前24 h动态心电图提示窦性心律,平均心率为105 次/min,不完全性右束支传导阻滞、 Ⅰ度房室传导阻滞; 至今随访1 年, 复查动态心电图示窦性心律、 不完全右束支传导阻滞, 未见房室传导阻滞,见图1 。
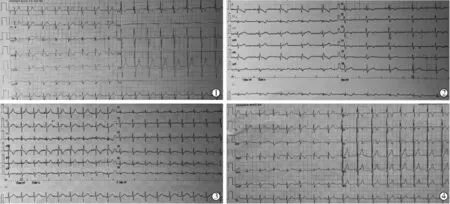
图1 患儿2 经导管介入封堵术前后心电图
3 讨论
国内研究报道ASD 介入封堵术后心律失常发生率和严重程度低于室间隔缺损,高于动脉导管未闭,提示心脏畸形与房室结和传导束毗邻关系是术后心律失常发生的解剖基础[3]。 Sato 等[4]研究发现封堵器对ASD 旁房室结刺激和挤压可造成AAVB,封堵器相关机械性磨损和持续炎性反应是导致ASD 介入术后AAVB 的重要发病机制,大尺寸ASD封堵器(≥18 mm)增加术后AAVB 发生概率[5-6]。 本组患儿1 为筛孔样缺损,正如术中所见封堵器下缘贴靠Koch 三角,取出封堵器后恢复窦性心律,因此建议对术中可能置入≥18 mm 封堵器患儿,应充分利用超声心动图多方位、多切面评估ASD,封堵器伞盘打开后需反复观察封堵器塑形状态及下缘与下腔静脉、冠状静脉窦关系[7],密切观察心律变化;对于术前伴有房室传导功能异常患儿,术后更应长期严格随访心电图[8]。
介入封堵术后封堵器对传导束、房室结摩擦所致局部水肿、炎性反应,在低龄且ASD 较大患儿中尤为明显[5,9]。 该摩擦刺激改变多为可逆性,因此应对ASD 介入术后早期AAVB 及早予激素治疗[5,10]。本组患儿2 术后复查超声心动图提示封堵器下缘与下腔静脉距离较远,AAVB 发生机制考虑由封堵器释放时牵拉房间隔力学改变所致,首选药物保守治疗。 本研究认为在激素治疗基础上,再给予小剂量异丙肾上腺素泵入,既可维持心室率以保证循环灌注需要、预防Adams- Stokes 综合征,又利于观察传导系统对药物治疗的反应性,作为是否手术取出封堵器的判断指标之一。 患儿2 对药物治疗反应良好,最终恢复窦性心律,避免了再次手术对患儿创伤,但患儿1 对药物治疗无反应, 术后24 h 及时取出封堵器恢复窦性心律,避免了永久起搏器植入。
ASD 介入封堵术后AAVB 少见, 发生率约为1%[10]。 目前关于ASD 封堵器取出指征和外科开胸术时机尚未一致[4,11]。 本研究、Sato 等[4]报道在ASD封堵术后1 d 取出ASD 封堵器,患儿心律恢复窦性心律。 Amoozgar 等[9]报道ASD 封堵术后17 d 取出封堵器, 患儿未恢复窦性心律, 植入永久起搏器。Dittrich 等[12]、Nehgme 等[13]分别 报道1 例患儿ASD封堵术后早期出现AAVB, 经药物治疗后恢复窦性心律,随访中再次出现AAVB,分别于术后11 个月、4 年余取出封堵器,遗憾的是均需植入永久起搏器。本研究建议对术后早期发生AAVB 患儿,应综合评估传导阻滞出现时间、药物治疗反应及病情进展程度, 若术中即刻出现AAVB、 对激素等治疗反应性差、房室传导阻滞进行性加重或发生Adams- Stokes综合征, 宜尽早取出封堵器(控制在术后1 周左右);鉴于患儿即使取出封堵器,心律失常转复窦性心律时间也长短不一,建议常规置入心外膜临时起搏器保驾; 对于出现过AAVB 的ASD 介入术后患者,无论是内科保守治疗还是经取出封堵器,均需终生随访。
综上所述,ASD 介入封堵术后早期AAVB 少见,超声心动图充分评估、选择合适封堵器是预防其发生的重要保证。AAVB 发生机制不同,治疗措施也不同,部分患儿经药物治疗效果理想,部分患儿需要取出封堵器,若考虑AAVB 由封堵器机械性损伤引起,建议尽早取出封堵器。 建议对所有患儿终生随访。 本研究局限性在于病例数过少,今后将开展多中心联合研究进一步观察ASD 介入封堵术后早期AAVB 转归,为优化临床治疗策略提供指导。

