急性或长期运动对运动员免疫功能影响的Meta分析
郭静霞 陈 亮
(福建师范大学 运动与健康福建省高校重点实验室,福建 福州 350007)
人体在大负荷运动后的免疫功能下降已得到共识,其机制可以基本归纳为运动后的“Open Window(开窗效应)”、运动强度与急性上呼吸道感染的“J”形关系等多方面,并且这一现象及其成因对于长期从事竞技运动的运动员而言同样适用。当前,对于诸多项目运动员的实验研究显示,一次大负荷运动后或连续进行的训练安排均会导致外周血免疫细胞功能应答、黏膜免疫功能等领域显著性降低[1-2]。对此,国内、外学者[2-6]曾对运动后恢复期免疫功能的调节做过系统性评述,但由于缺乏对专项、运动形式、运动负荷等的分类讨论,难以了解不同项目运动员在训练中免疫功能的应答及恢复规律。因此,本文采用Meta分析,通过对选取运动员进行急性或长期运动干预实验,结合不同研究设计、运动项目、人群特点等,尽可能避免由运动性疲劳或不当防御措施引起机体免疫功能降低,为合理安排训练与比赛、保证运动员的身体健康提供循证医学证据。
1 研究方法
1.1 文献检索
从中国知网、Web of Science、Pub Med、Cochrane library、Elsevier等数据库进行文献检索,检索时间为1950年——2020年3月30日。中文检索词以运动员、免疫、免疫功能、炎症因子、淋巴细胞、免疫球蛋白、急性运动进行混合式检索;英文检索词以“elite athlete(or competitive athlete or trained athlete or college student athlete)and immune* (or leukocyte*)and exercise*”为英文检索策略。此外,追溯纳入研究的参考文献,以补充获取相关文献,未检索未发表的文献。
1.2 文献纳入和排除标准
纳入文献:1)文献类型均为随机对照实验(RCT)或自身对照实验,无论是否盲法或实行分配隐藏;2)实验对象均为经验丰富的运动员;3)实验干预均为单次急性或长期大强度运动干预。
结局指标。1)炎症因子:C-反应蛋白(C-reactive protein,CRP);白介素-6(interleukin-6,IL-6);肿瘤坏死因子(tumor necrosis factor-α,TNF-α);2)白细胞亚型:淋巴细胞(lymphocyte)、中性粒细胞(neutrophils)、单核细胞(monocytes);3)唾液免疫球蛋白A(SIgA,salivary immunoglobulin A)。
排除标准为:1)结局指标不符合要求,包括动物实验;2)运动干预负荷较小;3)综述类文章;4)重复发表的文献。
1.3 数据提取
两名检索人员在检索过程中采用独立双盲的方式对纳入文献进行相关指标的提取,内容包括:第一作者、发表年份、运动项目、受试者性别、年龄、运动经历、练习方式、运动时间、结局指标。由2名有经验的评价员根据文献纳入与排除标准,独立完成文献的初筛和全文筛选。通过各个数据库检索,获得文献3071篇,导入文献管理软件EndNote X9去除重复文献后,共收录2051篇文献,通过阅读题目和摘要初筛后,排除不相关文献1673篇,剩余378篇文献,进一步阅读全文后,排除340文献,可能合格文献70篇,最终纳入Meta分析的共有37篇文献。
1.4 纳入研究质量评价
使用Cochrance风险评估工具对纳入的文献进行方法学质量评价,主要从随机分组、分配隐藏、双盲试验、效应指标盲检、检验数据完整性、试验结果选择性报告、其他偏移7个方面进行。并根据3个等级(低风险、高风险和不清楚)进行质量评价,将纳入文献质量从高到低分3个等级:高质量(5分及以上)、中等质量(3~4分)、低质量(2分及以下)。
1.5 统计学分析
采用Stata15.1软件对所得数据进行统计学处理,对纳入文献的各项结局指标进行Meta分析,由于纳入文献的结局指标属于连续型变量,测量方法和单位存在差异,效应尺度选择标准化均数差(SMD)和(95%Cl)为效应尺度合并效应量。
异质性检验采用Homogeneity test(Q检验,检验水准为a=0.1),若P
2 Meta分析结果
2.1 炎症因子
2.1.1 C-反应蛋白
共14篇文献纳入分析,纳入样本量为433人,部分文献对运动中、运动后不同时间、不同性别等进行分析,因此共产生34组数据。Meta分析结果显示,研究间存在高度异质性(I2=90.4%,P<0.1,图1),采用随机效应模型得到合并研究的总效应量及95%Cl为1.34(0.93,1.75),达到非常显著性水平(P<0.01)。
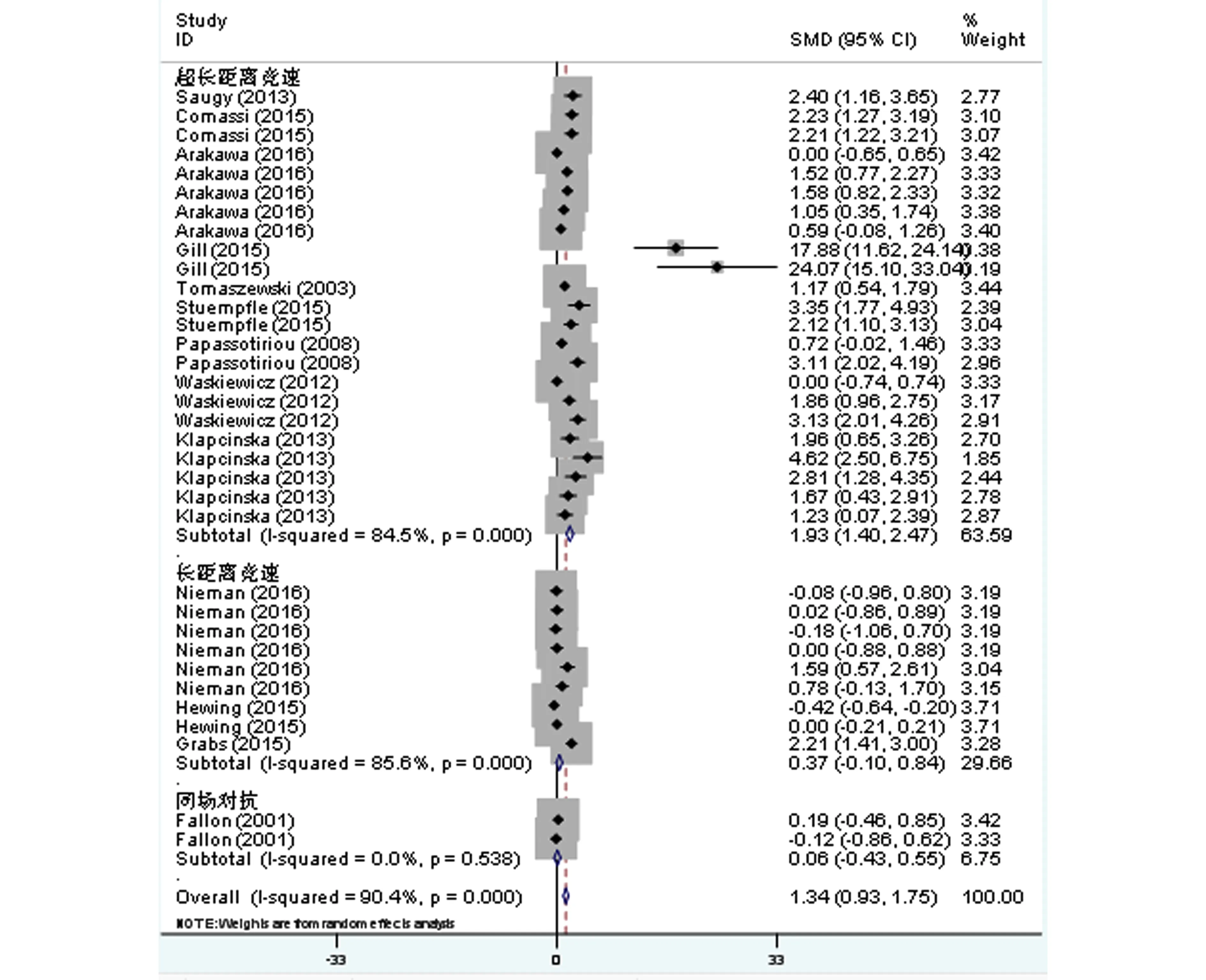
图1 不同运动项目CRP效应量Meta分析森林图
对可能引起CRP异质性高的因素进行亚组分析发现(表1),超长距离竞速性项目存在高度异质性,具有非常显著的统计学意义(I2>70%,P<0.01);长距离竞速和同场对抗性项目均不具有统计学意义(P>0.05)。对检测时间进行亚组后发现,比赛后即刻、24小时后检测均存在高度异质性,具有非常显著的统计学意义(I2>70%,P<0.01),赛后24h以内检测不具有显著的统计学意义(P<0.05)。所有水平运动员均存在高度异质性,具有显著的统计学意义(I2>70%,P<0.05)。

表1 可能异质性来源的亚组分析一览表
超长距离竞速和长距离竞速类项目异质性较高,因此进行亚组分析讨论其异质性来源。由表2可知,对于超长距离竞速类项目,所有检测时间、运动水平均具有非常显著的统计学差异(P<0.01)。长距离竞速类项目所有检测时间、运动水平均未发现显著性意义(P>0.05)。

表2 不同运动项目CRP的亚组分析
2.1.2 白介素-6
共15篇文献纳入分析,纳入样本量为286人,共产生46组数据,Meta分析结果显示,研究间总体存在高度异质性(I2=93.2%,P<0.1,图2)。采用随机效应模型得到合并研究的总效应量及95%Cl为2.02(1.49,2.55),达到非常显著性水平(P<0.01)。
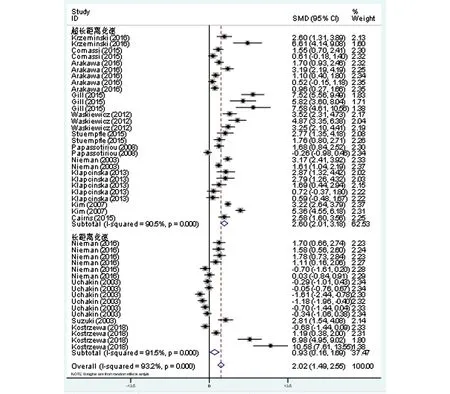
图2 不同运动项目IL-6效应量Meta分析森林图
对可能引起IL-6水平差异的原因进行亚组分析发现(表3),所有运动项目和运动水平均存在高度异质性,且具有显著的统计学意义(I2>70%,P<0.05)。即刻和赛后24h内检测均具有非常显著的统计学意义(P<0.01),24h后检测未发现显著性差异(P>0.05)。

表3 可能异质性来源的亚组分析一览表
对超长距离竞速和长距离竞速类项目进行亚组分析(表4),对于超长距离竞速类项目而言,所有检测时间和非高水平运动员均具有非常显著的统计学意义(P>0.01),高水平运动员IL-6水平没有显著性差异。长距离竞速项目,IL-6水平在24h前检测均显著升高(P<0.05),24小时后显著降低(P<0.05);高水平运动员IL-6水平均显著升高(P<0.01),非水平运动员未发现显著性差异(P>0.05)。

表4 不同健康状态人群IL-6的亚组分析
2.1.3 肿瘤坏死因子
共9篇文献纳入分析,纳入样本量为179人,共产生27组数据,Meta分析结果显示,研究间总体存在高度异质性(I2=85.0%,P<0.1,图3)。采用随机效应模型得到合并研究的总效应量及95%Cl为0.44(0.08,0.81),达到显著性水平(P<0.05)。

图3 不同运动项目TNF-α效应量Meta分析森林图
对可能引起TNF-α异质性的来源,进行亚组分析发现(表5),超长距离竞速项目存在高度异质性,具有非常显著的统计学意义(I2>70%,P<0.01),长距离竞速类项目未发现显著统计学意义(I2>70%,P>0.05)。运动后即刻检测具有显著的统计学意义(P<0.05),其他时间均未发现显著性意义(P>0.05)。高水平运动员运动后TNF-α水平显著升高(P<0.05),非水平运动员未发现显著性差异(P>0.05)。

表5 可能异质性来源的亚组分析一览表
对运动项目进行亚组分析(表6),对于超长距离竞速类项目而言,即刻检测时运动员的TNF-α水平显著升高(P<0.01),赛后检测未发现显著性意义(P>0.05);高水平运动员TNF-α水平没有显著性差异(P>0.05),中等水平运动员显著升高(P<0.01)。对于长距离竞速类项目而言,赛后24h内检测均未显著升高,24h后检测显著降低(P<0.01);高水平运动员的TNF-α水平显著升高(P<0.05),非水平运动员TNF-α水平显著降低(P<0.05)。

表6 不同运动项目TNF-α的亚组分析
2.2 白细胞亚型
2.2.1 淋巴细胞
共18篇文献纳入分析,纳入样本量为251人,共产生51组数据,Meta分析结果显示,研究间总体存在高度异质性(I2=82.7%,P<0.1,图4)。采用随机效应模型得到合并研究的总效应量及95%Cl为-0.24(-0.55,0.06),未达到显著性水平(P<0.05)。

图4 不同检测时间淋巴细胞效应量Meta分析森林图
对可能导致淋巴细胞异质性较大的原因,进行亚组分析发现(表7),所有运动项目、运动水平均未发现显著性意义(P>0.05)。赛后3h内检测淋巴细胞显著降低(P<0.01),其他时间未发现显著性意义。因此检测时间差异是淋巴细胞异质性的来源之一。

表7 可能异质性来源的亚组分析一览表
2.2.2 中性粒细胞
共15篇文献纳入分析,纳入样本量为258人,共产生39组数据,Meta分析结果显示,研究间总体存在高度异质性(I2=92.3%,P<0.1,图5)。采用随机效应模型得到合并研究的总效应量及95%Cl为2.59(1.94,3.42),达到非常显著性水平(P<0.01)。

图5 不同检测时间中性粒细胞效应量Meta分析森林图
对可能导致中性粒细胞异质性较大的原因,进行亚组分析发现(表8),所有运动项目、运动水平中性粒细胞水平均显著升高(P>0.05)。即刻和赛后3h内检测中性粒细胞水平显著提高,3h后检测未发现显著性意义。
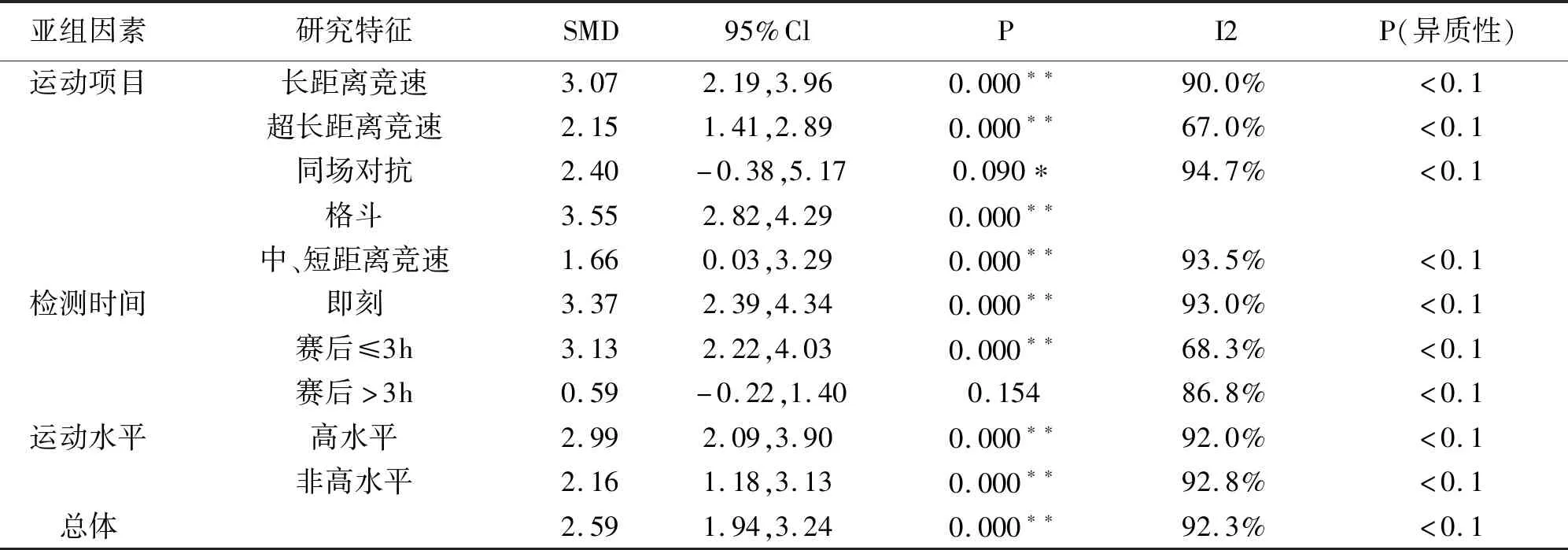
表8 可能异质性来源的亚组分析一览表
2.2.3 单核细胞
共9篇文献纳入分析,纳入样本量为107人,共产生29组数据,Meta分析结果显示,研究间总体存在高度异质性(I2=88.0%,P<0.1,图6)。采用随机效应模型得到合并研究的总效应量及95%Cl为0.88(0.34,1.43),达到非常显著性水平(P<0.01)。

图6 不同运动项目单核细胞效应量Meta分析森林图
对可能导致单核细胞异质性较大的原因,进行亚组分析发现(表8),超长距离竞速和同场对抗性项目具有非常显著的统计学意义(P<0.01);长距离和中、短距离竞速类项目存在高度异质性,不具有统计学意义(I2>70%,P>0.05)。即刻检测时单核细胞显著升高,赛后检测均未发现显著性意义。非高水平运动员单核细胞显著升高(P<0.01),高水平运动员未发现显著性意义。
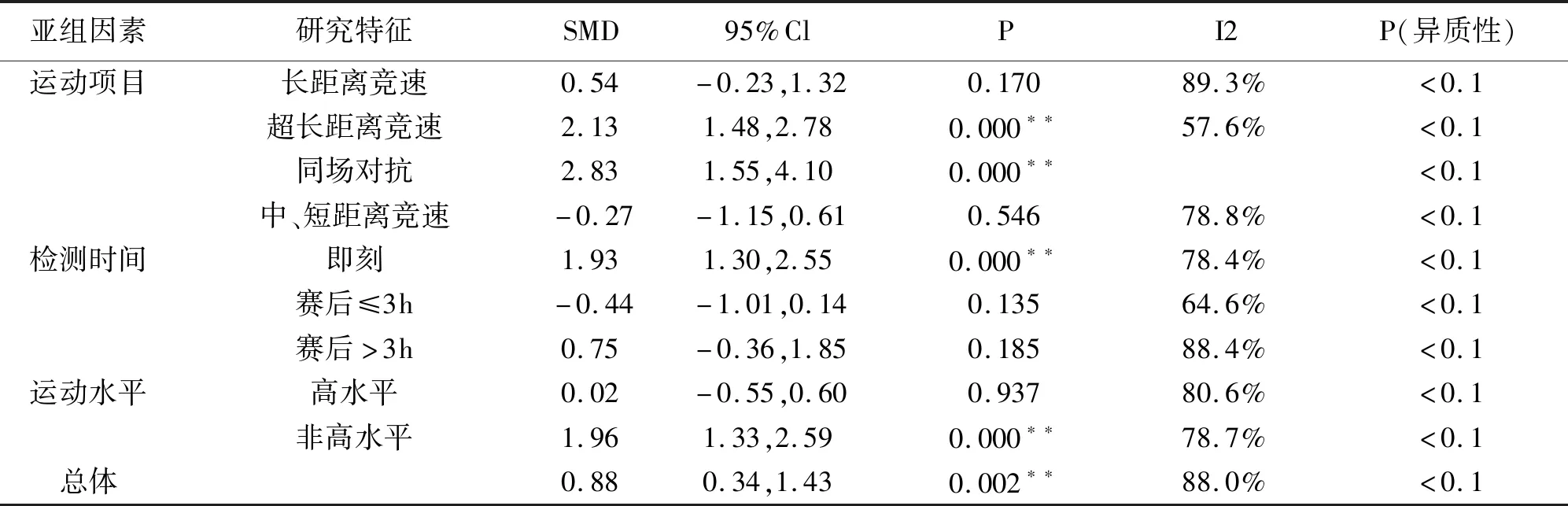
表8 可能异质性来源的亚组分析一览表
3 讨论与分析
3.1 运动对炎症因子的影响
炎症对机体免疫功能具有重要的调节作用,局部炎症可能影响效应T细胞与巨噬细胞的活化,进而影响细胞免疫与体液免疫的激活[7]。Meta分析结果显示,大强度急性运动后运动员体内CRP、IL-6、TNF-α水平均显著升高。综合3项指标结果显示,运动员在进行超级马拉松、铁人三项等超长距离竞速运动后,体内炎症因子在24h后仍显著高于运动前水平。对于不同竞技水平而言,高水平运动员比赛后24h内体内CRP、IL-6含量显著高于运动前水平[8],但中等水平运动员体内炎症因子的影响会持续更长时间[5,9],例如Arakawa[5]对为期2天全程130km跑的18位超级马拉松运动员进行检测,发现CRP、IL-6水平均显著升高,且运动性免疫抑制持续到运动结束后5天。
超长距离竞速运动对炎症因子的影响主要包括3个方面:1)大多数超长距离竞速项目处于极端条件下,且运动员对能量的需求较大,长时间的肌肉活动消耗了大量的肌糖原。糖原分解速率随运动强度改变,如运动强度分别为25%、54%、78%最大摄氧量时,相应的糖原分解速率分别为0.3、0.8、1.5mmol/kg,运动过程中肌糖含量减少会显著提高骨骼肌中IL-6基因的转录和IL-6蛋白的生成[7]。2)持续的长时间跑步会引起机体产生通气反应,这种反应最显著的特征是呼吸急促,伴有不同程度的低碳酸血症和呼吸性碱中毒,并一定程度上促进了IL-6细胞因子的产生[10]。3)长期大强度运动训练可能引起机体内各器官组织产生过度的应激,从而导致机体内各器官组织承受的生理负荷超过了正常的生理范围,使机体收到伤害,而大脑是最重要的人体器官,大强度运动训练时易引起扩张缺氧,从而产生多种炎性因子发生变化,引起一系列的炎性反应[10]。超长距离竞速导致大量骨骼肌损伤和急性炎症反应,在比赛后半段血清IL-6、CRP、TNF-α的变化更为明显[7]。
对于距离稍短的马拉松、递增负荷运动、自行车等长距离竞速项目而言,高水平运动员进行马拉松跑后体内炎症因子水平升高更为显著。例如Suzuki[11]发现2.6h左右完成马拉松比赛的运动员体内IL-6含量显著高于运动前水平(P<0.01)。与之相反的是,4h左右完成马拉松比赛的中等水平运动员体内IL-6、TNF-α水平显著下降[12],其运动强度一定程度有助于降低炎症因子含量,进一步印证中等强度运动能够提高机体免疫功能,而长时间高强度运动则造成暂时性免疫抑制。究其原因,不同水平运动员参加马拉松项目其肌糖原利用率、乳酸阈强度之间存在较大差异。高水平运动员执行定量的亚极量运动时,脂肪酸氧化供能的比率较高,相应的肌糖原利用速率减慢,对肌糖原的利用起节省作用,高水平运动员肌糖原分解速率相对比非训练者要快,保证了运动时产生较大的能量输出[13]。因此,运动水平、运动持续时间和强度是炎症因子变化的主要决定因素。
3.2 运动对白细胞亚型的影响
淋巴细胞作为构成免疫系统的主要细胞群体,其功能活性的变化直接关系到人体细胞免疫功能的强弱[14]。大量研究显示,淋巴细胞在运动过程中浓度升高,运动后反而下降,并低于运动前水平[15]。由Meta分析结果可知,急性运动后3h内淋巴细胞会显著降低(P<0.01)。研究显示,不同水平运动员进行递增负荷运动后淋巴细胞即刻升高,0.5h后出现降低趋势,1h后显著低于运动前水平[14-16]。有元分析指出,高强度运动后1h对机体淋巴细胞的免疫抑制最深刻,2.0h后将不会对宿主的免疫预防能力造成实质性伤害[17]。递增负荷运动以及元分析中纳入较多80%VO2max左右的有氧运动对机体淋巴细胞的影响相对较短,与之相比,任保莲[18]对运动员分别进行变速跑和间歇跑以及模拟400m跑比赛的田径训练后,得出淋巴细胞在运动后2~4h抑制最为深刻。超级马拉松运动后,淋巴细胞12h后显著下降,24h后逐复到原来水平[6,19-20]。
运动后即刻外周淋巴细胞升高的主要机制,首先,运动后即刻淋巴细胞增多与细胞毒性、抗原经验、炎症和抗原呈递有关,主要是NK细胞、CD4+T细胞和CD8+T细胞增多;其次,运动增加了血流动力学的力量、血浆儿茶酚胺的作用和β-肾上腺素受体[17]。急性运动结束后淋巴细胞下降的机制,主要包括:1)随着运动时间、运动强度的增加,机体的胸腺、脾脏会发生形态和功能的改变,脾脏的萎缩会损坏骨髓结构的变化,直接损害淋巴细胞的发源地,表现为淋巴细胞增殖能力降低[21];2)急性大负荷运动下调淋巴细胞内质网网膜钙通道基因表达,从而抑制胞内钙离子释放以及胞内Ca2+信号转导过程,相应地降低刺激剂诱导淋巴细胞增殖能力[22];3)恢复期淋巴细胞减少症,很可能是由于淋巴细胞在淋巴和非淋巴器官之间的重新分布,外周淋巴进入脾、肺、骨髓和淋巴结,这对免疫激活起到重要作用,可以保证免疫反应的调节[22]。
诸多研究认为,一次性大强度训练导致细胞数目的变化一般在24~36h后即可得到恢复,但其功能的恢复则需要更长时间[23-24]。运动中淋巴细胞数目变化与运动强度有关,表现在运动后升高程度与运动强度呈负相关,变化持续时间与运动持续时间呈正相关。进行长时间耐力运动、急性运动、高强度间歇、抗阻训练等均可暂时性的导致免疫功能下降,甚至造成不可逆的肾损伤[25]。提示教练员在这阶段,需根据运动项目特点,注意调整运动强度和运动量,避免过度训练导致的运动性免疫抑制,同时应注意加强营养,良好的碳水化合物和抗氧化剂的补充都有助于增强免疫系统。
中性粒细胞属于天然免疫系统是自发的宿主免疫,参与多种病理性的炎症反应,剧烈的长时间运动后会出现延迟性的中性粒细胞增多现象[15]。Meta分析结果显示,运动后3h内中性粒细胞均显著高于运动前水平,而后逐渐恢复到原来状态。Yamada[26]对青少年运动员进行递增负荷的力竭性运动实验后,运动后2h内中性粒细胞数量与测量时间成正比。超级马拉松运动、大强度400m田径训练后,24h内运动员体内中性粒细胞含量仍显著高于运动前水平[9,18]。在进行大负荷运动过程中,炎症介质如IL-6可刺激白细胞,特别是中性粒细胞和单核细胞的释放,其数量几乎是赛前的3倍[7]。白细胞计数的增加主要与血浆儿茶酚胺的升高有关,运动时,交感神经兴奋,血液中的肾上腺素与糖皮质激素等应激激素明显上升,促使安静状态下处于边缘池约等同于循环池数量的白细胞加速动员进入循环池及糖皮质激素,更可以促进中性粒细胞由储备池向循环池的加速移行,导致循环池中的中性粒细胞升高[18]。
Meta分析结果指出,运动后单核细胞即刻升高,赛后逐渐恢复,不同运动项目对单核细胞免疫性抑制的持续时间不同。无论是递增负荷的力竭性运动,还是4h的自行车长距离竞速运动,亦或是大强度的田径训练,均得出运动员单核细胞在运动结束后即刻升高,并在1~3h内逐渐恢复[26,27,18]。与之相对的是,Avloniti[16]对国家队足球运动员进行2h高强度同场对抗练习后单核细胞即刻检测时没有显著变化(P>0.05),4h后显著升高(P<0.01)。超级马拉松运动过程中及赛后24h内单核细胞均显著高于运动前水平,并持续到运动后48h[7,20,9]。
3.3 运动对黏膜免疫功能的影响
黏膜IgA较之血清IgA在机体抵御外来微生物入侵方面更具代表性[2],作为判断运动员是否易感新发的急性上呼吸道传染病COVID-19更具有针对性。Meta分析显示,急性大负荷运动对运动员黏膜免疫功能无显著统计学意义(P>0.05)。对于递增负荷运动、短道速滑、大负荷田径训练、足球比赛后均显示出唾液SIgA显著降低的共同规律[28-31],与之相比,10000m急性运动、田径短跨比赛结束后SIgA水平均显著升高(P<0.05)[28,30]。造成实验结果的差异可能与以下几点有关,1)高水平运动员对训练所引起的机体免疫适应性增加;2)与良好的比赛心理应激状态有关,高水平的训练和比赛将产生心理和生理性应激,而不良的应激状态将引起体内考的松、肾上腺素、神经肽大量释放,通过HPA轴抑制免疫功能[25];3)另外,可能与训练设计的科学化有关,运动员没有产生过度训练,机体在高强度大负荷的训练中表现出良好的适应能力[30],使机体对大运动量所产生的机体免疫反应有良好的应答,避免了过度训练而导致的“开窗”的发生。
运动过程中血糖、皮质醇和谷氨酰胺等的变化在唾液SIgA水平的改变中扮演着重要角色。一方面,运动后血糖、谷氨酰胺水平下降会直接影响淋巴细胞、巨噬细胞等免疫细胞的能源供应,继而抑制黏膜免疫系统功能;另一方面,血糖水平的下降会加强糖皮质激素的分泌,从而抑制淋巴细胞的增生,间接抑制了黏膜免疫状态;其次,运动后T细胞及B细胞活性的变化、运动中高通气量引起的口腔粘膜表面变化、浆细胞分泌SIgA的活动受抑制、蛋白分泌片(SC)对IgA的转运受抑制及心理因素等;最后,葡萄糖和谷氨酰胺等免疫细胞等能源物质供给不足,自由基、免疫抑制因子的大量产生也会降低免疫系统功能状态,这些都可能是长期耐力训练中唾液SIgA受累积性抑制的原因[32]。
3.4 局限性描述
1)本研究没有检索未发表的文献,egger检验提示部分指标可能存在一定的发表偏倚,可能夸大了阳性结果;2)运动后检测时间的差异,亚组分析时结局指标的时间节点未能细致划分。
4 结论
1)运动员在进行急性或长期大负荷运动时,在运动过程中及运动后短时间(1~3h)内对免疫系统的抑制最为深刻,所导致的细胞数目变化在24h后逐渐得到恢复。
2)急性或长期运动后免疫功能降低,其主要决定因素包括运动项目、运动水平、运动持续时间和强度。因此进行超长距离竞速类项目以及高强度同场对抗性项目时24h内应做好保护措施,中等水平运动员更长一段时间内应加强自我保护意识;进行如马拉松、自行车、递增负荷运动、田径训练等长距离和中、短距离竞速类项目时,运动后3h内为免疫功能下降高峰期。

