抗CD38单克隆抗体治疗多发性骨髓瘤的作用机制及研究进展①
余云艳 鄢玲利 刘白南
(遵义医科大学免疫学教研室,贵州省基因检测与治疗特色重点实验室,遵义563000)
随着肿瘤免疫和细胞生物学研究的不断深入,针对肿瘤的免疫疗法也在不断发展。肿瘤免疫治疗是指直接针对肿瘤抗原,激活肿瘤抗原引起的特异性免疫,逆转肿瘤环境中引起的免疫抑制等[1]。多发性骨髓瘤(multiple myeloma,MM)是一种恶性浆细胞型血液肿瘤,近几年,随着对免疫系统参与MM研究的不断深入,单克隆抗体逐渐成为MM治疗性用药的研究热点,治疗型单克隆抗体是主要以肿瘤抗原作为靶点的免疫疗法[2],其杀伤靶细胞的主要原因是肿瘤抗原在肿瘤细胞和正常细胞表面的表达差异,治疗型单克隆抗体与肿瘤抗原特异性结合,通过补体依赖的细胞毒性作用(complementdependent cytotoxicity,CDC)、抗体依赖性细胞介导的细胞毒作用(antibody-dependent cell-mediated cy‐totoxicity,ADCC)、抗体依赖的细胞吞噬作用(anti‐body-dependent cellular phagocytosis,ADCP)和诱导细胞凋亡杀伤肿瘤细胞[3-4]。因此,全面认识抗CD38单克隆抗体治疗MM的作用机制,可以正确引导针对肿瘤患者的免疫治疗。研究表明,靶向CD38和SLAMF7的单克隆抗体在治疗MM后取得了一定进展,其中位生存期可以达7~10年[5-6],在2015年,Daratumumab成为首个被批准用于治疗MM的抗CD38单克隆抗体。本文将对CD38的生物学功能和抗CD38单克隆抗体的作用机制、抵抗机制和研究进展进行概括。
1 CD38的生物学功能
CD38是一种单链跨膜Ⅱ型糖蛋白,包括1个长的羧基端胞外区(258个氨基酸),1个跨膜区(21个氨基酸)和1个短的氨基端胞内区(21个氨基酸)。CD38基因位于4号染色体(4p15),基因跨度大于80 kb,98%的基因序列由内含子组成,该基因包含8个外显子,其中有多个元件控制该基因的表达,包括位于CD38启动子上游的全反式维甲酸(ATRA)反应元件[7-8]。CD38在淋巴细胞、骨髓细胞及无造血功能的组织细胞中均有表达,在MM细胞膜上呈现过表达[9-10]。目前研究表明CD38具有酶活性、黏附功能和受体功能。CD38的胞外酶活性可将烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)和烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADP+)转化成环腺苷二磷酸核糖(cyclic adenosine diphosphate ribosyl,cADPR)和烟酸腺嘌呤二核苷酸磷酸(nicotinic acid adenine dinucleotide phosphate,NAADP)[9],而cADPR和NAADP能够使细胞内Ca2+释放参与钙离子动员[11],同时,CD38的酶活性可调节NAD+水平改善蛋白酶抑制剂(protease inhibitor,PI)的功能[12]。不仅如此,在CD38黏附功能的研究中发现,CD38参与细胞间的黏附,引起细胞迁移到组织的模式有所不同。而CD38作为受体,可与T细胞、B细胞和NK细胞的表面分子CD31(CD38天然的配体)相互作用激活跨膜信号传导,导致钙离子动员和细胞因子分泌,从而引起T细胞和NK细胞活化[13]。因此,CD38具有多种生物学功能,在MM细胞膜上的过表达使之成为治疗MM的理想靶标。
2 抗CD38单克隆抗体的作用机制
研究发现抗CD38单克隆抗体通过引起多种免疫效应机制,即CDC、ADCC、ADCP和细胞凋亡等,诱导肿瘤细胞发生免疫源性死亡(图1)[14],其中ADCC、ADCP主要依赖抗体的Fc端与免疫效应细胞膜上表达的FcγR相互作用杀伤靶细胞。目前Dara‐tumumab已经被批准单独用于临床治疗RRMM[15]。同时,还有其他抗CD38单克隆抗体正在进行临床研究,包括Isatuximab和MOR202[16]。由于每种抗CD38单克隆抗体杀伤靶细胞的作用机制存在差异,对抗CD38单克隆抗体作用机制的认识可以更好地指导临床治疗研究。
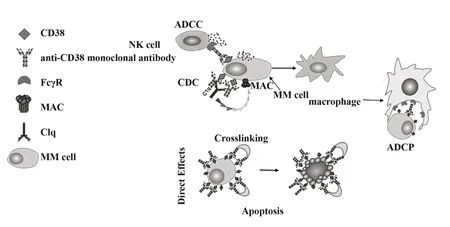
图1 抗CD38单克隆抗体作用机制示意图Fig.1 Schematic diagram of the action mechanism on an⁃ti-CD38 monoclonal antibody
2.1 补体依赖的细胞毒性杀伤机制(CDC)补体在机体的防御机制中起重要作用。其中诱导CDC是当抗CD38单克隆抗体与MM细胞表面的CD38结合形成免疫复合物后,单克隆抗体的重链铰链区发生构型改变,暴露出补体结合位点,激活补体的经典途径,C1q与抗CD38单克隆抗体的补体结合位点结合后,依次活化C1r、C1s、C4、C2、C3,紧接着形成C3转化酶和C5转化酶[17],进而形成攻膜复合体(membrane attack complex,MAC),使细胞膜形成小孔导致细胞溶解。同时随着补体途径的激活,C3b片段在MM细胞表面上沉积可使吞噬细胞通过补体受体识别并结合MM细胞,由此增强吞噬细胞对MM细胞的吞噬和清除功能[18]。
在目前的抗CD38单克隆抗体中,Daratumumab是最有效的CDC诱导剂[10],与之相反,MOR202诱导的CDC较弱,而Isatuximab诱导的CDC与MM细胞膜表面CD38的表达量密切相关[3]。通过对多种MM细胞系中CD38的表达和MM患者中C3相关片段的检测证实了以上观点,且研究发现只有当MM细 胞 膜 表 面过 表达CD38时 才 可以 诱导CDC[3,19]。由于MM细胞膜上CD38的表达存在差异,对MM患者的骨髓样本进行CDC分析,观察到MM细胞对Daratumumab的敏感性存在明显的异质性,与低表达CD38的MM细胞相比,Daratumumab会优先杀死过表达CD38的MM细胞[9]。而NK细胞是免疫效应过程中发挥关键作用的固有免疫细胞,其表达CD38,但将来自健康捐献者的外周血单个核细胞(PBMC)和Daratumumab共同孵育后测定CDC,分析发现CD38-/lowNK细胞、B细胞、T细胞和单核细胞并没有诱导CDC。该研究表明Daratumumab诱导CDC可能需要细胞膜表面CD38的表达量超过某个阈值,当超过阈值时细胞表面形成的MAC就会诱导CDC的发生[20]。
2.2 抗体依赖性细胞介导的细胞毒作用杀伤机制(ADCC)NK细胞是ADCC中的主要效应细胞,通过细胞表面的FcγR介导ADCC[21]。当抗CD38单克隆抗体的Fab端与MM细胞表面的CD38结合后,Fc端与免疫效应细胞表面的FcγR结合后激活ADCC,NK细胞释放穿孔素、颗粒酶等细胞毒性物质杀死靶细胞,此外,巨噬细胞、嗜中性粒细胞、嗜酸性粒细胞和γδT细胞也表达FcγR介导的ADCC[22]。现有的研究已经证实Daratumumab、Isatuximab和MOR202通过依赖NK细胞表达的FcγR介导ADCC杀伤MM细胞[1,23],且Daratumumab诱导ADCC的抗肿瘤活性与MM细胞和NK细胞膜表面CD38的表达量紧密相关。临床数据显示,MM患者首次使用Daratumumab治疗后,MM细胞及其他非恶性细胞(如NK细胞、T细胞、B细胞和单核细胞)中,过表达CD38+MM细胞大量减少,同时CD38+NK细胞也会减少,而CD38+NK细胞减少会引起ADCC对MM的疗效下降[19,24]。
2.3 抗体依赖的细胞吞噬作用(ADCP)肿瘤细胞的抗原决定簇(表位)与抗体的超变区相互作用后,抗体的Fc段与单核细胞和巨噬细胞膜表面存在的FcγR(主要为FcγRⅡa和FcγRⅢa)结合诱导AD‐CP,肿瘤细胞被单核细胞和巨噬细胞吞噬消化[25]。由于巨噬细胞是MM肿瘤微环境的组成部分,在体外试验研究中,活细胞成像仪和流式细胞仪发现Daratumumab与CD38+MM细胞结合后,单个巨噬细胞能够快速吞噬与Daratumumab结合的MM细胞。OVERDIJK等[14]用缺乏B细胞、T细胞和NK细胞的免疫缺陷SCID-BEIGE小鼠,证实了巨噬细胞的吞噬作用有助于增强Daratumumab的抗肿瘤活性,因此ADCP是Daratumumab有效杀伤MM细胞的机制,但Daratumumab诱导的ADCP与CD38的表达有关,Daratumumab不易诱导低表达CD38的MM细胞的ADCP[26]。另外,巨噬细胞与Daratumumab和其他肿瘤细胞共同培养(如Burkitt淋巴瘤细胞),能够有效地诱导巨噬细胞吞噬淋巴瘤细胞,表明Daratumumab还可能在其他疾病中发挥免疫作用[27]。此外,Isatuximab和MOR202也能与过表达CD38+MM的细胞结合诱导ADCP[1]。
2.4 细胞凋亡有研究表明,MM细胞膜表面的CD38与抗CD38单克隆抗体结合后,可由Fc-FcγR介导,激活肿瘤细胞的胞内相关信号,诱导肿瘤细胞发生程序性死亡(programmed cell death,PCD),PCD的主要特征是细胞聚集、形态学的改变、磷脂酰丝氨酸易位、线粒体膜电位和膜完整性丧失[4,28]。目前已用正常表达FcγR的NOTAM小鼠和FcγR-/-敲除小鼠进行试验,确定Daratumumab能通过FcγR介导的交联引起CD38+MM细胞发生PCD[4,14]。然而Isatuximab与Daratumumab、MOR202有 所 不 同,Isatuximab与过表达CD38+的MM细胞结合后,通过经典的caspase依赖性凋亡途径和溶酶体相关死亡途径直接诱导PCD发生,其特点是溶酶体扩充使溶酶体膜通透性增加和组织蛋白酶、水解酶释放[4]。另外,泊马度胺和来那度胺与Isatuximab联合治疗可增强Isatuximab直接杀伤MM细胞的活性[3,29]。
3 抗CD38单克隆抗体抵抗机制
最近几年的临床数据和试验研究显示,抗CD38单克隆抗体在MM的治疗中取得了较好的成果,但一些MM患者仍然会发展为RRMM。现有的研究指出,存在一些抵抗机制能够影响抗CD38单克隆抗体的抗肿瘤活性,例如CD38表达量减少、CDC、ADCC、ADCP(图2)。
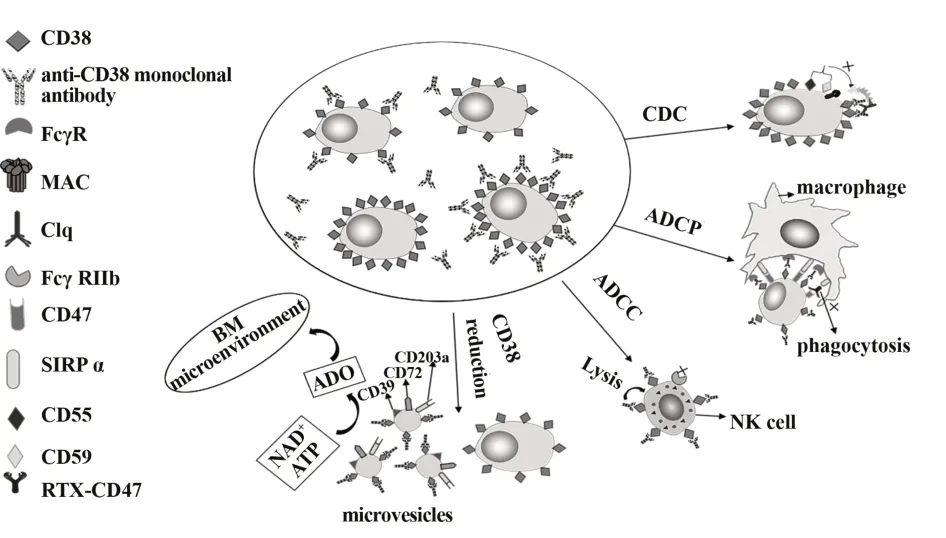
图2 抗CD38单克隆抗体抵抗机制示意图Fig.2 Schematic diagram of anti-CD38 monoclonal anti⁃body resistance mechanism
3.1 CD38表达量减少抗CD38单克隆抗体的抗肿瘤活性主要依赖于MM细胞过表达CD38,而对抗CD38单克隆抗体无反应的患者的MM细胞低表达CD38,因此可以得出CD38的表达量是抗CD38单克隆抗体治疗MM患者取得良好疗效的关键[19]。在GEN501研究中,采用流式细胞术检测MM患者的骨髓细胞后,发现MM细胞的CD38表达减少不仅发生于Daratumumab治疗期间的MM患者,还发生于进展期的MM患者[30]。然而有研究发现,Daratumumab治疗MM患者后CD38表达量减少只是瞬时效应,当Daratumumab停止治疗3~6个月后,CD38表达量会逐渐恢复,且Daratumumab不仅可使MM细胞表面CD38表达减少,也可使其他细胞(T细胞、B细胞、单核细胞、NK细胞)发生同一种现象[30-31]。
目前认为CD38减少的主要原因有以下两方面(图2),首先是Daratumumab通过ADCC和CDC选择性杀死过表达CD38的MM细胞,使低表达CD38的MM细胞得以存活,因此可以得出CD38的过表达是Daratumumab发挥抗肿瘤活性的关键因素之一[32]。其次,研究发现,在37℃条件下,用Daratumumab处理MM细胞时,MM细胞骨架发生改变,通过微囊泡的形式释放CD38[33-34]。这些微囊泡不仅表达CD38,还表达其他胞外酶(CD39、CD203a、CD73),可分解ATP和NAD+产生腺苷(ADO)释放到肿瘤微环境中,抑制免疫效应细胞分泌多种细胞因子,诱导免疫细胞不发挥免疫效应作用,从而帮助肿瘤细胞逃逸[32,35]。另外,ATRA和免疫调节药物(immuno‐modulatory drugs,IMiDs)能增加MM细胞表面CD38表达,因此,IMiDs和Daratumumab联合治疗时能够增强Daratumumab的抗肿瘤活性[19]。
3.2 补体依赖的细胞毒性的抵抗(CDC resis‐tance)近年研究发现,补体激活产物或肿瘤细胞表面过表达的补体调节蛋白可通过不同的机制介导肿瘤免疫逃逸,促进肿瘤生长。如膜补体调节蛋白CD46、CD59和CD55抑制MAC的形成,从而抑制补体对肿瘤细胞的细胞毒效应,帮助肿瘤细胞逃逸和药物抵抗[36]。
NIJHOF等[30]研究发现,Daratumumab对低表达CD55和CD59的MM细胞与淋巴瘤细胞系有较好的疗效,使用特异性磷脂酶C将细胞膜上的锚定蛋白CD55和CD59水解后,明显提高了Daratumumab对MM细胞的敏感性。而且NIJHOF等[30]的结果与GEN501和SIRIUS研究的结论一致,但在GEN501和SIRIUS研究中发现,进展期患者的MM细胞过表达CD55和CD59,表明CD55和CD59的过表达可能与Daratumumab介导CDC的抵抗机制有关[27]。更重要的是,ATRA可使肿瘤细胞表面的补体调节蛋白CD55和CD59表达减少,增加CD38表达,从而提高Daratumumab对MM细胞补体攻击的敏感性[19]。
3.3 抗体依赖的细胞介导的细胞毒性的抵抗(ADCC resistance)抗CD38单克隆抗体介导的ADCC主要与CD38的表达量、NK细胞数和免疫效应细胞表面的FcγR紧密相关,并且能有效地活化NK细胞通过ADCC杀伤MM细胞[22]。
目前研究发现,IMiDs能够增加CD38表达,并可与Daratumumab通过协同作用诱导ADCC杀伤MM细 胞[21]。在GEN501和SIRIUS研 究 中 发 现,Daratumumab首次治疗MM患者后,其介导的ADCC会引起外周血和骨髓中CD38+NK细胞大量减少,因此NK细胞的减少会使ADCC杀伤MM细胞的能力减弱,影响Daratumumab的临床疗效,增加疾病复发的风险,然而存活的CD38-/lowNK细胞比CD38+NK细胞具有更好的增殖能力和细胞毒性,能够有效地杀伤MM细胞[21,24]。于是WANG等[24]提出是否可以通过输注体外扩增自体NK细胞去提高Daratumum‐ab的抗肿瘤活性。虽然目前还没有获得Isatuximab和MOR202减少NK细胞数的临床数据,但在体外试验 中,Isatuximab和MOR202也 能诱 导ADCC减 少NK细胞[37]。
抗CD38单克隆抗体的ADCC是通过免疫效应细胞表达的FcγR实现的,不同的FcγR会产生不同的作用,其中FcγRⅡA-131H和FcγRⅢA-158V与IgG型抗CD38单克隆抗体的Fc段具有高亲和力,可以增强ADCC杀伤MM细胞[36]。相反,FcγRⅡb是一种抑制性受体,表达FcγRⅡb的NK细胞具有负反馈调节反应,从而影响抗CD38单克隆抗体诱导ADCC的抗肿瘤活性[37]。
3.4 抗体依赖的细胞吞噬作用的抵抗(ADCP resis‐tance)抗CD38单克隆抗体介导的ADCP与CDC和ADCC相似,也依赖MM细胞过表达CD38,且与ADCC相同,其免疫效应细胞表达不同的FcγR,也会影响ADCP清除MM的能力[19]。
最近的研究发现抗CD38单克隆抗体介导的ADCP与CD47有关,CD47是一种整合素相关蛋白,广泛表达于正常细胞,过表达于MM细胞,当CD47与巨噬细胞上的受体信号调节蛋白(signal regulatory protein α,SIRPα)结合后,引起SIRPα胞内段免疫受体酪氨酸抑制基序(immunoreceptor tyrosine-based inhibition motif,ITIM)的酪氨酸残基磷酸化,阻断了吞噬信号传递。而CD47-SIRPα就像是一个“不要吃我的信号”,阻止了巨噬细胞对MM细胞的吞噬作用,促进MM细胞的发生和发展[38]。已有研究证明,可通过一种双特异性抗体RTX-CD47识别CD47,并阻断CD47-SIRPα信号传递,促进巨噬细胞的吞噬作用。总而言之,CD47的阻断能增强抗CD38单克隆抗体的抗肿瘤活性[39]。另外,低剂量的环磷酰胺(CTX)能通过增加巨噬细胞表面的FcγR表达和减少肿瘤细胞上的CD47表达增强Daratumumab诱导的ADCP[37]。综上所述,IMiDs和抗CD38单克隆抗体联合治疗MM患者也能增强ADCP。
4 抗CD38单克隆抗体治疗MM的研究进展
4.1 Daratumumab目前在临床上有许多关于MM治疗的研究,其中IMiDs和蛋白酶抑制剂治疗RRMM的预后效果较差,而Daratumumab具有良好的抗CD38活性[40]。Daratumumab是重组人源CD38蛋白免疫人源化转基因小鼠后,通过杂交瘤技术获得的一种人源化CD38 IgG1单克隆抗体。多项研究表明,无论Daratumumab单独治疗还是联合用药治疗RRMM都具有一定的效果,根据GEN501研究的结果,在2015年Daratumumab就已经被美国食品和药物管理局(FDA)批准可以用于治疗MM的单克隆抗体药物,在2016年被欧洲药品管理局(EMA)批准可用于RRMM[9,41]。
在GEN501试验中,Daratumumab是第一个作为单独治疗药物进入Ⅰ/Ⅱ期临床试验阶段的,该试验分为两个部分,首先基于3+3剂量递增的方式去评估安全性和药代动力学,最初对患者进行Daratu‐mumab低剂量治疗,在0.005~24 mg/kg范围内,每周静脉注射1次连续注射8周,未发现最大耐受剂量。其次是进行评估Daratumumab的安全性和有效性,将所有患者分为8 mg/kg和16 mg/kg两个剂量组,分别对30例和42例患者进行治疗,发现16 mg/kg的总反应率(overall response rate,ORR)为36%,而8 mg/kg的ORR为10%[42]。此外,在Daratumumab的Ⅱ期SIRIUS研究中,有106例RRMM患者已经接受过 治疗,将GEN501和SIRIUS对RRMM进行16 mg/kg Daratumumab治疗的数据进行汇总分析后,其结果显示ORR为31.1%,中位无进展生存期(progression-free survival,PFS)为4个月,总生存期(overall survival,OS)为20.1个 月[43]。而 在 进 行Daratumumab首次治疗时,71%的患者出现了输液相关反应,大多数患者出现的输液相关反应是发热、恶心、疲劳、支气管痉挛[42]。同时MM是一种非常具有异质性的疾病,对特定药物的敏感性不同。因此,具有重叠毒性和协同作用机制的多种药物联合使用是改善临床预后的一种策略。基于抗CD38单克隆抗体杀伤靶细胞的作用机制,将抗CD38单克隆抗体与IMiD联合治疗RRMM,可显著增强NK细胞的活性和巨噬细胞吞噬肿瘤细胞的活性,因此将药物的联合治疗方案作为Ⅲ期试验[44]。对569例RRMM患者进行药物联合试验,每位患者之前都已平均接受了一种药物疗法,有40%的患者已经接受PI和IMiDs治疗,将569例患者随机化分组进行对照组来那度胺-地塞米松(dexamethasone)和实验组Daratumumab+来那度胺-地塞米松治疗,随后进行了13.5个月中位随访,发现有169例患者发生了疾病进展或死亡,其中实验组53例,对照组116例,对照组和实验组12个月的PFS分别为60.1%和83.2%,ORR分别为76.4%和92.9%,完全缓解率(complete response rate,CR)分别为19.2%和43.1%。以上结果提示Daratumumab联合治疗RRMM可以改善预后,治疗期间最常见的毒副反应是血小板减少、中心粒细胞减少和贫血[45]。
4.2 Isatuximab Isatuximab是一种治疗MM的新的人源化IgG1单克隆抗体,其可选择性的与恶性浆细胞表面的CD38结合[46]。如上所述,Isatuximab可通过多种机制杀伤MM细胞,Isatuximab与Daratu‐mumab和MOR202的不同之处在于不需抗体之间的交联即可直接诱导PCD发生,而Isatuximab在非霍奇金淋巴瘤、MM、急性淋白血病的异种移植模型中也表现出抗肿瘤活性[27,47]。
首先对Isatuximab以剂量递增的方式在RRMM患者中进行Ⅰ期评估,包括安全性、耐受性、药代动力学、药效学和疗效,其中有许多RRMM患者已经接受过治疗。当采用10 mg/kg Isatuximab治疗患者时,ORR为23.8%,CR为6%,Isatuximab最大的耐受剂量可达20 mg/kg,最常见的毒副反应发生在首次注射Isatuximab,包括恶心、发热、呕吐、呼吸困难、咳嗽和鼻塞[48]。对Isatuximab和多种药物联合进行评估,随机的选择307例RRMM患者将其分为2组进行试验,154例患者为实验组,采用Isatuximab-泊马度胺-地塞米松进行治疗,而153例患者为对照组,采用马度胺-地塞米松,随后进行了11.6个月的中位随访期,实验组和对照组的中位PFS分别为11.5个月和6.5个月,最常见的毒副反应是输液反应、上呼吸道感染、腹泻[47]。总之,药物联合治疗结果表明,Isatuximab-泊马度胺-地塞米松联合是治疗RRMM的一种有效且耐受性良好的选择,可为患者提供新的治疗方案。
4.3 MOR202 MOR202是 针 对CD38的 一 种 人 源化IgG1单克隆抗体,可通过ADCC、ADCP杀伤靶细胞,也可通过交联反应促进细胞凋亡,但其CDC作用较弱[49]。目前研究发现,来那度胺和维生素D能够增强MOR202介导的巨噬细胞毒性作用,补充维生 素D可提 高MOR202对MM患者的疗 效[50],而MOR202在RRMM患者中进行Ⅰ/Ⅱ期试验,MOR202的耐受剂量可达20 mg/kg,还未达到最大耐受剂量,另外来那度胺,硼替佐米也能增强MOR202的细胞毒作用,试验研究结果显示MOR202与来那度胺或泊马度胺联合治疗在一定程度上控制了恶性肿瘤的发展,但需要进一步评估MOR202联合药物治疗的安全性和疗效[23]。
5 总结与展望
由于抗CD38单克隆抗体具有多效性作用机制,同时具有较高的单药活性和与其他抗癌药物的协同作用,目前Daratumumab单抗治疗RRMM的疗效已在Ⅲ期临床试验中得到证实,且Daratumumab与其他药物的联合治疗RRMM也取得了一定效果。此外,其他抗CD38单克隆抗体也正在临床试验中。在今后的临床研究中,应进一步加深对抗CD38单克隆抗体杀伤肿瘤细胞作用机制和抵抗机制的理解,充分利用抗体的抗肿瘤活性,促进其在肿瘤精准治疗领域中的应用。