miR-194-5p靶向TSPAN1基因对皮肤鳞状细胞癌细胞增殖、凋亡及侵袭的影响
郜亮 贾振宇(长治医学院附属和济医院皮肤性病科,长治046000)
皮肤鳞状细胞癌(cutaneous squamous cell carci‐noma,CSCC)是一种表皮角质形成细胞衍生的皮肤肿瘤,是世界上最恶性的皮肤肿瘤之一[1]。主要表现为一系列的进展性恶性肿瘤,从前体光化角质病到原位鳞状细胞癌、浸润性鳞状细胞癌,最后到转移性鳞状细胞癌[2]。TSPAN1定位于人类染色体1p34.1,属于四跨膜蛋白超家族新成员,在多种肿瘤组织及细胞中均有表达,其机制可能是通过转导细胞分裂的信号或引起细胞异向分化或去分化,导致癌组织细胞增殖或血管生成等,参与癌变和侵袭转移过程[3]。CHEN等[4]发现抑制TSPAN1基因表达能够减少CSCC的增殖、迁移和浸润等恶性生物学行为。本研究从miRNA靶向基因对疾病进展进行调控的角度出发,探讨可能影响TSPAN1表达的miRNA,选中miR-194-5p作为研究点。
miR-194-5p参与乳腺癌、肝癌、胃癌、膀胱癌、卵巢癌等多种肿瘤的生长和转移,其上调往往能够抑制癌细胞的迁移与侵袭等[5-9]。WANG等[10]曾证明miR-194-5p与TSPAN1之间的靶向关系,阐明miR-194-5p作为上游因子调控TSPAN1表达,从而对癌细胞产生影响。但是其在CSCC中的作用并未完全明确。本研究在前人研究的基础上提出假设:miR-194-5p能够靶向抑制TSPAN1的表达进而调控CSCC的进展。
1 材料与方法
1.1 材料
1.1.1 细胞来源与试剂CSCC A431细胞系购自ATCC细胞库;苏木精-伊红染色试剂盒(G1120)、DAB(DA1010)、RIPA裂解液(R0010)、DEME高糖型培养基(11995)购自索莱宝科技有限公司;兔抗人一抗TSPAN1(ab254730)、Bax(ab32503)、c-myc(ab32072)、Bcl-2(ab32124)、羊 抗 兔IgG二 抗(ab150077)和Annexin V-FITC试剂盒(ab14085)均购自Abcam公司;光镜(37XF-PC)购自上海光学仪器厂;RNA提取试剂盒(10296010)、Lipofectamine2000(11668027)、无血清培养基Opti-MEMI(31985-070)购自Invitrogen公司;PrimeScript RT试剂盒(RR014A)购自宝日医生物科技公司;qRT-PCR引物序列由华大基因合成;PCR试剂盒(KR011A1)购自北京天根生化科技有限公司;BCA试剂盒(23227)购自Thermo Fisher;ECL试剂盒(36208ES60)购自Amersham Life Sciences公司;双荧光素酶试剂盒(E2920)购自Pro‐mega;细胞转染序列均购于上海吉玛制药技术有限公司;MTT溶液(GL0247)购自北京百奥莱博科技有限公司。
1.1.2 主要仪器酶标仪(SP-Max 3500FL)购自上海闪谱生物科技有限公司;24孔板8 μm Transwell小 室(3413)购 自Corning公 司;Matrigel基 质 胶(40111ES08)购自Sigma公司;倒置显微镜(YKDZ-55)购自上海永科光学仪器有限公司;流式细胞仪(CytoFLEX)购自贝克曼库尔特。
1.2 方法
1.2.1 研究对象收集我院2017年至2019年根据临床表现及组织病理明确诊断的患者病变组织及正常皮肤组织:CSCC共82例(男49例,女33例),作为Model组,年龄38~79岁,平均(62.15±11.47)岁。CSCC组中高分化38例,中分化25例,低分化19例。手术前均未进行过放疗、化疗及其他特殊治疗,且无免疫性疾病及系统性疾病。所有CSCC组织及正常皮肤组织样本均切成小块后迅速置于冻存管中液氮保存,后移至-80℃冰箱。该实验所有患者均对实验知情同意,并签署知情同意书,且通过我院临床试验伦理委员会同意。
1.2.2 HE染色所有的标本经甲醛固定,石蜡包埋,4 μm连续切片,进行苏木精-伊红(HE)染色,HE染色步骤:二甲苯脱蜡2次每次15 min;无水乙醇5 min 2次;90%乙醇5 min;80%乙醇5 min;水洗5 min。苏木素染色:苏木素液染5 min,水洗至变蓝;1%盐酸乙醇快速分化,水洗至变蓝。脱水、透明、封片:80%乙醇5 min;90%乙醇5 min;无水乙醇5 min 2次;二甲苯15 min 2次;中性树胶封片。HE染色光镜病理组织学检查并摄片,观察各组显色情况。在形态学图像分析系统上,在400倍放大倍数下取不同组别,并随机采集图像,实验重复3次。
1.2.3 免疫组织化学检测TSPAN1蛋白阳性表达率取10%的甲醛固定标本,石蜡包埋连续切片厚4 μm。将组织切片放入60℃温箱烘1 h,常规二甲苯脱蜡,梯度乙醇脱水。高温高压下用柠檬酸修复,1 800 W加热切片,喷气后改为1 000 W继续加热2 min,关掉电磁炉后,自然冷却10 min,用自来水冷却10 min,开高压锅盖,逐渐用自来水冷却切片。0.2 mol/L PBS溶液(pH7.4)洗5 min×3次,擦干切片,滴加入兔抗人TSPAN1多克隆抗体,4℃孵育过夜,0.2 mol/L PBS溶液(pH7.4)洗5 min,共3次;擦干切片后,加入过氧化物酶标记的二抗,室温下孵育15 min;配制显色剂,将DAB的A、B、C试剂各l滴加入1 ml蒸馏水中,混匀,置4℃冰箱保存;0.2 mol/L PBS溶液(pH7.4)洗5 min,共3次;DAB显色,室温暗室保存8 min;用自来水充分冲洗后,苏木紫浸染、脱水、透明、封片,光镜观察。阴性细胞核为蓝色或浅蓝色,阳性细胞核为黄色或棕黄色,采用日本Nikon图像分析软件进行阳性细胞计数,每张切片选取3个等面积不重复的视野(200倍),计算阳性细胞数量,阳性表达率=阳性细胞数/总细胞数×100%。
1.2.4 qRT-PCR检测采用RNA提取试剂盒提取组织中总RNA,鉴定RNA纯度和完整性后,采用PrimeScript RT试剂盒将RNA逆转录成cDNA。设计miR-194-5p、TSPAN1、c-myc、Bcl-2、Bax、内参U6和GAPDH引物,交由华大基因合成(表1)。按PCR试剂盒操作步骤进行qRT-PCR反应。miR-194-5p的相对表达水平以U6为内参,TSPAN1、c-myc、Bcl-2、Bax相对表达水平以GAPDH作为内参,采用2-ΔΔCt法检测各组基因的表达量并进行比较。(该实验同样适用于细胞实验)。

表1 qRT-PCR引物序列Tab.1 qRT-PCR primer sequences
1.2.5 Western blot检测各组蛋白表达水平分组收集转染48 h后细胞,加入RIPA蛋白裂解液,冰上裂解30 min,以12 000 r/min、4℃离心20 min,取上清液分装备用。按照BCA试剂盒说明书操作测定总蛋白含量后分装,置于-80℃冰箱冷冻,待用。分别取各组50 μg蛋白,加入蛋白质变性剂后行SDSPAGE凝胶电泳,转膜、封闭、过夜后,PBST漂洗(5 min×3次),分别加入一抗兔抗人TSPAN1、Bax、c-myc、Bcl-2抗体。37℃孵育2 h,PBST漂洗(10 min×3次),加入辣根过氧化物酶标记的羊抗兔IgG,37℃孵育2 h,PBST充分漂洗(10 min×3次)后,化学荧光法显色,使用Image J灰度分析软件对Western blot检测结果作半定量分析。以GAPDH作内参,以目标条带与内参照条带的灰度值之比作为蛋白质的相对表达水平。
1.2.6 双荧光素酶报告实验生物学预测网站Targetscan分析TSPAN1的靶向miRNA,人工合成TSPAN1 3'UTR基因片段利用内切酶位点SpeⅠ和HindⅢ引入pMIR-reporter中,在TSPAN1野生型上设计种子序列的互补序列突变位点,通过限制性内切酶酶切后使用T4 DNA连接酶将目的片段插入pMIR-reporter报告质粒。将测序正确的荧光素酶报告质粒WT、MUT分别与miR-194-5p共转染至细胞HEK-293T。转染48 h后收集并裂解细胞,分别使用荧光素酶检测试剂盒检测荧光素酶活性。
1.2.7 细胞培养、分组与转染将人正常皮肤细胞和人A431细胞贴壁培养于DMEM(高糖型)完全培养基(含100 U/ml青霉素、10%小牛血清、100 μg/ml链霉素)中,置于饱和湿度、37℃、5%CO2培养箱内培养,每1~2 d换液1次,细胞为单层贴壁生长,到长满瓶底时,用0.25%胰蛋白酶消化为单个细胞,获取对数生长期的细胞准备实验。
选择第3代细胞分为7组:Normal组,Blank组(空白对照组)、negative control(NC)组(阴性对照)、miR-194-5p agomir组(转染miR-194-5p agomir)、miR-194-5p antagomir组(转染miR-194-5p antagomir)、shRNA-TSPAN1组(转染shRNA-TSPAN1)、miR-194-5p agomir+shRNA-TSPAN1组(转染miR-194-5p agomir和shRNA-TSPAN1)。将处于对数生长期的A431细胞接种于6孔板,细胞密度生长至30%~50%,按li‐pofectamin 2000说明书转染细胞。转染步骤依据试剂盒说明书进行。
1.2.8 MTT法检验各组细胞转染后增殖能力变化取处于对数生长期、生长状态良好的细胞以1×104个/孔接种于96孔培养板,每孔培养基体积200 μl。细胞贴壁24 h,于37℃、5%CO2培养箱中继续培养至24 h、48 h及72 h,每孔加20 μl MTT溶液(5 mg/ml),37℃孵育4 h,弃上清液,每孔加150 μl DMSO,振荡10 min,酶标仪测490 nm各孔光吸收值OD,实验重复3次,取3次结果的平均值,记录结果。
1.2.9 Transwell检测取各组侵袭转染48 h后的细胞于无血清培养基中饥饿12 h后消化,PBS冲洗2遍,用含10 g/L BSA(牛血清白蛋白)的无血清培养基Opti-MEMI重悬细胞,调整细胞浓度为2×106个/ml。实验采用24孔板8 μm Transwell小室,每组3个小室,实验前在小室铺50 μl Matrigel基质胶,48 h后在Transwell小室上室分别加入各组细胞的单细胞悬液200 μl(4×104个细胞),而小室下室加入650 μl含10% FBS的G-DMEM培 养 液,置 于37℃、5%CO2培养箱中培养12 h。取出小室后,PBS淋洗,后置于甲醇溶液中,室温下固定30 min,再用0.1%结晶紫染色20 min,用棉签小心擦去微孔膜上层细胞,于倒置光学显微镜下观察并采集图像,随机选取4个视野,计算穿过微孔膜的细胞数,计算平均值。实验重复3次。
1.2.10 流式细胞术分析细胞凋亡率Annexin VFITC/PI双标染色检测细胞凋亡,将处理好的细胞置于37℃、5%CO2培养箱中培养48 h,收集细胞,PBS溶液洗涤2次后离心将细胞重悬于200 μl结合缓冲液中,加入10 μl Annexin V-FITC和5 μl PI混合液,避光室温反应15 min,加入300 μl结合缓冲液,用流式细胞仪以激发波长488 nm检测细胞凋亡情况。
1.3 统计学分析所有数据均采用SPSS21.0统计学软件(USA)处理,计量资料采用±s的形式表示,两组间比较为t检验,多组间比较应采用单因素方差分析。P<0.05表示差异具有显著性统计学意义。
2 结果
2.1 HE染色结果HE染色结果显示,正常皮肤组织基底层和角质层有明显分层,细胞核完整清晰,而CSCC组织中组织切片表皮层明显增厚,基底层与角质层之间的分层界限基本消失,角质层细胞角化不完全,细胞核形态也发生改变(图1)。
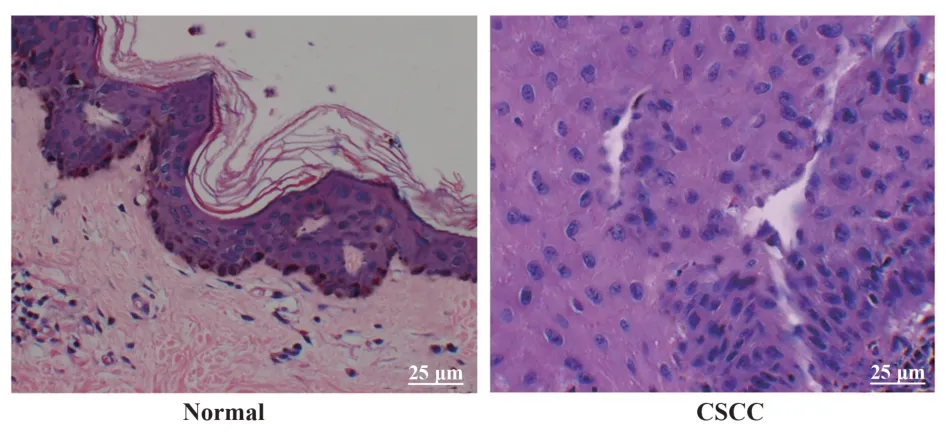
图1 正常皮肤组织和CSCC组织病理学观察Fig.1 Histopathological view of normal skin tissue and CSCC tissue
2.2 CSCC组织中TSPAN1表达增高与正常皮肤组织相比[阳性率(14.75±2.14)%],CSCC组织中TSPAN1细胞阳性率为(78.47±6.51)%,其表达显著上调(P<0.05)。提示TSPAN1可能参与了CSCC的进展。见图2。
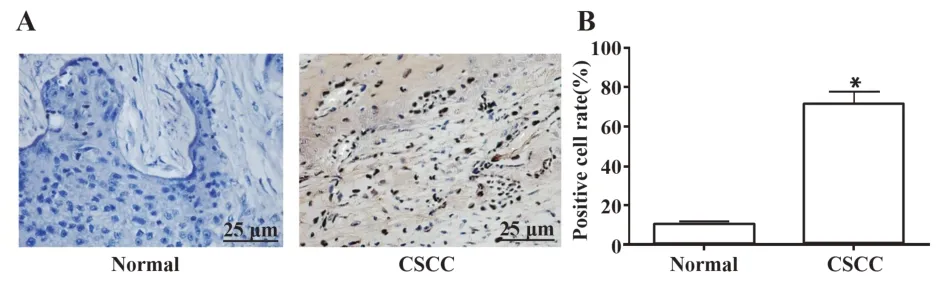
图2 CSCC组织中TSPAN1表达增强Fig.2 TSPAN1 expression was up-regulated in CSCC tissue
2.3 TSPAN1为miR-194-5p的靶基因生物学预测网站Targetscan及microRNA org发现miR-194-5p、miR-27a、miR-27b为TSPAN1的共有靶miRNA(图3A),检测Normal组织及CSCC组织中miR-194-5p、miR-27a、miR-27b的表达发现miR-194-5p在CSCC组织中表达降低最明显(图3B),表明miR-194-5p可能在CSCC进展中扮演重要角色,因此选择miR-194-5p进行后续研究,通过双荧光素酶报告实验证实了miR-194-5p和TSPAN1之间的靶向关系(图3C)。

图3 miR-194-5p在CSCC组织中表达降低且TSPAN1为miR-194-5p的靶基因Fig.3 miR-194-5p expression was down-regulated in CSCC tissue and TSPAN1 is a target of miR-194-5p
2.4 激活miR-194-5p或抑制TSPAN1的表达抑制上皮间质转化检测各组细胞miR-194-5p、TSPAN1以及上皮间质转化相关因子的表达,结果表明,相对于Blank组,激活miR-194-5p或沉默TSPAN1能够上调E-cadherin的mRNA和蛋白表达,下调Vimentin及N-cadherin的mRNA和蛋白表达(均P<0.05)。抑制miR-194-5p则会上调Vimentin及N-cadherin的mRNA和蛋白 表 达,下调E-cadherin的mRNA和蛋白表达(均P<0.05)。NC组和Blank组各指标差异无统计学意义(均P>0.05)。见图4。提示干预miR-194-5p或TSPAN1的表达能够影响CSCC细胞的上皮间质转化。
2.5 激活miR-194-5p或抑制TSPAN1的表达抑制A431细胞增殖活力qRT-PCR、Western blot及MTT检测结果显示,相对于Normal组,其余组中Bax表达降低,Bcl-2表达增高,细胞增殖活力增强(均P<0.05)。相对于Blank组,激活miR-194-5p表达或沉默TSPAN1能够促进Bax表达,抑制Bcl-2表达,抑制细胞活力的增强,且miR-194-5p agomir+shRNATSPAN1组效果更明显(均P<0.05)。抑制miR-194-5p表达则相反(均P<0.05)。NC组和Blank组各指标差异无统计学意义(均P>0.05)。见图5。提示干预miR-194-5p或TSPAN1表达能够影响A431细胞增殖活力,并影响凋亡相关因子表达。
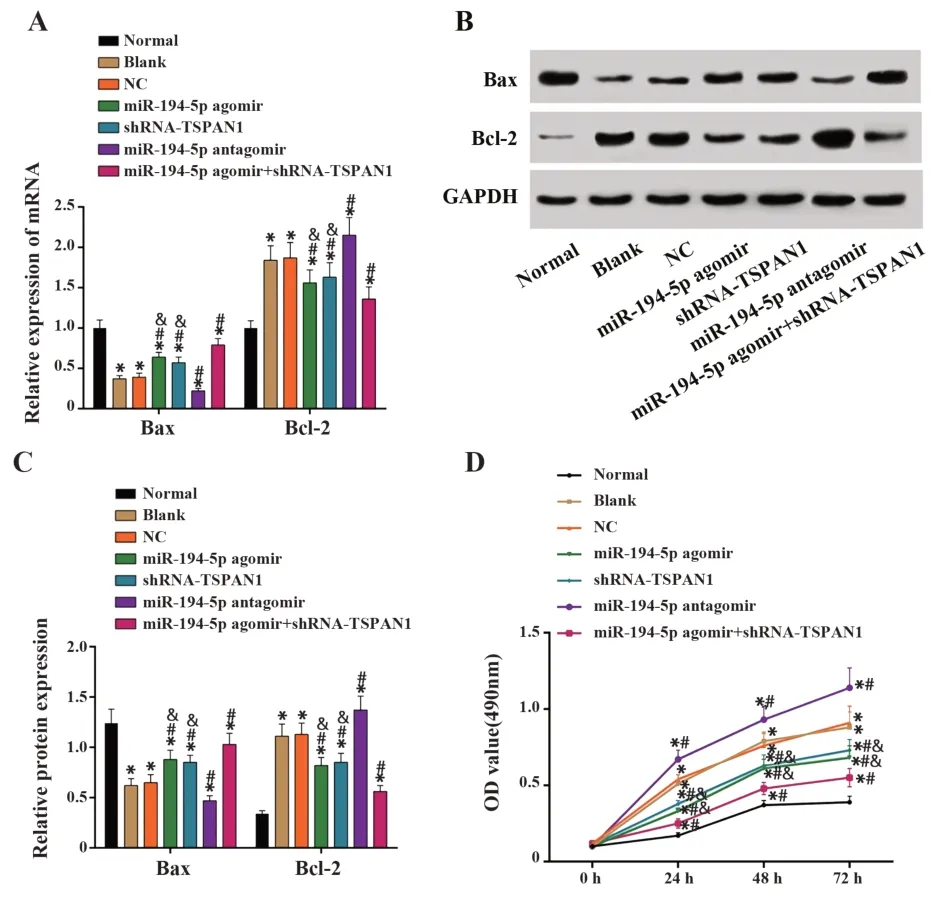
图5 各组细胞Bax、Bcl-2表达及增殖活力检测结果Fig.5 Results of expressions of Bax,Bcl-2 and prolifera⁃tion activity
2.6 激活miR-194-5p或抑制TSPAN1的表达抑制A431细胞侵袭Transwell侵袭实验检测各组细胞侵袭过膜情况,结果显示,相对于Normal组,其余各组细胞侵袭能力显著增强(均P<0.05)。相对于Blank组,激活miR-194-5p表达或抑制TSPAN1表达能够抑制细胞增殖侵袭过膜的数量,且二者联合作用效果更明显(均P<0.05)。抑制miR-194-5p表达能够促进细胞侵袭(均P<0.05),NC组和Blank组差异无统计学意义(P>0.05)。见图6。提示干预miR-194-5p或TSPAN1的表达能够调控A431细胞的侵袭。
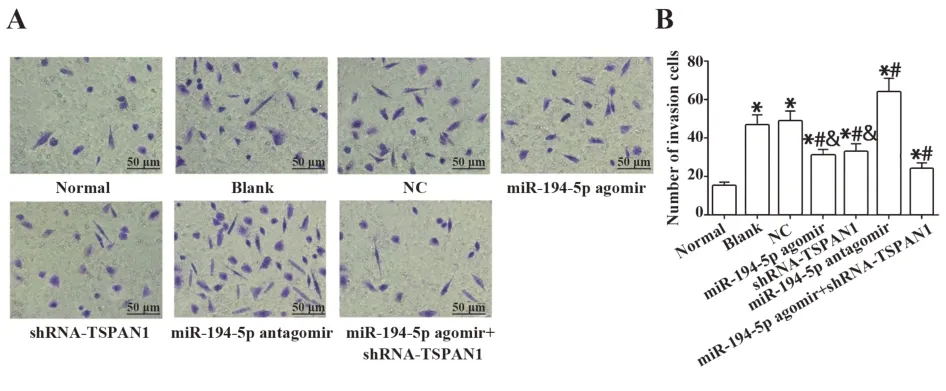
图6 过表达miR-194-5p或抑制TSPAN1能够抑制A431细胞侵袭Fig.6 Overexpression of miR-194-5p or inhibition of TSPAN1 could inhibit invasion of A431 cells
2.7 激活miR-194-5p或抑制TSPAN1的表达促进A431细胞凋亡Annexin V-FITC/PI双标染色法检测结果显示,与Normal组相比,其他各组细胞凋亡率明显降低(P<0.05)。相对于Blank组,激活miR-194-5p表达或抑制TSPAN1表达能够促进细胞凋亡,且联合作用效果更明显(均P<0.05)。抑制miR-194-5p表达能够抑制细胞凋亡(均P<0.05)。NC组和Blank组差异无统计学意义(P>0.05)。见图7。提示干预miR-194-5p或TSPAN1表达能够影响A431细胞的凋亡。
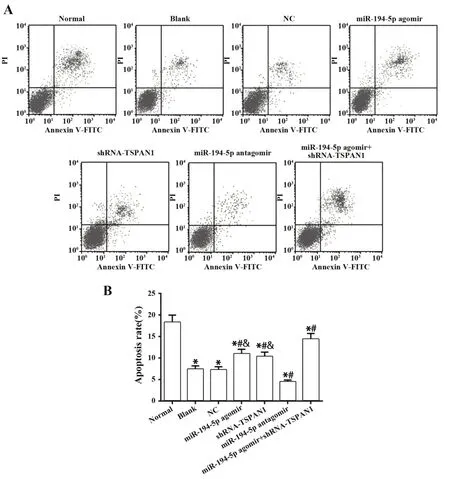
图7 过表达miR-194-5p或抑制TSPAN1能够诱导A431细胞凋亡Fig.7 Overexpression of miR-194-5p or inhibition of TSPAN1 could induce apoptosis of A431 cells
3 讨论
CSCC是一种常见的皮肤癌,在阳光照射下表现为鳞状、红色或出血性病变,紫外线照射、皮肤白皙和免疫抑制均是其发病原因,侵袭性CSCC以高发病率和高死亡率为特征[11-12]。miRNAs是一种内源性、非编码的微小RNA,长度为19~25个核苷酸,参与转录后的基因表达调控,miRNA的表达在宫颈癌、肺癌、胃癌等多种癌症中发挥重要作用[13-16]。其可通过调节一个或多个靶基因发挥肿瘤抑制或促进作用[17-18]。
目前已有大量关于miRNA影响CSCC的研究,例如LOHCHAROENKAL等[19]发现miR-203通过靶向调节c-myc的表达在CSCC中起抑癌作用;XU等[20]发现miR-125b通过靶向调节MMP13对CSCC起抑制作用。而作为常见的抑癌miRNA,miR-194-5p以往也被证实在多种肿瘤中发挥抑癌miRNA的作用,但目前未见miR-194-5p影响CSCC的报道[5-9]。本研究通过检测CSCC组织中miR-194-5p的表达,发现其在CSCC中表达下调。miRNA通常会与靶基因结合,抑制基因转录或促进mRNA降解,进而参与多种疾病的进展,这一现象也被称为RNAi[21]。本研究希望进一步明确miR-194-5p可能参与CSCC进展的机制并发现其与TSPAN1存在靶向结合位点。
据报道,TSPAN1可加速多种癌症的进展,特别是胃癌、结肠癌等消化系统恶性肿瘤,但关于TSPAN1对CSCC的影响目前未见报道[22-23]。通常TSPAN1在癌症组织中表达上调,促进癌细胞的生长、迁移和侵袭,抑制其表达则会抑制癌细胞的恶性进展[24]。与既往研究结果一致,本研究通过免疫组织化学实验发现TSPAN1在CSCC组织中的阳性表达显著上调,并且确定了miR-194-5p与TSPAN1之间的靶向关系;之后又通过一系列实验发现,上调miR-194-5p或下调TSPAN1表达能够抑制CSCC细胞的增殖、侵袭,加速细胞凋亡,且将miR-194-5p过表达和TSPAN1沉默联合作用效果更加明显。除检测各组细胞的生物学行为变化外,本研究还检测了各组细胞中凋亡及EMT相关因子的表达,以期明确影响细胞生物学行为变化的原因。结果表明,过表达miR-194-5p或沉默TSPAN1的表达能够促进Bax、抑制Bcl-2,并改善EMT相关因子变化情况,这也进一步证实了miR-194-5p/TSPAN1在CSCC中的作用。
综上所述,miR-194-5p通过靶向调控TSPAN1基因抑制A431细胞的EMT、增殖、侵袭,促进细胞凋亡,这将为CSCC的诊断和治疗提供一定的参考。但本研究也存在一定的局限性:本研究仅探讨了体外miR-194-5p/TSPAN1如何影响CSCC的进展,未进行相关的体内实验,这也是课题组后期要进一步完善的地方。

