骨髓间充质干细胞通过调控miR-142-3p保护LPS诱导大鼠肺上皮细胞RLE-6TN的炎症损伤与凋亡①
邹丽绢 李磊 肖政 许美霞 许涛
(武汉市第四医院,华中科技大学同济医学院附属普爱医院,武汉430033)
急性肺损伤(acute lung injury,ALI)/急性呼吸窘迫综合征(acute respiratory distress syndrome,AR‐DS)是一种以肺部炎症迅速发作为特征的呼吸衰竭,是常见的临床急症[1]。ALI/ARDS的临床特征主要有肺泡毛细血管屏障损伤、白细胞聚集、肺水肿、炎症和肺泡出血等[2-3]。ALI/ARDS的发病率和死亡率都很高,虽然对这些疾病的病理生理学有较为深入的了解,但仍无有效药物用于提高ALI/ARDS患者的生存率,而抑制肺部剧烈的炎症反应是防治ALI/ARDS的潜在策略[4]。
间充质干细胞(mesenchymal stem cell,MSC)具有自我更新、分化和分泌细胞因子等功能,研究发现骨髓、脂肪、肺组织MSC移植可减轻脂多糖(lipo‐polysaccharide,LPS)诱导的ARDS大鼠肺损伤,改善肺功能,且骨髓、脂肪、肺组织MSC与LPS诱导的巨噬细胞共培养,可调节巨噬细胞分泌细胞因子[5]。研究发现,骨髓间充质干细胞(bone marrow mesen‐chymal stem cells,BMSCs)移植处理ALI大鼠后,多种miRNA的表达出现异常,其中miR-142-3p表达水平显著低于ALI模型组[6]。但BMSCs调控miR-142-3p在ALI/ARDS中的具体作用尚未明确,本研究采用LPS诱导大鼠肺上皮细胞RLE-6TN制备肺上皮细胞损伤模型,与不同比例BMSCs共培养,检测细胞炎症因子及凋亡水平,以期为BMSCs治疗ALI/ARDS提供一定的理论基础。
1 材料与方法
1.1 材料大鼠肺上皮细胞RLE-6TN来源于美国ATCC细胞库;大鼠BMSCs来源于中国科学院细胞库。RPMI1640、DMEM/F12购自美国Hyclone;胎牛血清购自美国Gibco;LPS购自上海阿拉丁生化科技股份有限公司;TRIzol购自美国Ambion;反转录试剂盒购自宝生物工程(大连)有限公司;抗荧光衰减封片剂(含DAPI)、封闭液、Triton X-100、RIPA裂解液、BCA蛋白浓度测定试剂盒购自北京索莱宝科技有限公司;PVDF膜和化学发光试剂购自美国Milli‐pore;兔抗鼠NF-κB p65抗体、山羊抗兔二抗(免疫组化)、兔抗鼠Bcl-2抗体、兔抗鼠caspase-3抗体、兔抗鼠GAPDH、山羊抗兔IgG购自武汉贝茵莱生物科技有限公司。
1.2 方法
1.2.1 细胞培养将冻存的RLE-6TN细胞从液氮罐中取出,37℃水浴至冻存液溶解,将细胞悬液转移至离心管,400 g离心3 min。弃上清,加入1 ml培养液重悬细胞沉淀,将细胞悬液转移至培养瓶中,加入4 ml含10%胎牛血清的RPMI1640,于37℃、5%CO2培养箱内培养。大鼠BMSCs采用DMEM/F12,于37℃、5%CO2培养箱内培养。
1.2.2 CCK8法筛选LPS诱导时间及浓度收集对数期的RLE-6TN细胞,调整细胞密度并分布于96孔板中,每孔180 μl,约5×103个细胞。培养至细胞贴壁,分别加入0.5、1.0、1.5、2.0 μg/ml LPS干预细胞,继续培养12 h、24 h、48 h。每孔加入10 μl CCK8溶液,继续培养4 h,在酶标仪上检测450 nm处吸光值。
1.2.3 qPCR检测细胞miR-142-3p表达水平TRIzol裂解细胞,提取RNA,反转录合成cDNA,进行实时荧光定量PCR扩增,miR-142-3p引物合成由武汉天一辉远生物科技有限公司完成,引物序列:miR-142-3p-F 5'-GGGTGTAGTGTTTCCTAC-3',miR-142-3p-R 5'-AACTGGTGTCGTGGAGTCGGC-3';U6-F 5'-CTCGCTTCGGCAGCACATATACT-3',U6-R 5'-ACGCTTCACGAATTTGCGTGTC-3'。反 应 程 序:95℃3 min;95℃5 s;56℃10 s;72℃25 s;40个循环。以2-∆∆Ct法计算miR-142-3p相对表达量。
1.2.4 实验分组与共培养处理将RLE-6TN细胞分为6组:对照组、LPS组、BMSCs培养液(DMEM/F12)组、RLE-6TN+BMSCs 1组(RLE-6TN∶BMSCs=10∶2)、RLE-6TN+BMSCs 2组(RLE-6TN∶BMSCs=10∶3)和RLE-6TN+BMSCs 3组(RLE-6TN∶BMSCs=10∶4)。RLE-6TN+BMSCs组均将RLE-6TN与BM‐SCs共培养,具体步骤如下:收集经2 μg/ml LPS处理48 h后的RLE-6TN细胞,更换为新鲜RPMI1640培养基,分布于6孔Transwell小室下层,每孔2 ml,约3×105个细胞。Transwell小室上层分别加入相应比例BMSCs,共培养24 h后,取出下室中的RLE-6TN细胞进行实验检测。
1.2.5 流式检测细胞凋亡收集1.2.4中的各组RLE-6TN细胞,取约1×106个细胞,400 g离心5 min,弃上清液。向细胞沉淀中加入1 ml预冷PBS,混匀,400 g离心5 min,弃上清液。加入200 μl预冷PBS重悬细胞沉淀,依此加入10 μl Annexin V-FITC和10 μl PI,混匀,避光孵育30 min。流式细胞仪上机检测各组细胞凋亡水平。
1.2.6 qPCR检测细胞miR-142-3p、IL-6及TNF-α mRNA表达水平收集1.2.4中的各组RLE-6TN细胞,实验操作同1.2.3节,引物如下:IL-6-F 5'-CCTTCTTGGGACTGATGT-3',IL-6-R 5'-ACTGGTCTGTTGTGGGTG-3';TNF-α-F 5'-CCACGCTCTTCTGTCTACTG-3',TNF-α-R 5'-GCTACGGGCTTGTCACTC-3'。
1.2.7 Western blot检测细胞Bcl-2和caspase-3蛋白表达水平收集1.2.4中的各组RLE-6TN细胞,约1×106个细胞,加入200 μl RIPA裂解液于4℃裂解细胞,提取细胞总蛋白。BCA蛋白浓度测定试剂盒测定所提蛋白浓度,取20 μg蛋白进行SDS-PAGE分离。将蛋白转移至PVDF膜,封闭2 h后,加入一抗(Bcl-2、caspase-3、GAPDH,稀释比1∶1 000)孵育1 h,洗膜,二抗(稀释比1∶20 000)孵育1 h。加入化学发光试剂,曝光显影,记录灰度值计算蛋白相对表达量。
1.3 统计学处理所有检测均进行3次重复,采用SPSS23.0软件进行统计分析,计量资料采用±s表示。多组间比较采用单因素方差分析,两两比较采用SNK检验,以P<0.05表示差异具有统计学意义。
2 结果
2.1 LPS诱导时间及浓度筛选结果结果显示,随着LPS诱导时间延长及浓度的升高,对RLE-6TN细胞增殖活性的抑制作用越明显,见图1。因此,基于本研究检测的时间点和浓度中,选择对细胞损伤最为明显的2 μg/ml LPS处理48 h作为后续实验中LPS的处理浓度与时间。
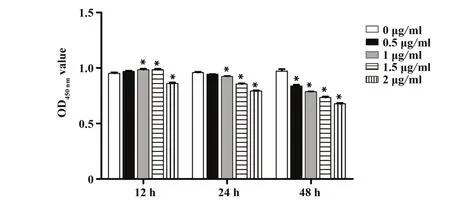
图1 CCK8检测RLE-6TN细胞增殖活性Fig.1 Proliferation activity of RLE-6TN cells was detected by CCK8
2.2 LPS诱导对RLE-6TN细胞miR-142-3p表达的影响结果显示,与对照组比较,LPS诱导组RLE-6TN细胞中miR-142-3p表达水平显著升高(P<0.05),见图2。
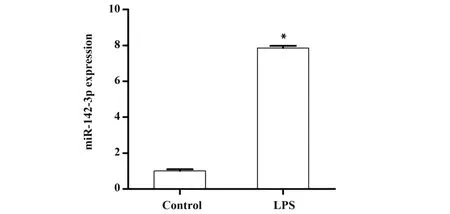
图2 qPCR检测RLE-6TN细胞中miR-142-3p表达水平Fig.2 Expression level of miR-142-3p in RLE-6TN cells was detected by qPCR
2.3 BMSCs共培养抑制RLE-6TN细胞凋亡结果显示,与对照组比较,LPS组RLE-6TN细胞凋亡率显著升高(P<0.05)。与LPS组比较,BMSCs培养液组细胞凋亡率差异无统计学意义(P>0.05),而BMSCs共培养组的RLE-6TN细胞凋亡率显著降低(P<0.05),且随着共培养BMSCs比例的增加,细胞凋亡率逐渐降低(P<0.05)。见图3。

图3 流式检测RLE-6TN细胞凋亡Fig.3 Apoptosis of RLE-6TN cells was detected by flow cytometry
2.4 BMSCs共培养抑制RLE-6TN细胞miR-142-3p、IL-6及TNF-α mRNA的表达结果显示,与对照组比较,LPS组RLE-6TN细胞miR-142-3p、IL-6及TNF-α mRNA表达水平均显著升高(P<0.05)。与LPS组比较,BMSCs培养液组细胞miR-142-3p、IL-6及TNF-α mRNA表达水平差异无统计学意义(P>0.05),而BMSCs共 培 养组 的RLE-6TN细胞miR-142-3p、IL-6及TNF-α mRNA表达水平均显著降低(P<0.05),且随着共培养BMSCs比例的增加,表达水平逐渐降低(P<0.05)。见图4。
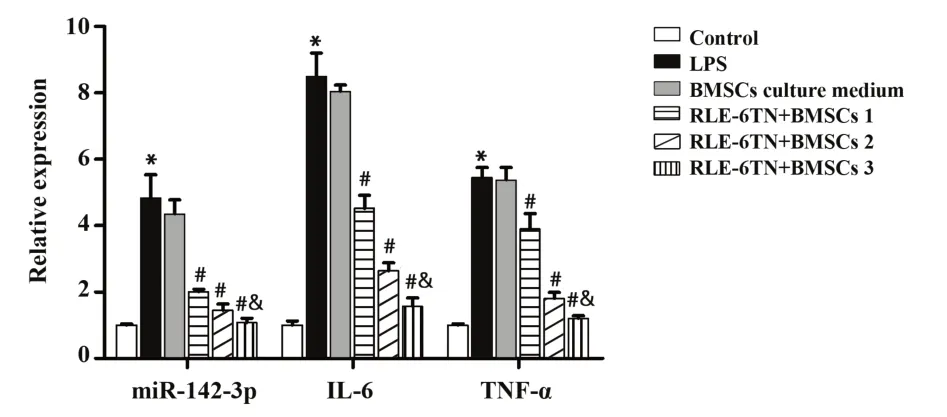
图4 qPCR检 测RLE-6TN细 胞 中miR-142-3p、IL-6及TNF-α mRNA表达水平Fig.4 Expression levels of miR-142-3p,IL-6 and TNF-α mRNA were detected by qPCR
2.5 BMSCs共培养影响RLE-6TN细胞Bcl-2和cas‐pase-3蛋白表达水平结果显示,与对照组比较,LPS组RLE-6TN细胞Bcl-2蛋白表达水平显著降低(P<0.05),caspase-3蛋白表达水平显著升高(P<0.05)。与LPS组比较,BMSCs培养液组细胞Bcl-2和caspase-3蛋白表达水平差异无统计学意义(P>0.05),而BMSCs共培养组的RLE-6TN细胞Bcl-2蛋白表达水平显著升高(P<0.05),caspase-3蛋白表达水平显著降低(P<0.05),且随着共培养BMSCs比例的增加,Bcl-2和caspase-3蛋白表达变化越显著(P<0.05)。见图5。
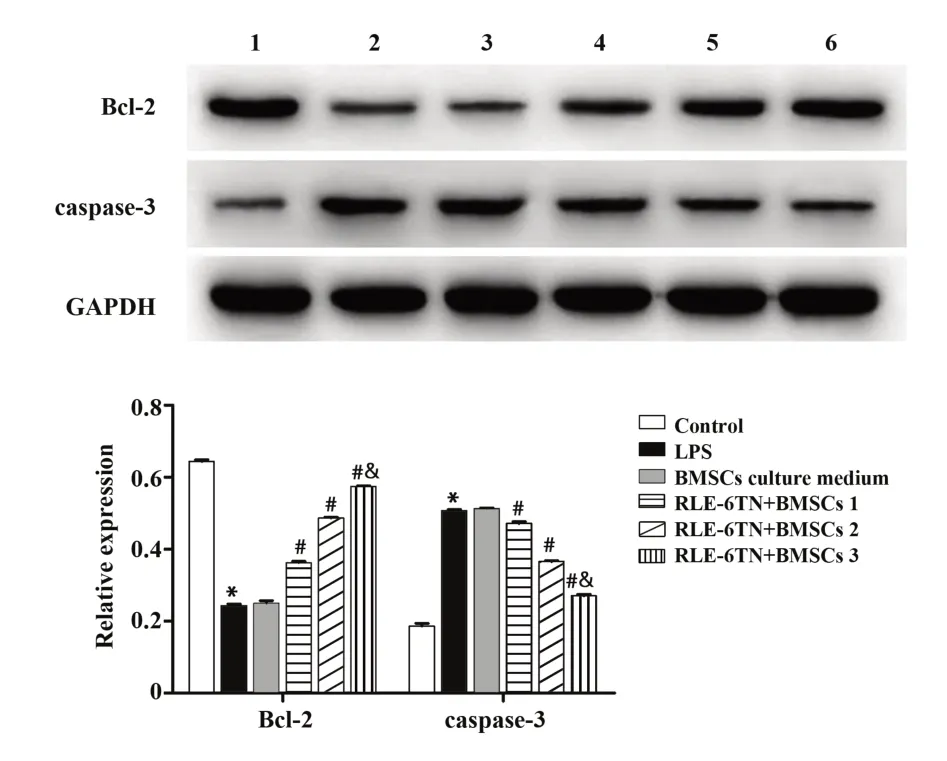
图5 Western blot检测RLE-6TN细胞Bcl-2和caspase-3蛋白表达水平Fig.5 Protein expression levels of Bcl-2 and caspase-3 were detected by Western blot
3 讨论
ALI/ARDS属于高度难治性疾病,其在肺上皮细胞中的复杂病理机制尚不完全明确。内皮细胞功能障碍和炎症因子的过度释放是肺泡毛细血管膜损伤的关键,而肺泡毛细血管膜损伤则是内毒素性肺损伤的典型特征[7]。LPS可直接或间接引起ALI/ARDS,常用于体内外复制ALI/ARDS模型[8]。肺内炎症细胞失控性地释放炎症因子,是引发ALI的根本原因[9]。ALI/ARDS患者血清中促炎细胞因子IL-1β、IL-6和TNF-α水平显著高于健康人群,采用LPS诱导小鼠和A549细胞,也可检测到高表达的促炎细胞因子[10]。miRNA参与了多种细胞生理病理过程的调节,包括内皮细胞损伤和炎症反应。研究发现,LPS诱导人肺微血管内皮细胞HPMECs,可介导miR-92a表达上调,而抑制miR-92a可改善内皮细胞功能障碍,减少促炎因子IL-6和TNF-α的释放[11]。miR-142因其在调节免疫应答方面的典型作用而受到广泛关注[12],本研究采用LPS诱导大鼠肺上皮细胞RLE-6TN,发现细胞中miR-142-3p表达上调,提示miR-142-3p异常表达可能与ALI/ARDS的发生发展存在一定联系。
目前,对于ALI/ARDS尚无有效的特异性治疗方法,而MSC在ALI/ARDS患者中具有良好的治疗潜力,基础研究结果也显示BMSCs对LPS诱导的ALI可发挥较好的保护作用[13]。各类MSC治疗ALI/ARDS的效果以及作用机制不尽相同,其作用机制大致可分为两大类:一是直接通过迁移归巢和定向分化在损伤部位发挥作用;二是通过旁分泌方式调节细胞炎症因子水平,发挥免疫调节作用[14]。LPS诱导ALI大鼠,导致部分miRNA(包括miR-142-3p)表达异常,在BMSCs治疗后,miRNA表达得到恢复,而失调的miRNA参与了BMSCs介导的免疫调节过程[6]。miR-142-3p为MSCs通过旁分泌信号调节免疫应答的关键性miRNA之一[15]。本研究结果显示,经BMSCs共培养处理的RLE-6TN细胞中,LPS诱导致使表达上调的miR-142-3p、促炎因子IL-6和TNF-α均表达减少,提示BMSCs可能通过抑制miR-142-3p表达缓解RLE-6TN细胞炎症反应。
肺上皮细胞凋亡可加速ALI/ARDS进展,是ALI/ARDS患者死亡的主要原因之一,LPS诱导肺泡上皮细胞可诱导炎症反应与细胞凋亡[16]。对肺上皮细胞凋亡途径进行调控,减少细胞凋亡,是ALI/ARDS治疗的主要方向之一[17]。研究发现,miR-142-3p对肿瘤细胞、血管内皮细胞凋亡均具有调控作用[18-19]。本研究结果显示,LPS诱导RLE-6TN细胞后,细胞凋亡率显著升高,抗凋亡蛋白Bcl-2表达降低,而凋亡执行因子caspase-3表达升高,经过BMSCs共培养的RLE-6TN细胞,凋亡率下降,Bcl-2表达升高,caspase-3表达降低,且共培养的BMSCs比例越高,效果越明显。
综上所述,LPS诱导大鼠肺上皮细胞RLE-6TN,可介导miR-142-3p、细胞促炎因子表达升高,细胞凋亡增加,而RLE-6TN细胞与BMSCs共培养后,缓解炎症反应,减少细胞凋亡,其作用机制可能与抑制miR-142-3p的表达有关。