系统性红斑狼疮诱导多能干细胞差异蛋白图谱的鉴定与调控网络分析①
秦娟 何慧燕 梁灼健 赵鑫 蔡晚霞 廖秋燕 叶梅 戴勇汤 冬娥
(深圳市人民医院(暨南大学第二临床医学院,南方科技大学第一附属医院)临床医学研究中心,广东省自身免疫性疾病工程研究中心,深圳518020)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是自身炎症性免疫性结缔组织疾病,发生群体以青年女性为主,可累及多种脏器,患者体内形成的大量自身抗体可结合体内抗原生成免疫复合物沉积于机体诸多部位,包括肾小球、血管、关节与皮肤等,受补体刺激可导致组织坏死与急慢性炎症,抗体同时可与组织细胞抗原直接反应导致细胞受损,引发机体多系统损伤,但其潜在病因尚未阐明。SLE尚无有效治疗方法,其治疗往往长期广泛采用免疫抑制剂[1]。为阐明SLE发病机制,本研究对SLE患者蛋白质组进行分析,以确定SLE患者和健康志愿者蛋白表达差异。
诱导多能干细胞(induced pluripotent stem cells,iPSCs)是将特定转录因子导入体细胞后产生的具有无限增殖能力和多向分化潜能的细胞,iPSCs可从患者自身体细胞直接诱导获得,保留疾病基因组遗传信息,并在体外模拟疾病进程和表型。因此,采用iPSCs构建的疾病模型在疾病病理机制探究方面具有应用价值,同时可作为细胞模型筛选药物靶点[2]。本研究从SLE患者及健康对照者尿液中成功诱导出iPSCs并对其进行蛋白质组学鉴定。
同重同位素相对与绝对定量(isobaric tags for relative and absolute quantitation,iTRAQ)技术是能够于一次实验中开展多个样品(≤8个)的蛋白质组定量技术,其应用范围基本包括所有蛋白样品,具备高定量精度优势,在蛋白质组学定量领域应用广泛,本研究采用iTRAQ技术鉴定SLE患者的差异表达蛋白。
1 资料与方法
1.1 资料
1.1.1 研究对象根据美国风湿学院(ACR)修订的SLE标准和系统性红斑狼疮指数(SLE disease activity index,SLEDAI)2000,实验组选取诊断为活动性SLE,并排除3个月内使用免疫抑制剂治疗的患者[3-4]。对照组选取每年进行身体检查的健康志愿者。所有参与者知情同意,并经临床伦理委员会批准。
1.1.2 仪器与试剂LTQ-or bitrapX L-htcpalparagnms4系统(北京基因组学研究所,生政,中国);范式MS4高效液相色谱泵(michrom Bioresources Inc.,Auburn,Ca,USA);HTC-Pal自动采样器(CTC‐Analytics,Zwingen,瑞士);C18分析柱(内径75 μm,15 cm;L-柱,CERI,Auburn,CA);LTQ-轨道射线谱仪(热费舍尔科学,不来梅,德国);IPI_human v3.87数据库。
1.2 方法
1.2.1 细胞收集和培养收集实验组患者中段尿50 ml,立即置于4℃保存,并于24 h内处理,建立SLE-iPSCs组和对照组iPSCs(NC-iPSCs)并进行鉴定[5]。实验组、对照组各1例。
1.2.2 蛋白定量提取实验组、对照组总蛋白,进行还原烷基化处理、浓度测定、电泳、酶解、iTRAQ标记及标记后肽段等量混合等,对其进行预分离及液相串联质谱分析。①蛋白提取:称取适量样品,1 ml PBS洗脱至少30 s,25 000 g离心20 min(4℃),弃上清,重复以上操作,加入500 μl lysis3溶解,分别添加1 mmol/L PMSF、2 mmol/L EDTA反应5 min,添加DTT至10 mmol/L,200 Watts超声裂解15 min,25 000 g离心20 min,保留上清,10 mmol/L DTT处理1 h(56℃),还原打开二硫键。55 mmol/L IAM处理45 min(暗室中),进行半胱氨酸烷基化封闭。加入1 ml冷冻丙酮,-20℃放置过夜。25 000 g离心20 min,弃上清,沉淀在300 μl 0.5 mmol/L TEAB中200 Watts超声裂解15 min。25 000 g离心20 min,取上清用于定量;②还原烷基化处理,打开二硫键以充分酶解蛋白;③2D quant kit法进行蛋白浓度测定;④等体积进行SDS电泳;⑤酶解蛋白;⑥iTRAQ试剂标记肽段:胰蛋白酶消化,真空离心泵抽干肽段,0.5 mmol/L TEAB复溶肽段,按照手册进行iTRAQ标记,每组肽段被不同iTRAQ标签标记,室温培养2 h,将标记后的各组肽段混合,SCX柱进行液相分离;⑦将标记后的肽段等量混合;⑧混合后的肽段采用强阳离子交换色谱(strong cation ex‐change choematography,SCX)进行预分离;⑨进行液相串联质谱(liquid chromatography coupled with tan‐dem mass spectrometry,LC-MS/MS)分析。
1.3 数据分析质谱扫描结果采用吉祥物服务器2.3.02版与api_humanv3.87数据库中的数据进行比较。
2 结果
2.1 采 用iTRAQ技 术对SLE-iPSCs和NC-iPSCs进行比较蛋白质组检测共获得7 415个高质量肽,对2 305个蛋白进行鉴定与量化,通过皆为1.5倍差异的上调蛋白、下调蛋白定义一类蛋白作为不同表达蛋白,发现SLE-iPSCs与NC-iPSCs双方差异表达的蛋白共88种,丰度提高26种,SLE-iPSCs库内丰度下降的62种,蛋白丰度差异倍数>1.5倍,同时P<0.05,可判定为差异蛋白(表1、2)。差异蛋白数统计情况见图1A。在相对定量方面,若2样本在同一蛋白量方面未见显著改变,则其蛋白丰度比趋于1。若蛋白丰度比≥1.5倍,同时P<0.05,可将此蛋白视为差异蛋白,显示以各蛋白差异倍数底数为2时所取对数值相应分布状况(图1B)。

表1 蛋白质谱鉴定结果Tab.1 Results of identified proteomic profiling

表2 蛋白定量统计Tab.2 Protein quantification statistics
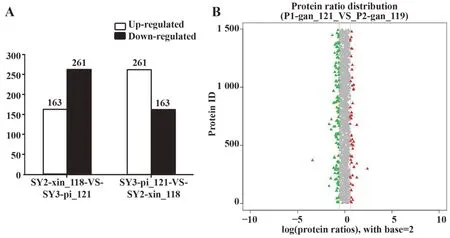
图1 差异蛋白数与蛋白丰度分布Fig.1 Differential expression proteins number and pro⁃tein abundance distribution
2.2 SLE-iPSCs样本差异蛋白差异蛋白定量分析结果显示,共筛选出10个在SLE-iPSCs蛋白谱中表达显著上调的差异蛋白(表3)及10个显著下调的差异蛋白(表4)。
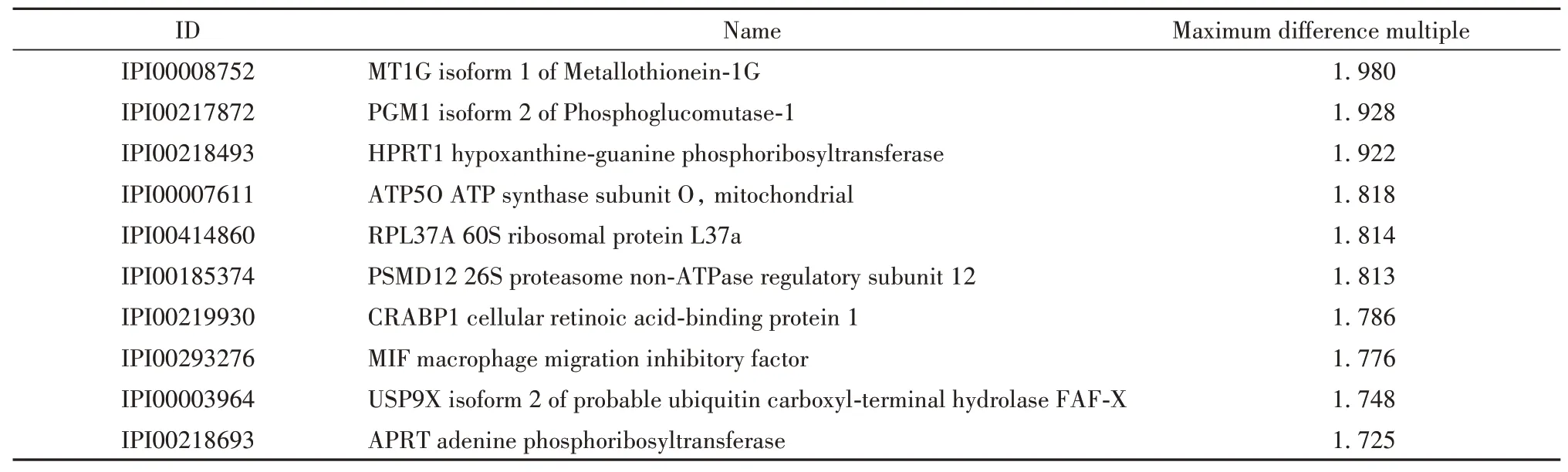
表3 SLE-iPSCs样本上调蛋白Tab.3 Up-regulated proteins of SLE-iPSCs
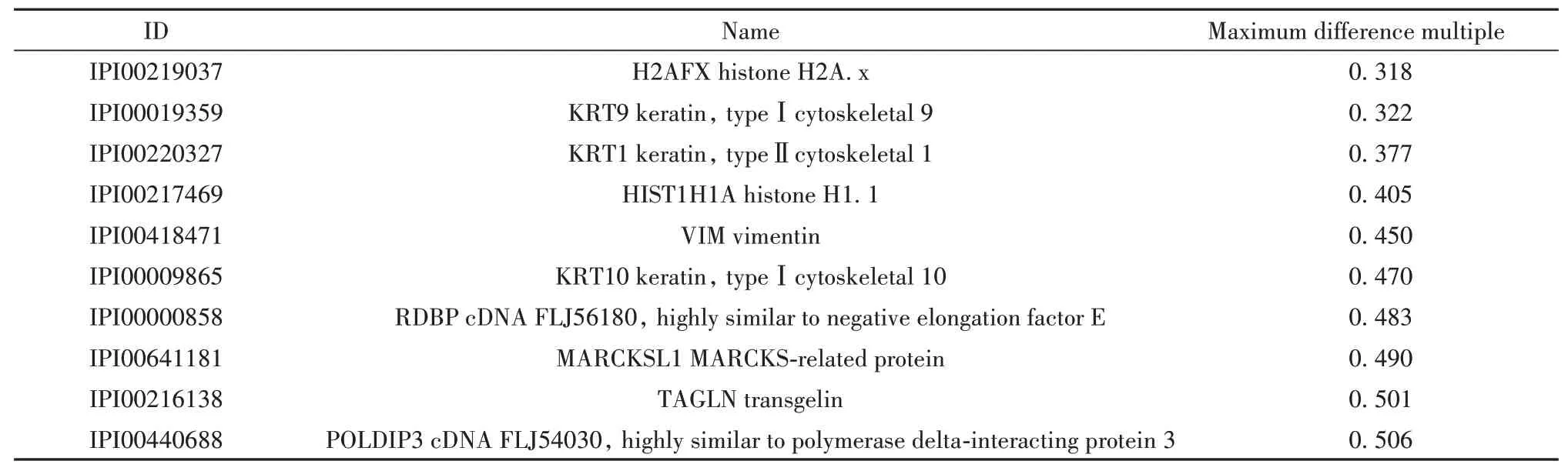
表4 SLE-iPSCs样本下调蛋白Tab.4 Down-regulated proteins of SLE-iPSCs
2.3 差异蛋白质GO分析为深入探究此类蛋白的分子机能与生物过程,对检测确定的差异蛋白开展了GO富集分析,对生物体内基因与基因产物属性做出全面描述,结果显示,GO分析共含3个本体,分别为分子功能、生物过程、所处位置(图2)。富集量最大的蛋白分子功能、细胞组成、生物过程见表5,分子功能方面,蛋白结合(55.69%)、催化活性(26.87%)及结构分子活性(3.67%)占比较大。细胞组成方面,富集量最大的几种蛋白分别位于细胞(23.98%)、细 胞 部 分(23.98%)及 细 胞 器(20.27%)。生物过程方面,细胞过程(16.63%)、生物代谢过程(13.97%)及生物调节过程(7.93%)占比较大。

表5 富集量最大的几种蛋白分子功能、细胞组成、生物过程(%)Tab.5 Molecular function,cellular component and biological process of most concentration proteins(%)
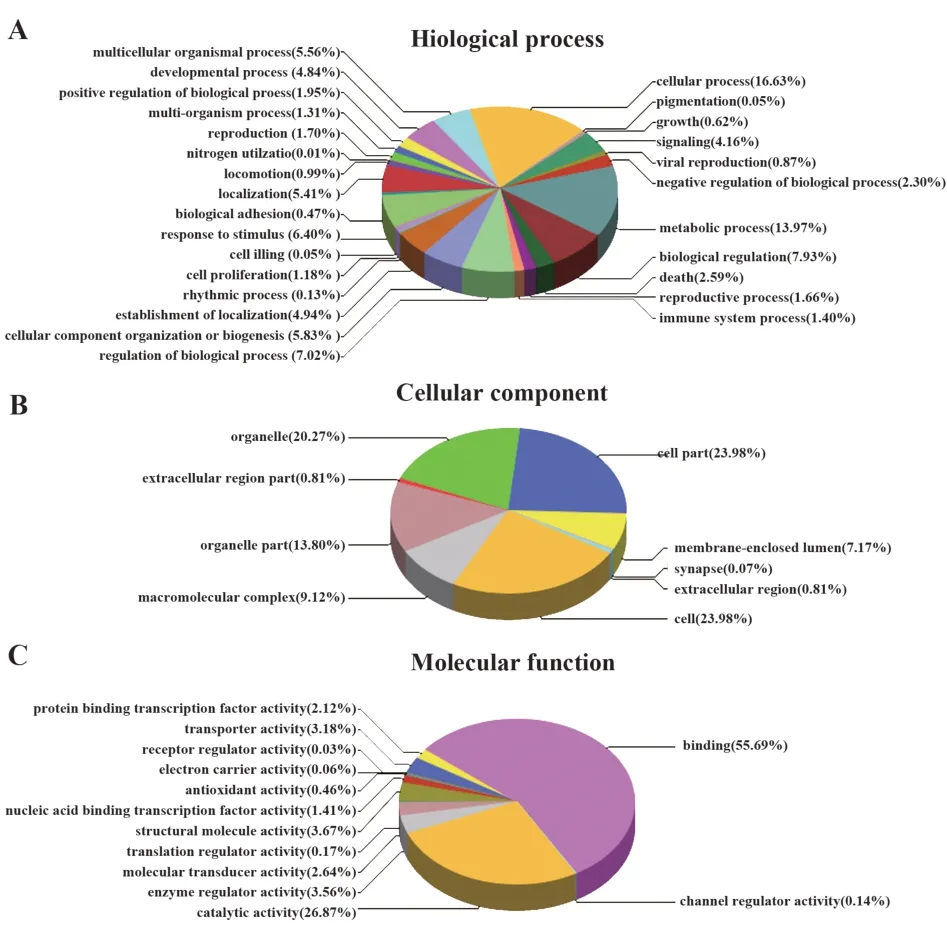
图2 差异表达蛋白GO分析Fig.2 GO analysis of differential expression proteins
2.4 差异蛋白KEGG通路富集KEGG是连接已知分子间相互作用的信息网络,如代谢通路、复合物、生化反应。与NC-iPSCs相比,SLE-iPSCs差异蛋白KEGG通路富集结果如图3所示。不同颜色代表不同P值,点的大小代表差异蛋白量。
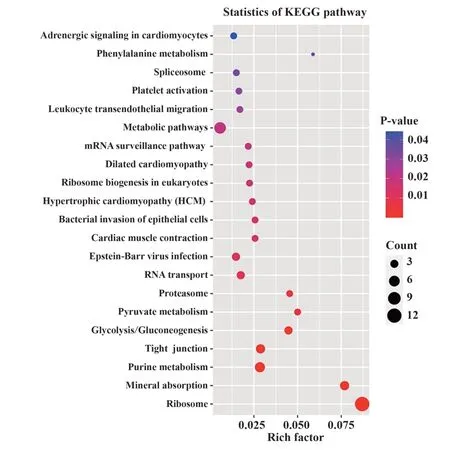
图3 KEGG富集通路Fig.3 KEGG enrichment pathway
3 讨论
iTRAQ技术可于一次实验中开展多个样品(≤8个)蛋白质组定量,其应用范围基本包括所有蛋白样品,具备高定量精度优势,在定量蛋白质组学领域应用日渐广泛。本研究显示,SLE-iPSCs与NC-iPSCs存在多个差异表达蛋白,部分为上调蛋白,如巨噬细胞迁移抑制因子(macrophage migration inhibitory factor,MIF)、金属硫蛋白-1G(metallothionein-1G,MT1G),部分为下调蛋白,如组蛋白H1,部分与SLE患者病情严重程度相关或与自身免疫性疾病病理生理学机制相关。
MIF是首个被发现拥有多效炎症介质活性的因子,同时是一类发挥关键作用的内分泌激素,拥有变位酶及氧化还原酶活性,多种细胞均可合成MIF,如T细胞、B细胞等免疫细胞,以及血管平滑肌细胞(VSMC)、内皮细胞等非免疫细胞。MIF为多功能趋化因子,不仅在细胞内外发挥相应生物学活性,同时可经自分泌与旁分泌途径调节微环境。作为免疫调节细胞因子,MIF结构具备一定独特性,功能类似于趋化因子。自1966年MIF被发现以来,其在固有免疫、炎症反应和免疫细胞招募等方面研究广泛。MIF具有促进细胞定向迁移、增强其他炎症介质释放、提升炎症反应、拮抗糖皮质激素、抑制细胞凋亡等功能,因此与多种炎症性疾病显著相关,包括癌症、自身免疫性疾病、代谢性疾病、动脉粥样硬化等[6-7]。
研究表明,具有高表达MIF等位基因的个体SLE发病率降低,但终末器官并发症患者高表达MIF等位基因频率提高,即MIF对SLE发病具有影响,高表达MIF等位基因降低SLE易感性,可能通过增强自身免疫病原体清除实现[8]。但一旦SLE发展,低表达MIF等位基因保护器官免受炎症损伤,说明MIF对SLE患者免疫发病影响具有双重作用。研究显示,与对照组相比,SLE患者MIF水平显著升高,此结果与本研究结果相似[9]。此外,SLE患者活动期血清MIF含量较静止期显著升高,同时MIF上升程度与SLEDAI显著相关[10]。SLE属于自身免疫性疾病,患者体内T细胞活化与B细胞克隆激活分泌出众多自身抗体。MIF则为前炎症介质,可由机体多种组织细胞生成,SLE患者体内大部分MIF由活化的T细胞与单核巨噬细胞合成。研究证实,采用特异性抗原刺激T细胞,核糖核酸因MIF信使表达上调,蛋白分泌量大幅提高,表明MIF在SLE患者B细胞抗体生成与T细胞活化方面发挥关键作用[11]。本研究显示,SLE患者MIF蛋白高表达,证实MIF与SLE患者病情高度相关。
本研究中,SLE-iPSCs样本MT1G表达明显上调,此蛋白在生物体内大量分布,且内含半胱氨酸,可与多种重金属离子小分子量可溶性蛋白结合,在细胞内具有关键生物功能,维持机体内必需金属离子稳定,抑制重金属离子损伤机体组织器官与机能,清除机体在多种刺激因素作用下或正常代谢下产生的自由基,影响DNA复制、转录及蛋白合成,抑制细胞凋亡。机体应激、细胞因子与损伤等因素均可诱导MT表达[12]。MT可显著抑制机体因T细胞所致的体液免疫反应[13]。炎症产生的细胞因子可通过胞内信号机制促进MT基因表达,与机体在应激状态下MT基因表达升高结果一致,MT表达增多可能是机体为恢复免疫动态平衡、减少炎症损伤的一种反馈性保护机制[14]
本研究中,MT1G表达显著上调,说明在SLE患者自身免疫过程中,机体处于应激状态,产生大量自身抗体,从而大幅度促进MT1G合成,但目前尚未文献报道,但本研究中差异表达的MT1G可能成为SLE的辅助诊断和监测指标。本研究采用iPSCs与iTRAQ技术鉴定SLE-iPSCs、NC-iPSCs间蛋白表达差异,得到SLE-iPSCs显著升高、降低的蛋白,同时针对此类差异蛋白功能开展GO分析发现,MIF与SLE患者发病相关,并与SLE患者疾病活动期状态相关。MT1G则与自身免疫疾病病程相关,多个自身免疫疾病患者体内MT1G高表达,这2种蛋白有望成为SLE患者诊断及病情监测的标志物。