miR-124通过靶向Capn4抑制Wnt/β-catenin信号通路调节胃肠道间质瘤(GIST-T1)细胞生物学功能①
支小飞 陈思俊 华如衡 朱建伟(南通大学附属医院普外科,南通226001)
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是来源于胃肠道间充质干细胞最常见的间叶源性肿瘤,在消化道肿瘤中约占1%~3%,其主要在胃及小肠中发生[1-2]。可发生于各年龄段,绝大多数病例发生于成年人,但在儿童中也有报道,且多为恶性,男女GIST发病率没有明显差异[3-4]。microRNA是一种广泛分布的内源性非编码蛋白质的小RNAs(约为22个核苷酸),其特点是可以结合到mRNA的3'UTR端来发挥其负调控基因表达的作用[5]。现已证实,miRNA与肿瘤的发生发展具有紧密的联系[6]。
研究显示,miRNA在胃肠道间质瘤中同样存在着差异表达,多种miRNA参与胃肠道间质瘤细胞的增殖、侵袭、凋亡等过程,表明miRNA在胃肠道间质瘤形成发展中扮演着重要角色[7-10]。miR-124也是被认可的miRNA家族中的成员之一,已有研究表明,miR-124在肿瘤性疾病、神经发生中表达有明显异常,扮演着重要的调控角色[11-15]。但目前有关miR-124在胃肠道间质瘤中的表达情况及调控作用研究相当少,其具体作用机制仍然是不清楚的。本研究中通过实时荧光定量PCR检测了miR-124在胃肠道间质瘤组织和细胞中的表达,并且进一步探讨了miR-124对于GIST-T1细胞增殖、侵袭、凋亡的影响以及相关的分子机制。
1 资料与方法
1.1 资料
1.1.1 主要试剂细胞培养基DMEM、胎牛血清、胰蛋白酶购自Sigma;Lipofectamine 2000转染试剂和Annexin V-FITC细胞凋亡检测试剂盒购自Invit‐rogen公司;逆转录试剂盒、荧光定量PCR检测试剂盒购自大连宝生物工程有限公司;双荧光素酶报告检测试剂盒购自Promega公司;Capn4-3'UTR和Capn4-3'UTR MUT由擎科生物有限公司设计;miR-124 mimics及NC-mimics、miR-124 inhibitor及NC-in‐hibitor由上海吉玛制药公司设计并合成;CCK-8试剂盒购自上海碧云天生物有限公司;Transwell孔板购自康宁;Capn4(ab93959,兔抗)购自Abcam;β-actin抗体(AA128,鼠抗)购自上海碧云天生物有限公司;胃肠道间质瘤细胞系(GIST-T1),货号为QCB318购自上海钦诚生物科技有限公司。
1.1.2 临床样本选取来自南通大学附属医院胃肠外科实施外科手术切除,符合中国胃肠道间质瘤诊断标准的GIST临床病例30例,依据生长部位分为:胃16例、肠道10例、胃肠外4例;依据肿瘤直径分为:直径≤2 cm 3例,直径2.1~5.0 cm 10例,直径5.1~10.0 cm 13例,直径>10 cm 4例;根据GIST危险度分级分为:极低度危险性肿瘤3例,低度危险性肿瘤8例,中度危险性肿瘤12例,高度危险性肿瘤7例。其中男性17例,女性13例,患者年龄分布在17~58岁,平均年龄(45±10)岁,手术切除标本具有保存完整的肿瘤组织和切缘正常组织,分别选取肿瘤组织及切缘组织标本各30例,组织离体后液氮中进行冻存,并在使用前均经HE染色和免疫组化标记(CD117、CD34、SMA、Desmin4)进行鉴定。
1.2 方法
1.2.1 GIST-T1细胞培养与细胞转染人胃肠道间质瘤细胞系(GIST-T1)使用含有10%FBS的DMEM培养基,在37℃、5%CO2、饱和湿度下培养,每3 d进行1次换液。收集对数生长期的细胞接种于6孔板中,2×105个/孔。采用Lipofectamine 2000试剂根据说明书进行转染。根据实验设计,对细胞进行模拟物mimics和inhibitor处理,模拟物处理的细胞分为3组:空白对照组(NC组)、阴性对照组(mimics-NC组)和miR-124模拟物组(miR-124 mimics组)。In‐hibitor处理的细胞分为3组:空白对照组(NC组)、阴性对照组(inhibitor-NC组)和miR-124抑制剂组(miR-124 inhibitor组)。
1.2.2 实时荧光定量PCR根据TRIzol Reagent使用说明书提取组织及细胞中的总RNA。取100 ng的总RNA为模板,按照逆转录试剂盒使用说明书获得cDNA。取cDNA和引物,按照实时荧光定量PCR检测试剂盒说明书配制PCR反应体系,反应条件为:95℃预变性30 s,40个循环扩增反应(95℃5 s,60℃20 s)。U6为miR-124的内参,采用2-ΔΔCt法计算miR-124的 相 对 表 达。miR-124 F:5'-GAGAATTCGCACGCGTCGCCAGCTTTTTC-3',miR-124 R:5'-TCTCTAGATGCAGCTGCAGCGCTGAGATC-3';U6 F:5'-CTCGCTTCGGCAGCACATA-3',U6 R:5'-CGAATTTGCGTGTCATCCT-3'。
1.2.3 CCK-8检测细胞增殖使用96孔板按照上述方法转染GIST-T1细胞,并在标准空白孔中加入不含细胞的完全培养液,培养48 h后在每个孔中加入10 μl CCK-8试剂,于摇床上轻轻晃动混匀后,置于37℃培养箱避光培养1 h,然后使用酶标仪测定波长450 nm的吸光度值。
1.2.4 Transwell检测细胞迁移和侵袭迁移:转染24 h后用胰酶消化各组细胞并使用无血清培养基重悬细胞,调整细胞密度为2×108个/L,取细胞悬液100 μl加在Transwell小室的上层,Transwell小室下层加入500 μl含10%血清培养基,置于培养箱中继续培养24 h后取出小室,PBS清洗后使用棉签轻轻擦去上室中未迁移的细胞,4%多聚甲醛固定20 min,PBS清 洗3次 后 使 用0.1%结 晶 紫 染 色10 min,PBS清洗后随机选取5个视野,计数下室染色细胞。侵袭:将冻存的Matrigel置于4℃冰箱直至液态,用400 μl无血清培养基稀释50 μl Matrigel胶原液并混匀。向Transwell小室上室中加50 μl上述稀释液,置于37℃培养箱中进行孵育直到凝固,然后加入100 μl无血清培养基浸润凝胶,吸弃,后续步骤与迁移实验相同。通过计数穿膜细胞的数目来反映细胞侵袭能力。
1.2.5 流式细胞术检测细胞凋亡转染48 h后用不含EDTA的胰酶消化miR-124 mimics组、mimics-NC组、空白对照组细胞,用上清培养液终止消化,1 000 r/min离心5 min,收集细胞,使用500 μl 1×binding buffer重悬细胞,然后加入5 μl Annexin VFITC和10 μl PI,室温避光5 min后流式细胞术统计各组的凋亡率。
1.2.6 通过生物信息学预测miR-124的靶基因通过生物信息学网站miRBD和Target Scan联合预测miR-124的靶基因。
1.2.7 双荧光素酶报告实验取GIST-T1细胞制备成单细胞悬液,接种于96孔板,按照Lipo‐fectamine 2000试剂说明书进行共转染,然后将细胞分为以下4组:①野生型质粒对照组(转染mimics-NC和Capn4-3'UTR);②野生型实验组(转染miR-124 mimics和Capn4-3'UTR);③突变型质粒对照组(转染mimics-NC和Capn4-3'UTR MUT);④突变型质粒实验组(转染miR-124 mimics和Capn4-3'UTR MUT)。24 h后裂解细胞,并按照双荧光素酶活性检测试剂盒说明书检测荧光素酶活性。相对荧光素酶活性=萤火虫荧光素酶活性值/海肾荧光素酶活性值。
1.2.8 Western blot检测收集转染后的GIST-T1细胞,进行裂解后提取细胞总蛋白质,BCA法测定蛋白浓度。每孔上样量为20 μg,10%SDS-PAGE电泳实验跑胶,以湿转法电转移至PVDF膜上,5%脱脂奶粉封闭1 h后,用1×PBST溶液清洗3次,然后加入一抗(Capn4抗体、β-actin抗体),4℃过夜孵育,洗膜后加入二抗,室温孵育2 h,洗膜后加入ECL显影液显影。
1.3 统计学分析采用GRAPD prism 6统计学软件进行分析,数据以±s表示,多组数据之间的比较采用单因素方差分析(ANOVA),两组数据之间比较采用t检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 miR-124在胃肠道间质瘤组织中具有低表达qRT-PCR检测收集到的30例胃肠道间质瘤组织、癌旁组织中miR-124的表达情况,以U6作为内参,结果显示miR-124在胃肠道间质瘤组织中的表达量显著低于癌旁组织(P<0.01,图1)。
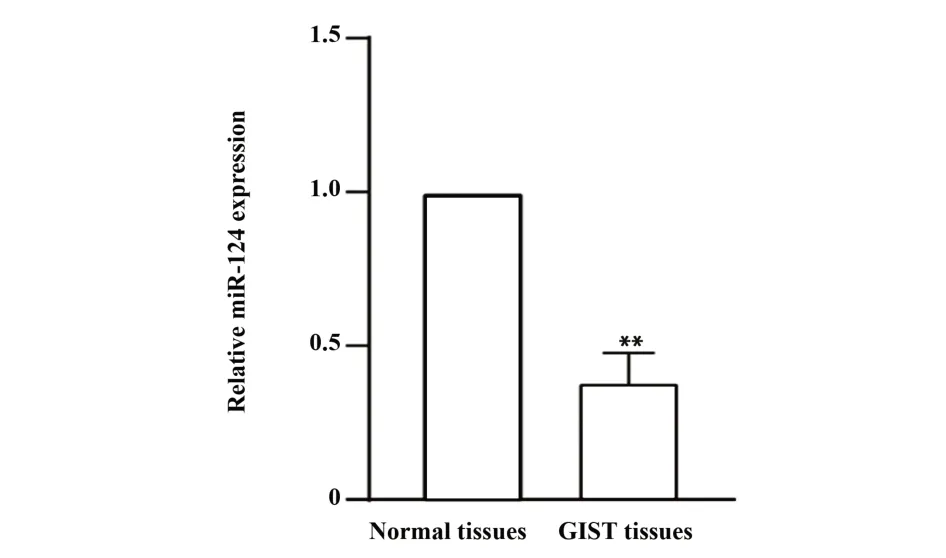
图1 qRT-PCR检测miR-124在GIST组织、癌旁组织中的差异性表达Fig.1 Differential expression of miR-124 in GIST tissues and adjacent tissues by qRT-PCR
2.2 miR-124在GIST-T1细胞中过表达后检测及细胞生物学功能检测以胃肠道间质瘤(GIST-T1)细胞作为研究对象,在细胞中分别转染miR-124 mimics、mimics-NC、miR-124 inhibitor、inhibitor-NC 48 h后,如图2A所示,与mimics-NC组相比,miR-124 mimics组GIST-T1细胞中的miR-124表达显著上调(P<0.01),mimics-NC组与空白对照组之间并没有差异,而与inhibitor-NC组相比,miR-124 inhibi‐tor组GIST-T1细胞中的miR-124表达显著下降(P<0.001)。提示转染miR-124 mimics能明显提高细胞中miR-124的表达水平,转染效率高。
在细胞中分别转染miR-124 mimics和mimics-NC 48 h后,CCK-8实验结果显示(如图2B),与mim‐ics-NC组相比较,miR-124 mimics组细胞吸光度值明显低于mimics-NC组(P<0.01),而mimics-NC组与空白对照组之间并无差异,说明上调miR-124表达能显著降低GIST-T1细胞增殖。
在细胞中分别转染miR-124 mimics和mimics-NC 48 h后,Transwell小室迁移实验结果显示(如图2C),与mimics-NC组 相比 较,miR-124 mimics组GIST-T1细胞迁移数目明显减少(P<0.01),mimics-NC组与空白对照组之间并无差异。说明上调miR-124表达能明显抑制GIST-T1细胞迁移。此外,Transwell检测细胞侵袭,显示侵袭能力下降(如图2D,P<0.05)。
在细胞中分别转染miR-124 mimics和mimics-NC 48 h后,流式细胞术检测各组细胞凋亡情况,结果如图2E所示,与mimics-NC组相比较,miR-124 mimics组GIST-T1细胞的总凋亡率明显增加(P<0.001),mimics-NC组与空白对照组之间并无差异。结果说明上调miR-124表达能明显促进GIST-T1细胞发生凋亡。
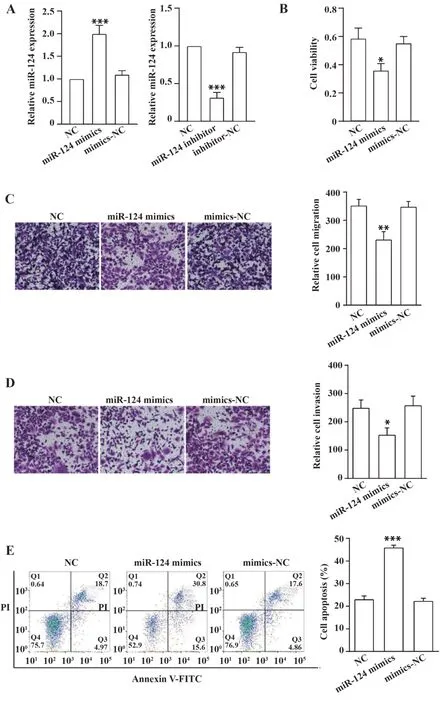
图2 miR-124表达对GIST-T1细胞增殖、迁移、侵袭和凋亡能力的影响Fig.2 Effect of miR-124 expression on proliferation,mi⁃gration,invasion and apoptosis of GIST-T1 cells
2.3 miR-124的靶基因预测通过生物信息学在线分析网站miRanda及Targetscan进行联合预测,并结合参考文献[16],预测Capn4可能是miR-124的靶基因,miR-124与Capn4 3'UTR区存在互补的结合位点(如图3A)。进一步通过双荧光素酶报告实验检测miR-124与Capn4 3'UTR的结合作用(如图3B),结果显示,miR-124能够显著性抑制GIST-T1细胞中Capn4 3'UTR区的荧光素酶活性(P<0.01),而miR-124对GIST-T1细胞中Capn4 3'UTR突变区的荧光素酶活性没有明显的抑制作用。说明miR-124可以与Capn4 3'UTR区进行特异性结合。
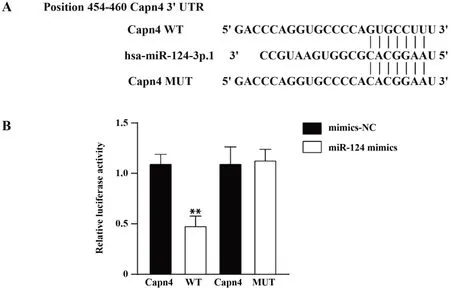
图3 miR-124与Capn4靶向结合Fig.3 Targeted binding of miR-124 to Capn4
2.4 miR-124对Capn4基因的表达调控细胞分组同上,转染48 h后,Western blot检测miR-124过表达或者抑制后Capn4蛋白表达水平变化,结果如图4所示,miR-124 mimics组中Capn4蛋白表达低于mimics-NC组及空白对照组(P<0.01),miR-124 in‐hibitor组中Capn4蛋白表达显著高于inhibitor-NC组及空白对照组(P<0.001)。表明miR-124可以下调Capn4蛋白表达。
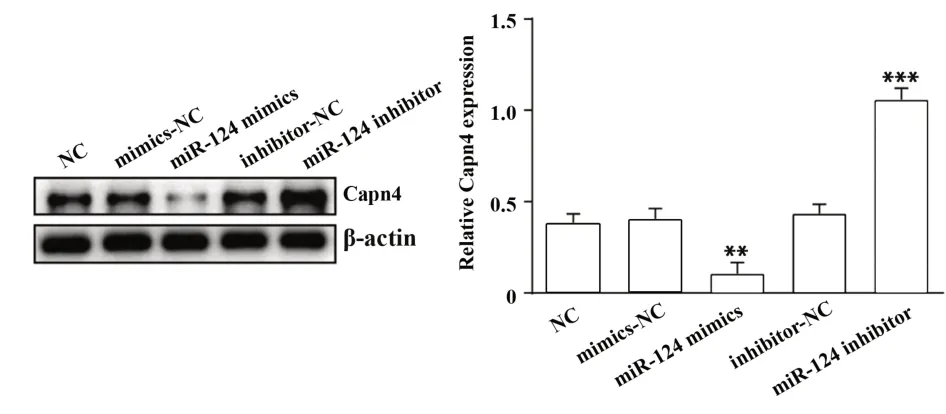
图4 Western blot检测GIST-T1细胞中Capn4蛋白表达Fig.4 Western blot was used to detect expression of Capn4 protein in GIST-T1 cells
2.5 miR-124对Wnt/β-catenin信号通路各蛋白表达的影响细胞分组同上,转染48 h后,Western blot检测miR-124过表达或者抑制后Wnt-1、βcatenin蛋白表达水平变化,结果如图5所示,miR-124 mimics组中Wnt-1、β-catenin蛋白表达低于mimics-NC组及空白对照组(P<0.001),miR-124 inhibitor组中Wnt-1、β-catenin蛋白表达显著高于inhibitor-NC组及空白对照组(P<0.001)。
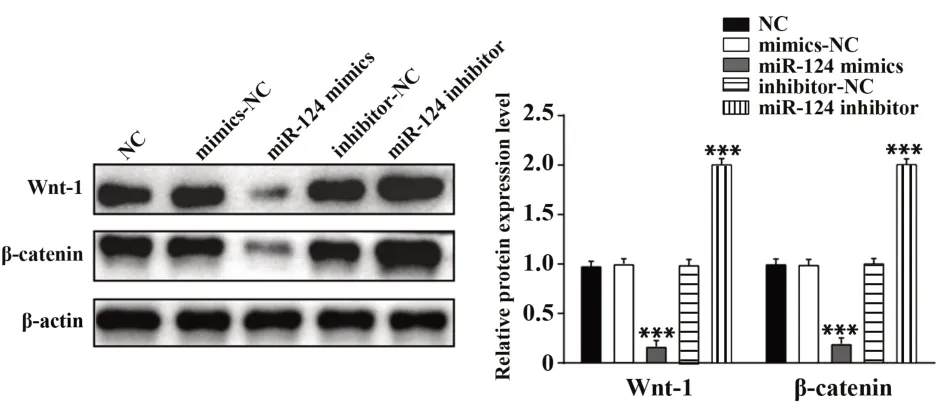
图5 Western blot检测GIST-T1细胞中Wnt-1、β-catenin蛋白表达Fig.5 Protein expressions of Wnt-1,β-catenin were mea⁃sured by Western blot in GIST-T1 cells
3 讨论
microRNA是一种高度保守的非编码性小RNAs(约为22个核苷酸)。miRNA在肿瘤中具有差异性表达,在细胞的增殖、迁移、凋亡具有重要作用。miR-124也是其成员之一,在肿瘤发生发展中具有差异性表达,并扮演着重要的调控角色。ZHANG等[17]发现,非编码RNA MALAT1与miR-124相互作用,并通过靶向JAG1调节舌癌生长。JIAO等[18]发现miR-124通过灭活Notch途径促进神经元干细胞的增殖和分化。LI等[19]发现lncRNA MALAT1通过调节miR-124/STAT3促进非小细胞肺癌的发展。PAN等[20]研究发现慢病毒介导的miR-124过表达通过靶向JAG1和EZH2抑制胃癌的生长和侵袭。本研究使用qRT-PCR检测胃肠道间质瘤组织和癌旁组织中miR-124的表达情况,发现miR-124在肠道间质瘤组织中的表达量显著低于癌旁组织,说明miR-124确实与胃肠道间质瘤的发生有关。为了进一步研究miR-124对胃肠道间质瘤(GIST-T1)细胞增殖、迁移和凋亡的影响,本研究在体外条件下培养GIST-T1细胞,然后发现在细胞中转染miR-124 mimics可以上调GIST-T1细胞miR-124的表达;CCK-8实验结果显示,上调miR-124表达能显著性降低GIST-T1细胞增殖;Transwell迁移实验结果显示上调miR-124表达能明显降低GIST-T1细胞迁移;Transwell小室侵袭实验结果显示上调miR-124表达能明显抑制GIST-T1细胞侵袭,流式细胞术检测结果说明上调miR-124表达能明显促进GIST-T1细胞发生凋亡。进一步说明miR-124在胃肠道间质瘤细胞中具有重要作用,能够抑制细胞发生恶性生物学行为。
目前,miR-124调控肿瘤发生的具体机制尚未明确。CHEN等[21]研究发现circHIPK3通过miR-124调节细胞增殖和迁移,并调节肝细胞癌中AQP3的表达。QIAN等[22]发现miR-124通过抑制整合素αV表达抑制人肝细胞癌迁移和侵袭。QIAO等[23]发现miR-124通过抑制AURKA抑制胶质母细胞瘤生长并增加化学敏感性。Capn4是钙蛋白酶的一个亚基,现有研究表明其在黑色素瘤、鼻咽癌、肝细胞癌、肝内胆管癌和肾细胞癌中均表达上调,说明Capn4在肿瘤的发生发展过程中确实具有重要作用。WANG等[24]研究发现Capn4通过激活Wnt/βcatenin信号通路促进人黑色素瘤的上皮-间质转化。ZHENG等[25]发现Capn4可通过NF-κB诱导的基质金属蛋白酶2促进鼻咽癌转移。CHENG等[26]发现Capn4通过增加MAPK7促进结直肠癌的增殖。
为了进一步研究miR-124调控胃肠道间质细胞瘤的具体机制,通过生物信息学预测Capn4可能是miR-124的靶基因,miR-124与Capn4 3'UTR区存在互补的结合位点。进一步通过双荧光素酶报告实验检测发现miR-124能够特异性结合Capn4 3'UTR,并通过Western blot检测发现miR-124可以下调Capn4蛋白水平表达,充分证实miR-124与Capn4之间具有靶向关系。CAI等[16]也证实miR-124通过Capn4在体外抑制胶质瘤细胞的迁移和侵袭。
肿瘤细胞的迁移和侵袭受到多种途径调节,如Wnt/β-catenin、NF-κB和EMT途径。β-catenin影响许多细胞过程,包括细胞增殖、黏附等,其在肿瘤细胞中也有高表达[27-28]。β-catenin在多种癌症中促进肿瘤进展和转移,并且在胃肠道间质瘤中也具有重要作用[29-30]。本研究Western blot结果显示miR-124可以下调Wnt-1、β-catenin蛋白表达,从而抑制了肿瘤的发生发展。
综上所述,miR-124可能通过靶向Capn4的表达,进而抑制GIST-T1细胞的生长和迁移,并促进GIST-T1细胞的凋亡,因此有望成为治疗胃肠道间质瘤的重要靶点,对胃肠道间质瘤的预防及治疗具有一定意义。本研究尚未证实Capn4和β-catenin的抑制剂对GIST-T1细胞生物学行为的影响,后续将深入研究。

