花青素对阿尔兹海默病关键药理途径的生物信息学分析及实验验证
罗连响 黄芳芳 吴锐剑 林浩雯 王渠 李晓玲 黄宇戈
(广东医科大学海洋医药研究院,湛江524023)
阿尔兹海默病(Alzheimer's disease,AD)是一种重度、慢性、进行性神经退行性疾病,与记忆和认知障碍相关,是老年人痴呆最常见的原因,并可导致死亡[1-2]。据估计,截至2018年,全球约有5 000万人患有AD,预计到2050年,AD患者人数将增加3倍以上,达1.52亿[3]。迄今为止,AD的病理机制尚未明确,但β-淀粉样蛋白(Aβ)和微管相关蛋白tau被认为是促进AD发生和发展的两个重要因素,细胞外Aβ蓄积,神经纤维缠结以及神经元内tau蛋白病变是AD的重要病理学特征[4]。此外,AD还与突触丢失、特定神经递质减少、神经炎症和神经元死亡等多种因素有关[5]。目前,由于AD发病机制复杂且尚未明确,药物只能在一定程度上缓解AD症状,但治疗效果不理想,且副作用大[6]。
花青素(cyanidin)是多酚类黄酮类化合物花色苷(anthocyanins)的主要成分之一,在各种花、果、种子和植物叶片中含量丰富,如樱桃、蓝莓、桑树、黑接骨木等,并且因其在中枢神经系统中的神经保护作用而备受关注[7-9]。花青素的神经保护作用的关键机制之一是抑制氧化应激和神经炎症。据报道,花青素可通过抑制内质网应激对Aβ25-35诱导的神经元细胞死亡产生保护作用,以及通过抑制人神经母细胞瘤细胞TLR4/NOX4下游NF-κB活性来减轻Aβ25-35诱导的神经炎症[10-11]。此外,研究表明,摄入花青素可降低AD发生的风险[12-13]。因此,探索花青素治疗AD的机制具有重要意义。
网络药理学是在大数据医学研究的新模式下产生的,可构建多层次网络模型,从网络角度描述生物系统、药物和疾病之间的复杂性,以高通量方式揭示小分子的调控原理[14-15]。而分子对接可从已知结构的受体(靶蛋白或活性位点)和配体出发,按照几何互补、能量互补以及化学环境互补的原则,进行分子间相互作用识别并预测受体-配体复合物结构,阐明药物的作用机理[16-17]。因此,本研究采用网络药理学方法分析花青素治疗AD的相关靶点以及相关信号通路,并通过分子对接技术以及体外实验对主要靶点进行进一步验证,为花青素治疗AD提供理论基础。
1 材料与方法
1.1 材料鼠小胶质细胞BV2细胞购自American type culture collection(ATCC);花青素购自MedChem Express(MCE);DMEM培养基、胎牛血清(FBS)和0.25%Trypsin-EDTA(1X)购自Gibco;普通RIPA裂解液(组织/细胞)购自Solarbio;抗COX-2抗体购自Cell Signaling Technology(CST);二氧化碳培养箱(型号FORMA STERI-CYCLE i160)购自美国Thermo Electron公司;超净工作台(型号SW-CJ-2D)购自苏州净化设备有限公司;超分辨激光扫描共聚焦荧光显微镜(型号FV3000)购自日本Olympus公司;Gel‐View 6000M多功能图像工作站(型号GelView 6000M)购自广州博鹭腾仪器仪表有限公司。
1.2 方法
1.2.1 药物靶点的收集在Pubchem数据库[18](https://pubchem.ncbi.nlm.nih.gov/)收集花青素(cyanidin)的相关信息,并将其结构的SDF文件保存,随 后 导 入Swisstargetprediction平 台[19](http://www.swisstargetprediction.ch/)上进行靶点预测。同时,在Chembl数据库(https://www.ebi.ac.uk/chembl/g/)和CTD数据库(https://ctdbase.org/)中收集花青素的靶点,去重整合后校正为人源靶点。
1.2.2 疾病靶点收集在OMIM数据库(https://omim.org)和Genecards数 据 库[20](http://Gene‐cards.org)中搜索AD的相关靶点。为了提高靶点准确性,取两个数据库中收录疾病靶点的交集作为疾病的靶点。
1.2.3 蛋白质互作网络(PPI)构建以及核心靶点的筛选将药物靶点和疾病靶点相互映射,随后将获得的交集靶点导入STRING平台[21](https://stringdb.org/)进行PPI网络构建,并将该网络数据导入cytoscape3.7.2软 件,利 用cytoHubba插 件,采 用MCC算法筛选出10个hub基因。
1.2.4 GO和KEGG富集分析将花青素和AD两者 的 交 集 靶 点 导 入Metascape平 台[22](https://metascape.org/)进行富集分析,所有结果富集倍数均大于1.5,P值均小于0.01具有统计学意义。在GO生物进程、GO分子功能以及GO细胞组分这三个类别中分别选取富集基因数最高的前15条GO通路进行展示。KEGG通路也根据富基因数排列,取前13条通路展示。此外,本研究重点关注了筛选出的hub基因的富集分析情况,在所有结果中,抽取出hub基因的富集通路进行展示。
1.2.5 分子对接和分子动力学研究分子对接是一个模拟小分子在大分子活性位点的对接姿势从而预测亲和力的过程,可用于评价药物活性成分与药物靶点结合能力[23-24]。因此,利用AutoDock4对花青素和靶点PTGS2进行分子对接研究。从Pubchem数据库中获取化合物花青素的SDF格式(CID:68247),然后使用ChemOffice构建化合物的3D结构保存为*mol2格式并使其能量最小化。靶点蛋白方面,从PDB数据库[25](http://www1.rcsb.org/)中获取PTGS2的3D结构PDB格式文件(PDB ID:3LN1),使用pymol2.3来除去靶点的水分子和使用AutoDock4来添加氢,再使用AutoDock4把化合物和靶点保存为pdbqt格式,随后运用vina程序进行对接,最后使用ligplot2.23来生成2D相互作用力图以及使用pymol2.3来分析对接后复合物的3D模式图。对接后,利用分子动力学仿真模拟PTGS2和花青素的复合物,以检测复合物的稳定性和灵活性。本研究使用GROMACS2018.1软件包和gro‐mos54a7_atbff力场以及SPC216水模型来进行分子动力学模拟。为了保证模拟系统的总电荷中性,在系统中加入相应数量的钠离子取代水分子进而形成合适尺寸的溶剂盒。然后将周期边界条件(PBC)应用于系统的三个方向。利用gromos54a7_atb力场,从ATB网站[26](http://atb.uq.edu.au/)获得花青素的力场参数。最初,整个系统50 000步的能量在300 k时被最小化(EM)。随后通过位置约束的MD模拟,然后通过NVT(粒子的数目、体积和温度恒定)和NPT(粒子的数目、压力和温度恒定),实现受体、配体和溶剂的平衡。最后,对体系的均方根偏差(RMSD)和原子位置的均方根波动(RMSF)进行分析,RMSD可通过反映体系里的分散程度进而反映复合物的稳定性,而RMSF则通过反映某一个原子相对于参考构象的结构变化,从而反映原子的自由度(灵活性)。
1.2.6 鼠小胶质细胞BV2细胞的培养和处理BV2细胞培养在含10%胎牛血清和1%青霉素/链霉素的DMEM高糖培养基中,并于5%CO2的37℃培养箱中培养。将BV2细胞以1×105个/ml的密度接种于12孔板中过夜。第2天将细胞分为空白对照组,LPS组以及给药组(5、10、20 μmol/ml花青素),给药组先用花青素预处理0.5 h,0.5 h后在LPS组以及给药组中加入250 ng/ml LPS共刺激24 h。
1.2.7 Western blot分析如1.2.6所示进行药物处理后,将BV2细胞用RIPA裂解液裂解以收集细胞蛋白。将收集的蛋白样品进行SDS-PAGE电泳,置于转膜仪转膜。转膜后分别孵育一抗抗体,4℃孵育过夜。第2天洗膜后加入稀释(1∶4 000)的二抗,室温孵育1 h。二抗孵育完成后,显影仪显影。最后使用Image J软件通过光密度法对印迹进行定量分析。
1.2.8 免疫荧光法检测PTGS2蛋白的表达提前1 d将BV2细胞铺于6孔板,在铺细胞之前将无菌的方形盖玻片加入6孔板。第2天进行药物处理,收样时弃去培养基,用PBS洗3次,然后加入4%多聚甲醛(PFA)室温固定20 min。弃掉PFA,用PBS在室温浸洗3次,每次5 min。然后加5 00 μl 0.5%Tri‐ton X-100(PBS配制)室温破膜15 min,再用PBS浸洗3次,每次5 min。之后用山羊血清封闭0.5 h。去除封闭液后加入PBS浸洗3次,每次5 min。加入相应的一抗稀释液(5%BSA稀释1∶300),静置4℃冰箱过夜。第2天回收一抗,加入PBS浸洗3次,每次5 min。然后加入对应的荧光二抗稀释液(PBS稀释1∶1 000)室温避光1 h。再用PBS避光清洗3次,每次5 min。接着加入DAPI染色液(PBS稀释1∶2 000)室温避光10 min。去除DAPI并加入PBS避光清洗3次,每次5 min。最后,准备好载玻片,并于每张载体玻片中央滴加50 μl抗淬灭封片液,随后将盖玻片倒扣于封片液上,4℃避光保存。在激光共聚焦显微镜下观察,并拍照记录结果。
1.3 统计学处理使用GraphPad Prism 8.3.0软件分析统计数据信息。所有数据均显示为±s。两组间的比较采用双尾t检验,多组数据间的比较采用单因素方差分析,P<0.05被认为差异具有统计学意义。
2 结果
2.1 药物及疾病靶点的收集在Chembl数据库收集到20个花青素靶点,在CTD数据库中收集到26个花青素靶点,在SwissTargetPrediction平台收集到99个花青素靶点。去重合并后共获得139个花青素人源靶点。在OMIM数据库和Genecards数据库中共收集到2 006个AD人源靶点。药物靶点和疾病靶点的交集情况用韦恩图表示,见图1A。
2.2 PPI网络以及核心靶点分析将71个交集靶点上传至STRING平台即可得到PPI图,将组织(or‐ganism)设置为“Homo sapiens”,文件以tsv格式保存,将71个交集靶点的相互作用信息上传至Cyto‐scape 3.7.2软件进行可视化,并利用MCC算法筛选出10个hub基因。PPI网络(见图1B)由71个节点,562条边构成,其中MCC算法排名前10的靶点依次为:血管内皮生长因子A(VEGFA),IL-6,原癌基因酪氨酸蛋白激酶src(SRC),肿瘤坏死因子(TNF),信号转导和转录激活因子3(STAT3),人前列腺素内过氧化物合酶2(PTGS2),基质金属蛋白酶9(MMP9),表皮生长因子(EGFR),雌激素受体alpha(ESR1),丝氨酸/苏氨酸蛋白激酶AKT(AKT1)。这10个hub靶点颜色随着MCC分数从黄色到红色变化,靶点越接近红色,MCC分数越高。网络中靶点的拓扑分析数据见表1。

表1 核心靶点在网络中的拓扑分析(度值排序前10个靶点)Tab.1 Topological analysis of core targets in network(top 10 targets in degree ranking)

图1 花青素与AD疾病靶点的韦恩图和交集靶点的PPI网络Fig.1 Venn diagram of cyanidin and AD targets and PPI network of intersection targets
2.3 GO富集分析GO(gene ontology)可从功能、参与的生物途径、细胞中的定位,对基因产物进行简单注释,因此,通过GO富集分析可以大致了解基因富集在哪些生物学功能、途径或细胞定位,为后续研究奠定基础。本研究使用Metascape平台进行GO富集分析共得到1 671个条目(P<0.05),其中包含1 517个生物进程(BP)条目,66个细胞组成(CC)条目,88个分子功能(MF)条目,并展示各部分富集基因数排名前15的通路,见图2。不同的颜色代表不同的部分,不同的柱子高度代表不同的基因富集数,柱子越高,代表基因在通路富集越显著。在生物进程(GO-BP)分析中,基因主要富集在细胞运动以及细胞参与的各个反应。而通过细胞组分(GOCC)分析,可以了解到,花青素治疗AD的靶点大多集中在膜区、突触和轴突区。在分子功能(GO-MF)分析中可以看出,靶点与各类激酶反应相关。
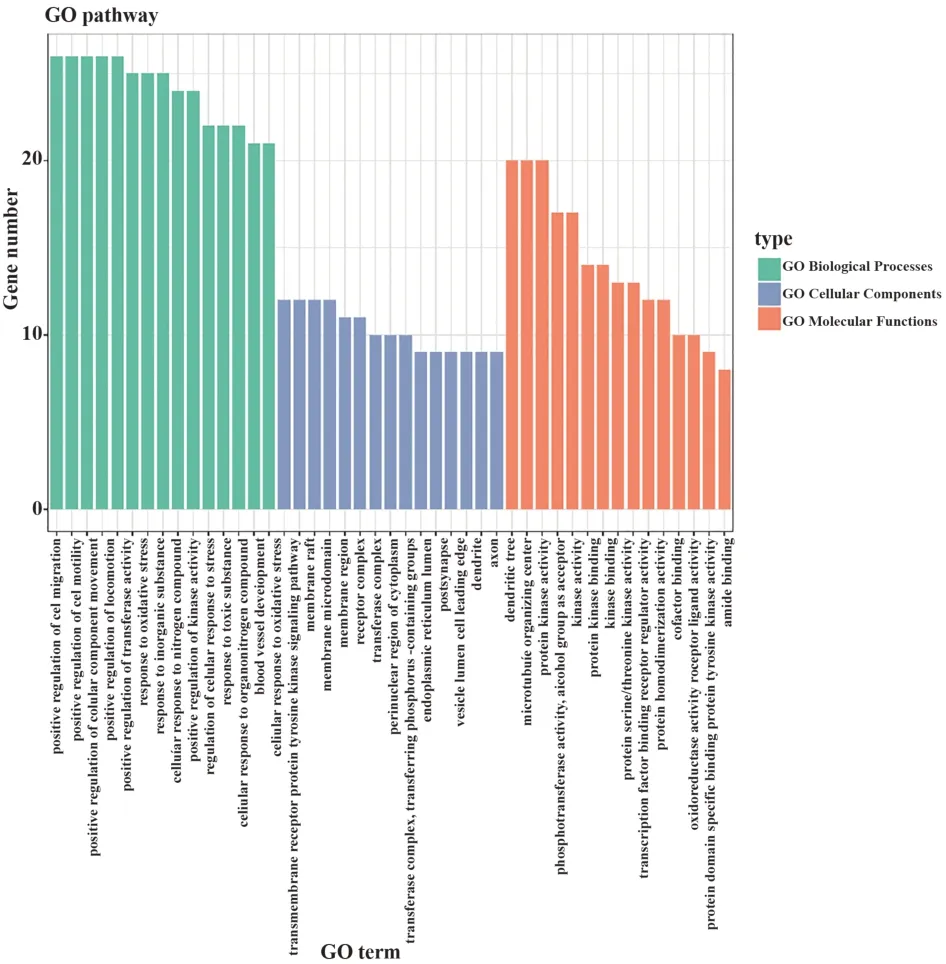
图2 花青素与AD交集靶点的GO富集分析图Fig.2 GO enrichment analysis of intersection target of cyanidin and AD
2.4 KEGG通路富集分析通过使用Metascape平台进行KEGG通路富集分析,共得到220条KEGG信号通路。图3展示了富集基因数排名前13的通路。纵坐标表示通路名,横坐标代表富集倍数,气泡大小代表富集在通路的基因数,颜色代表P值。结果显示,靶点主要富集在PI3K/AKT信号通路、Rap1信号通路、Ras信号通路、MAPK信号通路等。随后,从Metascape平台上下载的metascape_result.xlsx文件中挑选出与10个hub基因相关的通路,并用弦图展示,见图4。可见PTGS2和TNF与AD通路联系紧密,为后续研究提供依据。
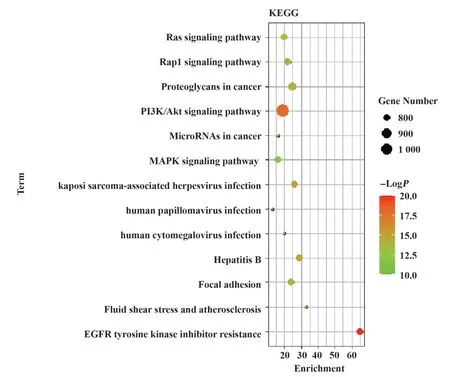
图3 花青素与AD交集靶点的KEGG通路图Fig.3 KEGG pathway diagram of intersection target of cyanidin and AD
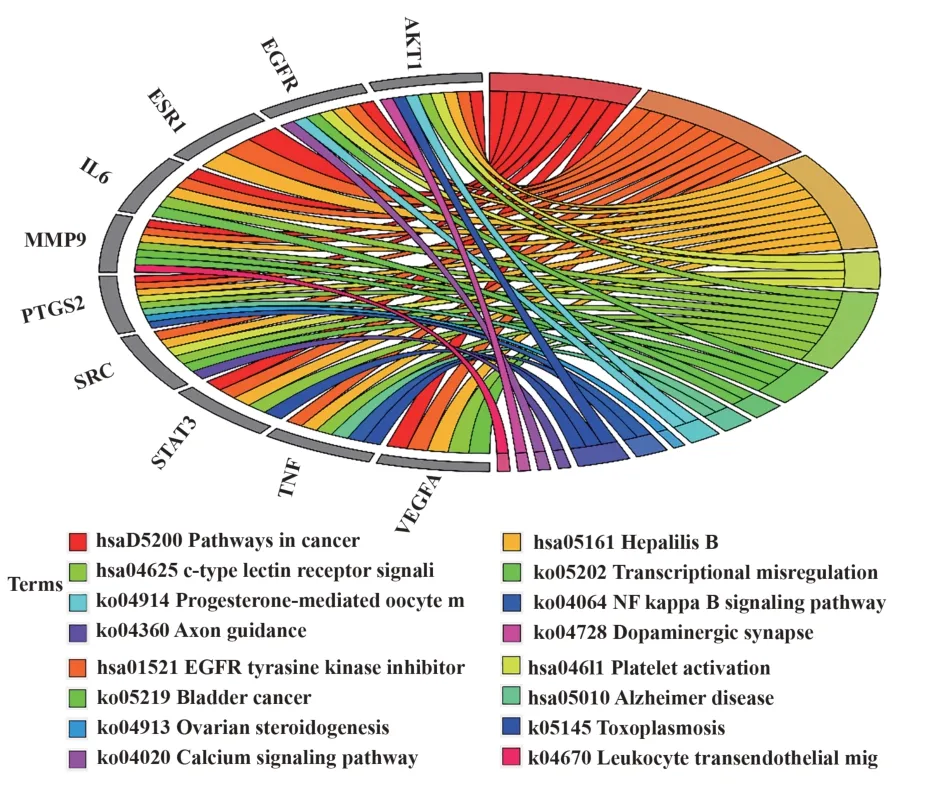
图4 10个hub基因的KEGG通路图Fig.4 KEGG pathway diagram of 10 hub genes
2.5 花青素与核心靶点PTGS2的分子对接及分子动力学研究炎症反应可在AD的病理生理学中起至关重要的作用,研究表明,Aβ可激活小胶质细胞,加剧神经炎症,导致AD的发生和发展,而促炎性酶如环氧合酶-2(COX2,即PTGS2)的过度表达会危及大脑神经元的存活[27-29]。本研究发现PTGS2为花青素治疗AD的关键靶点,且PTGS2与AD通路联系紧密。因此,为了进一步探讨花青素与PTGS2的结合效果,使用分子对接技术进行研究。在本次对接研究中,选择的活性位点是Leu338、Ser339、Arg499、Phe504和Val509,从图5A中看出花青素与活性位点中的Leu338形成了氢键作用;而从图5B中可以看到花青素与残基Leu338形成氢键相互作用(键长2.77Å),与Tyr341、His75、Arg499、Ser339和Val509以及Phe504等残基形成疏水相互作用;另外,花青素与PTGS2的结合能为-8.441 kcal/mol。因此,从相互作用和结合能数值可以发现,花青素与PTGS2形成了很紧密的结合,在结合强度方面表现非常良好。

图5 花青素与PTGS2活性位点的结合模式以及复合物体系的RMSD和RMSF图Fig.5 Binding mode of cyanidin and PTGS2 active sites and RMSD and RMSF of complex system
通过分子对接,发现花青素与PTGS2结合效果较好,因此,进一步使用分子动力学仿真模拟技术检测花青素与PTGS2复合物的稳定性和灵活性。分子动力学后,课题组获得了PTGS2和花青素在蛋白质方面的RMSD和RMSF的数据,其中与第一帧相比,PTGS2和花青素在100 ns的模拟过程中最终在7 ns平衡,并且RMSD数值为0.225 nm,说明PTGS2和花青素的体系很快达到了稳定且并未出现过多的波动(图5C),而在RMSF方面可以看到整体的RMSF数值处于0.05 nm到0.45 nm之间(图5D),而形成氢键的残基Leu338中RMSF的数值为0.1 nm,这说明氢键起到了限制Leu338的灵活性的作用。
2.6 花青素对LPS诱导的BV2细胞中PTGS2蛋白表达的影响采用LPS诱导BV2细胞建立神经炎症模型,随后通过Western blot以及免疫荧光法检测花青素对LPS诱导的BV2细胞中PTGS2蛋白表达的影响。如图6所示,与空白对照组相比,LPS组PTGS2蛋白表达明显增高,花青素预处理后明显降低。
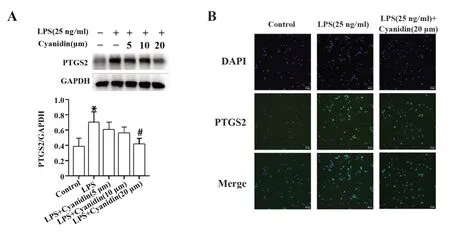
图6 Western blot和免疫荧光法检测PTGS2蛋白的表达Fig.6 Western blot and immunofluorescence detected expression of PTGS2
3 讨论
作为一种由多种因素引起的复杂疾病,AD的病因和发病机制尚不清楚,而目前用于治疗AD的药物只能在一定程度上缓解AD的症状,且治疗效果并不理想,副作用严重[6]。花青素是一种常见黄酮类化合物,因其在中枢神经系统中的神经保护作用而备受关注[7-9]。因此,为了更好探索花青素治疗AD的机制,本课题组通过网络药理学和分子对接的方法对花青素治疗AD的可能作用靶点及作用机制进行了综合研究。
通过对花青素作用靶点与AD疾病靶点进行交集分析,可发现71个共同靶点,这提示花青素可能具有抗AD的作用。进一步结合PPI网络拓扑分析结果发现,VEGFA、IL-6、SRC、TNF、STAT3、PTGS2以及AKT1等是该网络的关键靶点。通过分析10个hub基因的富集通路发现,PTGS2和TNF与AD通路联系紧密。PTGS2(即COX-2)是催化花生四烯酸转化为前列腺素的酶,可在AD病理生理学和神经退行性变中产生有害作用[30]。据文献报道,在中枢神经系统中,COX-1可在神经元、星形胶质细胞和小胶质细胞中组成性表达,而在病理生理条件下,COX-2在上述细胞中表达上调,并且COX-2抑制剂在AD、中风、帕金森病、多发性硬化症和精神分裂症等疾病的体内外模型中均显示出神经保护作用,这提示COX产物具有神经毒性。研究还发现,COX-2可诱导神经炎症介导秋水仙碱诱导的AD大鼠模型的记忆损害和神经退行性变[31-32]。以上结果提示抑制COX-2表达可能在花青素治疗AD中发挥关键作用。因此,本研究通过分子对接技术以及体外实验进一步验证花青素对PTGS2的影响。分子对接结果显示,花青素与PTGS2可形成良好结合,且稳定性较好。同时,体外实验结果也显示,在LPS诱导的BV2细胞神经炎症模型中,花青素可显著降低PTGS2蛋白的表达,这证明了网络药理学预测的准确性,也再次说明PTGS2对于花青素治疗AD的关键性。此外,研究也表明,在AD疾病进展过程中,细胞因子如TNF-α、IL-6可通过淀粉样斑块沉积加重神经炎症过程,从而产生细胞毒性作用,最终可能导致神经元死亡[33]。综上,花青素可能通过作用于PTGS2、IL-6、TNF等多个靶点减轻神经炎症,从而对AD发挥治疗作用。
通过对交集靶点进行GO富集分析,从功能、参与的生物途径和细胞中的定位对基因产物进行了简单注释。从分子功能富集结果分析,花青素治疗AD主要体现为与各类激酶反应;从细胞组分结果分析,花青素治疗AD的靶点大多集中在膜区、突触和轴突区;从生物进程富集结果分析,花青素治疗AD的靶点主要富集在细胞运动以及细胞参与的各个反应。以上结果提示花青素可能作用于多细胞组分参与不同细胞反应过程,从而发挥治疗AD的功效。
淀粉样斑块和神经纤维缠结是AD的重要病理特征,细胞外Aβ沉积所引起的细胞内Ca2+超载、氧化应激、神经炎症、细胞凋亡等最终可导致神经元丢失[34-35]。在本研究中,KEGG通路富集分析结果显示,花青素治疗AD可能与PI3K/AKT信号通路、Rap1信号通路、Ras信号通路、MAPK信号通路等多条通路密切相关。PI3K/AKT信号通路是最重要的信号通路之一,在多种信号转导和细胞功能中发挥关键作用。研究表明,PI3K/AKT通路可参与调控细胞周期生长、细胞迁移、凋亡和自噬等不同的细胞功能[36-37]。AKT是一种抑制凋亡信号通路的关键促生存因子,AKT磷酸化可抑制下游促凋亡因子Bax,上调下游抗凋亡因子Bcl2,最终抑制细胞凋亡[38]。此外,研究还发现,天然膳食花色苷(anthocy‐anins)可通过PI3K/AKT/Nrf2/HO-1途径减轻AD小鼠模型的氧化应激、神经退行性变和记忆障碍[39]。MAPK是慢性炎症性疾病的关键靶点,多个体内外实验表明,p38 MAPK能够协调多种与AD相关的事件,如tau蛋白磷酸化、神经炎症、神经毒性和突触功能障碍等[40-41]。因此,抑制p38 MAPK被认为是治疗AD的一种有前景的策略。此外,研究发现,Rap1信号通路和Ras信号通路也与AD的发病机制密切相关[42]。因此,基于文献报道和本研究网络药理学的分析结果,预测花青素可能通过调控PI3K/AKT、MAPK等多条信号通路来抑制细胞凋亡和氧化应激,减轻神经炎症以及调节tau蛋白,从而发挥治疗AD的作用。
综上所述,本研究通过网络药理学和分子对接的方法分析了花青素治疗AD的潜在靶点及调控分子机制,通过筛选得到71个潜在作用靶点,主要涉及PI3K/AKT信号通路、MAPK信号通路、Rap1信号通路、Ras信号通路等,揭示花青素可能通过减轻神经炎症反应、抑制细胞凋亡和氧化应激、调节tau蛋白等多种途径来发挥治疗AD的效果,表现出多靶点、多通路的作用特点。本研究通过结合文献研究、网络分析、分子对接、细胞实验,对花青素治疗AD的关键作用靶点和相关信号通路进行了探索性研究,为花青素治疗AD的进一步研究及其相关产品的开发提供依据。