miR-204在宫颈癌中的表达及对宫颈癌细胞生物学行为的调控机制研究
任 丹,宋一村,成荣杰,吴红梅,毕丹丹,王晓菲,李 楠*
(1.齐齐哈尔医学院附属第五医院 大庆龙南医院 病理科,黑龙江 大庆163000;2.哈尔滨医科大学附属第四医院 a.病理科;b.妇科,黑龙江 哈尔滨150001)
宫颈癌是女性最常见的生殖道恶性肿瘤之一,我国每年新发病例达13.15万,其中宫颈癌死亡人数约5.3万,严重危害我国女性身体健康[1-2],宫颈癌发病的相关基因分子信号机制及新型靶向治疗研究一直是该领域的热点[3-4]。目前已认识到微小RNA(miRNA)与宫颈癌的发病密切相关,探索其作用信号调控机制有助于深入认识宫颈癌发病的分子机制[5]。以往研究报道miR-204通过介导一系列的信号通路在宫颈癌及肿瘤发生发展中发挥着重要的作用[6-7],而miRNA的生物学功能主要通过靶向基因mRNA结合来实现,有研究发现沉默信息调节蛋白1(SIRT1)、CXC趋化因子受体4(CXCR4)参与了宫颈癌的发病过程[8-9],miR-204可调控SIRT1在多种癌症中发挥抑癌作用,且SIRT1具有抑制CXCR4表达活性的作用[10-11]。然而,目前尚不清楚miR-204是否通过介导SIRT1/CXCR4信号通路参与了宫颈癌的发病过程。因此,本项目拟借助临床研究联合体外细胞实验通过分子生物学检测手段,解析miR-204调控SIRT1/CXCR4信号通路在宫颈癌中的作用机制,以期深入认识宫颈癌发病的分子机制。
1 资料与方法
1.1 一般资料
选取2016年1月至2017年1月在大庆龙南医院行手术切除的宫颈癌癌组织及癌旁正常组织各30例,患者年龄范围35-75岁,平均年龄(44.92±3.21)岁,纳入标准:(1)宫颈癌的诊断标准参考人民卫生出版社《妇产科学》第8版标准;(2)所有患者均在本院接受手术治疗,标本来源于CIN Ⅱ级-Ⅲ级术后患者;(3)宫颈癌患者临床分期为Ⅰ期-Ⅱ期;(4)所有患者手术前均未接受放化疗。排除标准:(1)转移性宫颈癌;(2)合并其他部位恶性肿瘤疾病;(3)既往有放化疗病史。组织样本在手术室收集后于15 min内进行处理,组织样本置于液氮罐,被冻存于-80℃冰箱内,本研究经医院伦理委员会批准。人宫颈癌Hela细胞株均购于上海中科院细胞库。
1.2 主要试剂及仪器
DMEM 培养基,胰蛋白酶购自Gibco公司。胎牛血清购自Hyclone公司。MTT试剂盒、BCA蛋白定量试剂盒及Western Blot试剂盒购自上海碧云天生物公司。Transwell 小室购自美国Corning 公司。SIRT1、CXCR4一抗购自Proteintech公司。TRIzol 提取试剂、PrimeScript RT reagent Kit Perfect Real Time RNA 反转录试剂盒购自宝日生物技术有限公司。白藜芦醇、EX527及 Annexin V-FITC/PI 双染细胞凋亡检测试剂盒购自美国Sigma-Aldrich公司。引物序列由上海生工生物公司设计合成,miR-204模拟物由上海吉玛基因公司设计并合成。Lipofectamine 2000购自Invitrogen公司。凝胶成像仪购自Bio-Rad公司。SDS-PAGE蛋白电泳仪及湿式电转移系统购自北京六一仪器厂。ABI7500定量PCR仪购自Life公司。NanoDrop 2000超微量分光光度计购自美国Thermo公司。
1.3 方法
1.3.1细胞培养及转染 人宫颈癌Hela细胞株于37 ℃,5%CO2中培养,待细胞密度达80%-90%,可用0.25%胰蛋白酶消化用于后续实验,实验分组,对照组:加入PBS液;miR-204过表达组:转染构建miR-204基因过表达细胞;miR-204过表达+SIRT1激动剂白藜芦醇组:miR-204过表达后加入20 μmol/L的白藜芦醇预处理2 h;miR-204过表达+SIRT1拮抗剂EX527组:miR-204过表达后加入20 μmol/L的EX527预处理2 h。转染前一天,加入无抗生素的完全培养基,用Opti-MEM稀释miR-204模拟物,轻轻混匀,室温静置5 min;Opti-MEM稀释Lipofectamine2000,轻轻混匀,室温静置5 min;室温孵育20 min;转染后继续常规培养4-6 h后更换新的完全培养基,继续常规培养24-96 h,进行后续处理。
1.3.2qRT-PCR 检测mRNA的表达 TRIzol提取试剂提取组织和细胞总RNA,光度计测定总RNA浓度,测定RNA在260 nm、280 nm的吸光度值,检测纯度和计算浓度,RNA样品A260/280在1.8-2.1为合格。通过反转录试剂盒进行逆转录合成cDNA,以cDNA为模板进行PCR 扩增,以GAPDH为内参,引物见表1,反应体系和反应程序见表2、表3。采用2-ΔΔCt分析mRNA相对表达量。
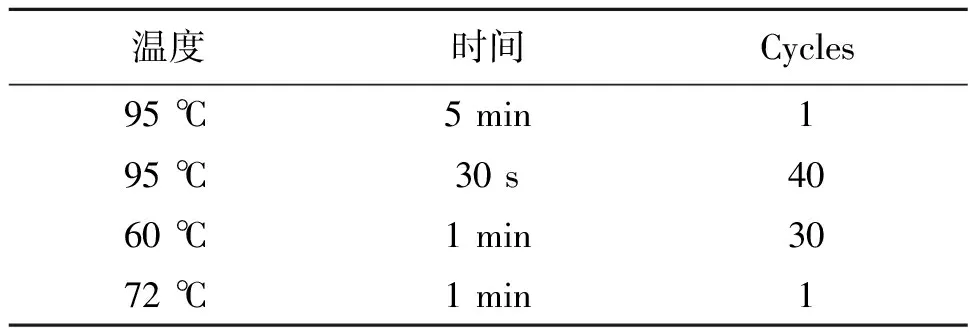
表3 反应程序
1.3.3Western Blot检测细胞SIRT1、CXCR4蛋白表达 加入RIPA裂解液至冰上充分裂解,离心后取上清,BCA法测定总蛋白浓度,用12%聚丙烯酰胺凝胶电泳,随后电转,用5% TBS(含脱脂奶粉)封闭1 h,加入1∶1000稀释的SIRT1、CXCR4和GAPDH一抗,4℃孵育过夜,TBST漂洗5 min×3次后加入适当浓度(1∶5000)的二抗,室温孵育1 h。TBST漂洗5 min×3次,暗室内浸入ECL液显色。
1.3.4MTT法检测细胞活力 于转染后24 h、48 h、72 h和96 h不同时间点,每孔加入 MTT溶液 20 μl,继续常规培养4 h后终止培养,吸弃原培养基,加入150 μl DMSO,室温下孵育10 min;随后振荡10 min,以空白对照孔调零,用酶标仪测定490 nm处OD值,绘制细胞的活力曲线。
1.3.5Annexin V-FIPC/PI双染色法流式细胞仪检测凋亡 取对数生长期的细胞以105个/ml密度培养24 h;加入5 ml不含胎牛血清的基础培养基,1 000 rpm/min,离心5 min,PBS漂洗2次,弃上液,取细胞数105个加入100 μl 1×binding buffer,分别加入5 μl Annexin V-FITC和5 μl PI,冰浴反应18 min;每管再加入1×binding buffer 300 μl,用300目尼龙网过滤,用FACS Calibur型流式细胞仪检测细胞凋亡,实验重复3次,取平均值。
1.3.6Transwell小室细胞侵袭实验 胰酶消化,用含BSA的无血清培养基重悬,调整细胞密度至(1-10)×105个/ml,加200 μl悬液至上室,然后加500 μl含10%胎牛血清的完全培养基至下室,培养24 h。取出小室,甲醇固定15 min,苏木素染液染色15 min,显微镜下随机选取5个高倍视野计数穿过膜的细胞数,重复3次。
1.4 统计分析
所有数据测定结果采用SPSS19.0统计软件进行分析,计量资料均采用均数±标准差表示,多组比较采用单因素方差分析,计数资料以率表示,两两比较采用LSD-t检验,计数资料采用卡方检验,以P<0.05为差异有统计学意义。
2 结果
2.1 miR-204、SIRT1、CXCR4在宫颈癌组织和癌旁正常组织的表达
与癌旁正常组织相比,宫颈癌组织中miR-204 mRNA相对表达量明显下降,SIRT1和CXCR4mRNA相对表达量明显增加,差异有统计学意义(P<0.05)。详见图1。
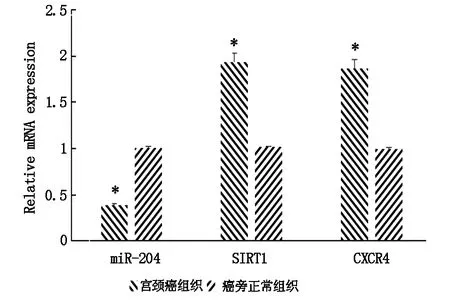
图1 miR-204、SIRT1、CXCR4在宫颈癌组织和癌旁正常组织的表达
2.2 调控miR-204对宫颈癌细胞增殖的影响
MTT实验显示与对照组相比,miR-204过表达组细胞增殖率显著下降(P<0.05),miR-204过表达+白藜芦醇组增殖率无明显差异(P>0.05),miR-204过表达+EX527组增殖率显著下降,且miR-204过表达+EX527组与miR-204过表达组存在显著性差异(P<0.05),详见图2。
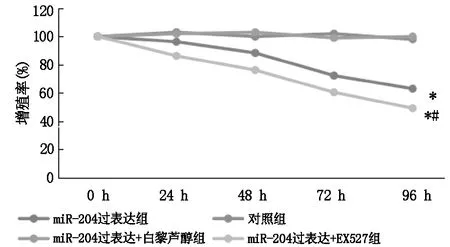
图2 调控miR-204对宫颈癌细胞增殖影响
2.3 调控miR-204对宫颈癌细胞侵袭的影响
Transwell小室实验显示与对照组相比,miR-204过表达组细胞侵袭细胞数显著下降(P<0.05),miR-204过表达+白藜芦醇组无明显差异(P>0.05),miR-204过表达+EX527组显著下降,且miR-204过表达+EX527组与miR-204过表达组存在显著性差异(P<0.05),详见图3。
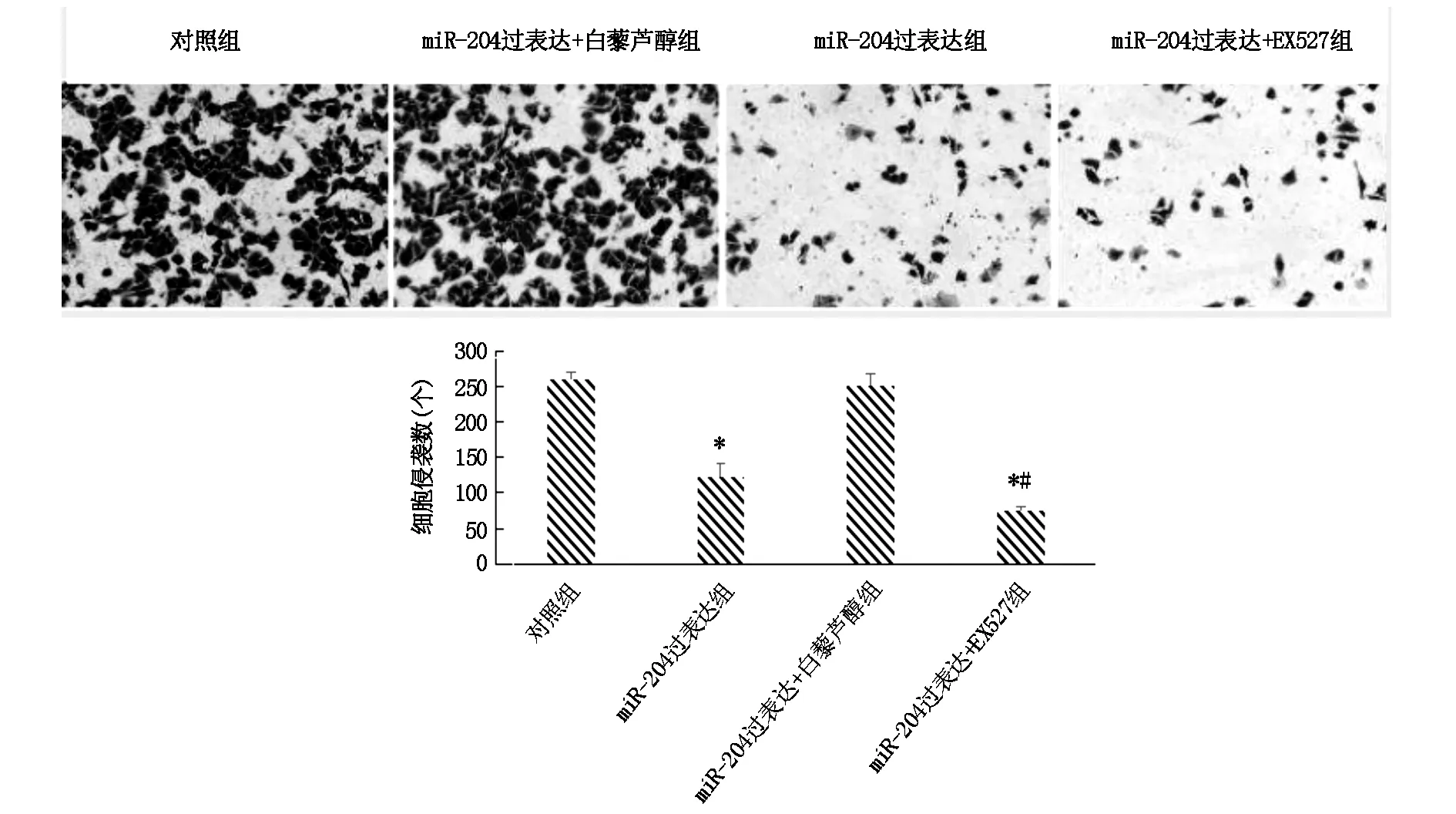
图3 调控miR-204对宫颈癌细胞侵袭影响
2.4 调控miR-204对宫颈癌细胞凋亡的影响
流式细胞术测定结果显示与对照组相比,miR-204过表达组细胞凋亡率显著上升(P<0.05),miR-204过表达+白藜芦醇组无明显差异(P>0.05),miR-204过表达+EX527组显著上升(P<0.05),且miR-204过表达+EX527组与miR-204过表达组存在显著性差异(P<0.05),详见图4、图5。

A:对照组;B:miR-204过表达;C:miR-204过表达+白藜芦醇组;D:miR-204过表达+EX527组

图5 各组宫颈癌细胞凋亡的影响
2.5 调控miR-204对宫颈癌细胞SIRT1、CXCR4的影响
qPCR检测及WB检测结果显示,与对照组相比,miR-204过表达组SIRT1、CXCR4显著下降(P<0.05),miR-204过表达+白藜芦醇组无明显差异(P>0.05),miR-204过表达+EX527组显著下降(P<0.05),且miR-204过表达+EX527组与miR-204过表达组存在显著性差异(P<0.05),详见图6、图7。
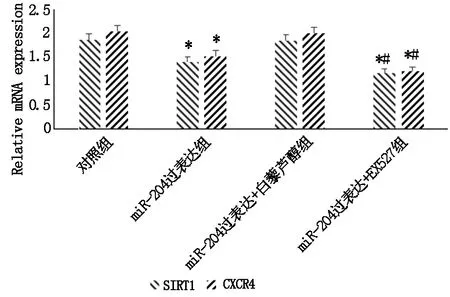
注:与对照组及miR-204过表达+白藜芦醇组相比,*P<0.05,与miR-204过表达组相比,#P<0.05。

图7 调控miR-204对宫颈癌细胞SIRT1、CXCR4 蛋白的影响
3 讨论
宫颈癌是发病率最高的生殖系统恶性肿瘤,高发病率及病死率是导致宫颈癌患者不良预后的主要原因[12]。尽管近年来治疗手段得到了长足发展,但由于发病机制尚未完全明确,中晚期宫颈癌患者预后并未得到明显改善[13]。进一步深入阐明宫颈癌发病的分子机制对于提高宫颈癌诊治能力具有重要意义,近年研究发现,miRNA在宫颈癌发生发展等恶性进展中发挥关键调控作用。
miR-204定位于人类9号染色体上73424891-73425000位置之间,属于抑癌基因,近来研究表明miR-204参与宫颈癌的发生、发展及侵袭转移等[14]。本研究发现与癌旁正常组织相比,miR-204在宫颈癌组织中的表达量显著降低,与Wu等的研究[15]结果类似。据生物信息学数据分析,miR-204具有多种靶基因,SIRT1便是其中之一,但关于miR-204调控SIRT1是否参与宫颈癌细胞生物学行为目前不得而知,为了进一步探究miR-204的具体功能是否与调控SIRT1通路有关,本研究miR-204模拟物转染至宫颈癌细胞诱导呈miR-204过表达模型,然后分别予以SIRT1激动剂白藜芦醇和抑制剂EX57干预,观察各自处理对细胞增殖,侵袭和凋亡的影响,结果显示,与不处理的对照组相比,miR-204过表达组的细胞增殖和细胞侵袭能力下降,SIRT1、CXCR4 表达水平均明显下降,同时凋亡率明显增加,表明提高miR-204表达有助于减缓肿瘤细胞生长和转移,而给予白藜芦醇后,细胞增殖、细胞侵袭及凋亡能力,SIRT1和CXCR4 表达水平均未发生明显变化,表明给予SIRT1激动剂后可以逆转miR-204过表达引起的抗肿瘤作用,与之相反的是给予抑制剂后,miR-204过表达的抗肿瘤作用明显增强,提示SIRT1为miR-204参与调控的下游靶基因,SIRT1是烟酰胺腺嘌呤二核苷酸依赖性组蛋白脱乙酰酶,研究显示抑制SIRT1可发挥抑癌作用[16]。CXCR4在多种恶性肿瘤细胞中高表达,能够促进恶性肿瘤的发展和转移[17],本研究进一步证实SIRT1和CXCR4在宫颈癌中高表达,抑制其表达可以实现抑制肿瘤细胞增长。本研究表明可通过提高miR-204表达抑制SIRT1/CXCR4通路参与调控宫颈癌细胞的生物学行为。
综上所述,miR-204在宫颈癌中呈现低表达,提高miR-204表达可以经SIRT1/CXCR4通路抑制宫颈癌细胞增殖和侵袭,并促进凋亡,miR-204 可作为一种潜在的治疗靶点。

