基于MPMS诱变体系的茶树菇细胞工程育种*
吴亚楠,尹显达,耿培妍,田宇超,李珊珊,王 谦**
(1.河北大学生物工程技术创新中心,河北 保定 071002;2.承德市农业环境保护监测站,河北 承德 067000)
茶树菇(Arocybe aegirita) 隶属于担子菌亚门(Basidiomycotina) 层菌纲 (Hymenomycetes) 伞菌目(Agaricales) 粪锈伞科(Bolbitiaceae) 田头菇属(A-grocybe),又名茶新菇、柱状田头菇[1],原生于南方的油茶树上,故俗称茶树菇[2]。其味道鲜美,脆嫩可口;且还含有人体所需的18种氨基酸,其中包括人体不能合成的8种氨基酸,还含有丰富的多种矿物质元素和B族维生素,是一种营养价值、药用价值均较高的珍稀食用菌[3]。
荆条 (Vitex negundo var.heterophylla) 为落叶灌木,喜光、抗旱、耐瘠薄,主要生长于山坡、路旁、林缘土岗等地[4],适应性极强,对土壤要求不严,分布几遍全国;冀北山地、晋东南山地、太行山、豫西山地丘陵以及晋陕黄土高原等地均有分布[5-6],而且还具有“愈伐愈盛”的特性[7]。
多功能等离子体诱变系统(multifunctional plas-ma mutagenesis system,MPMS) 以等离子体为主要诱变剂。等离子束进入细胞后,其活性成分与蛋白质DNA等生物大分子作用,会造成DNA片段局部损伤,以此激发细胞自身的修复体系,从而产生大量的随机突变[8]。该突变方式对碱基无选择,能在任何位点产生突变,从而产生种类丰富的变异基因[9]。MPMS诱变技术已应用于γ-氨基丁酸高产菌株[10]、淡紫拟青霉产几丁质酶菌种[11]、埃莎霉素Ⅰ高产菌株[12]的选育,与常规育种手段相比,MPMS具有成本低,操作简便,无有害气体,不污染环境,丰富育种手段等特点。
本研究使用新型育种方法MPMS,利用河北太行山林业废弃物荆条进行茶树菇育种工作,通过筛选得到最善于分解利用荆条的高产量、高品质、高利用率的茶树菇菌株。
1 材料与方法
1.1 材料
1.1.1 菌株
出发菌株茶树菇AS7(PDA斜面培养),保藏于河北大学食药用真菌研究所。
1.1.2 栽培原材料
荆条屑、杂木屑、玉米芯、麸皮等由河北大学扶贫基地张家口赤城县灵华食用菌种植有限公司提供。
1.1.3 供试培养配方
PDA斜面培养基:马铃薯20%、葡萄糖2%、琼脂2%、KH2PO40.1%,MgSO40.1%,pH自然。
液体培养基:玉米粉2%、豆饼粉2%、葡萄糖2%、酵母膏0.2%、KH2PO40.1%、MgSO40.1%。
荆条枝屑筛选培养基:荆条枝屑(过100目筛)0.5%、酵母膏0.2%、VB10.001%、KH2PO40.2%、MgSO40.05%、琼脂2%。
荆条枝屑栽培培养基:荆条枝屑(粉碎至木屑状)60%、玉米芯20%、麸皮18%、石灰2%。
1.2 试验方法
1.2.1 菌丝体的制备
将PDA培养基中的茶树菇菌丝刮于液体培养基中,接种后黑暗条件下静置24 h,再置于25℃、180 r·min-1的摇床上培养 4 d~7 d。
1.2.2 菌悬液的制备
将制备好的菌丝体经无菌纱布或无菌铜网过滤,滤液转移至离心管中,8 000 r·min-1离心5 min,弃上清。用无菌水冲洗沉淀2次,并制成悬浮液。
1.2.3 MPMS诱变处理
在超净工作台中用移液枪吸取50 μL制备好的菌悬液,均匀涂抹在无菌不锈钢载片上,将其置于无菌平皿内移至提前开机杀菌30 min的MPMS生物诱变育种机中。MPMS诱变射频功率为100 W,处理距离3 mm,气体流量12.00 L·min-1,设置诱变模式为A-F,以≥99.99%氮气为工作气体,诱变时间以每10秒递增的方式设置,分别为0、10 s、20 s……90 s,每个梯度设置6个平行[13]。诱变后的载片使用700 μL无菌水冲洗,将冲洗所得处理液充分混匀后,吸取300 μL处理液涂布于荆条木屑再生培养基平板上,25℃避光培养,5 d~10 d后记录诱变菌株数,绘制致死率曲线,以确定最佳后诱变照射时间。
1.2.4 诱变菌株的初筛
按3株诱变菌株与1株出发菌株的方法接入同一PDA平板培养基进行拮抗试验[14],挑选出菌株产生较明显拮抗反应的诱变菌株。
1.2.5 诱变菌株的复筛
将初筛得到的菌株分别取相同大小的3个菌块接入荆条枝屑筛选培养基试管中,同时以出发菌株为对照,25℃恒温培养。待菌丝萌发长齐后作为起点划线,观察菌株长势,计算生长速度,统计菌丝生长速度[15]。
挑选长势、生长速度均优于出发菌菌株的诱变菌株栽培培养基,测定30 d后其多酚氧化酶活性。诱变菌株多酚氧化酶测定采用邻苯二酚法测定[16-18]。
按荆条屑配方制作菌袋,接种优良诱变菌株后,在黑暗的条件下培养,开袋后统计三茬鲜菇的重量,计算生物学效率[19-21]。
1.2.6 诱变菌株真实性鉴定
对筛选得到的优良诱变菌株与出发菌株进行菌种真实性鉴定,采用ISSR分子标记技术[22-25],明确优良诱变菌株与出发菌株在分子水平上的遗传距离,使用软件Ntsys 2.10e进行聚类分析,构建遗传关系聚类树状图。其ISSR引物序列见表1。

表1 ISSR引物序列Tab.1 Sequence of ISSR prime
1.3 数据统计
试验数据采用SPSS进行分析。
2 结果与分析
2.1 MPMS致死率曲线
诱变菌株致死率曲线见图1。
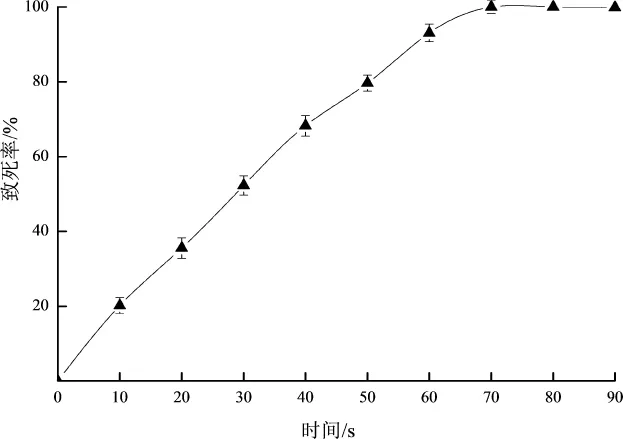
图1 致死率曲线图Fig.1 The lethality curve
由图1可知,50 s时菌丝体的致死率为79.65%;60 s时菌丝体的致死率为93.07%;70 s时菌丝体的致死率为99.99%;80 s后致死率达到了100%,因此,选用60 s为MPMS最佳诱变时间。
2.2 诱变菌株的初筛结果
通过MPMS诱变共得到262株诱变菌株。拮抗试验后,有22株茶树菇诱变菌株与出发菌株产生明显的拮抗反应,部分菌株拮抗反应见图2。
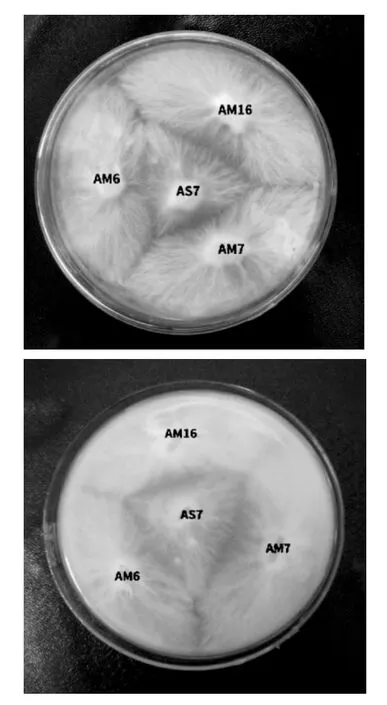
图2 诱变菌株的拮抗反应图Fig.2 Antagonistic reaction diagram of mutagenesis strain
由图2可知,诱变菌株AM16、AM6以及AM7与出发菌株AS7产生了明显的拮抗反应。
2.3 诱变菌株复筛的结果
2.3.1 诱变菌株与出发菌株生长速度与长势对比
荆条枝屑再生筛选培养基中诱变菌株与出发菌株生长速度、长势统计结果见表2。
由表2可知,MPMS诱变试验得到了与出发菌株有明显拮抗的20株诱变菌株;其中生长速度较快的菌株AM220、AM27、AM229、AM233、AM17与出发菌株相比有显著差异;菌株AM220、AM27、AM229较出发菌株有极显著性差异;菌株AM220的生长速度最快,高达3.42 mm·d-1,比出发菌株快0.34 mm·d-1。
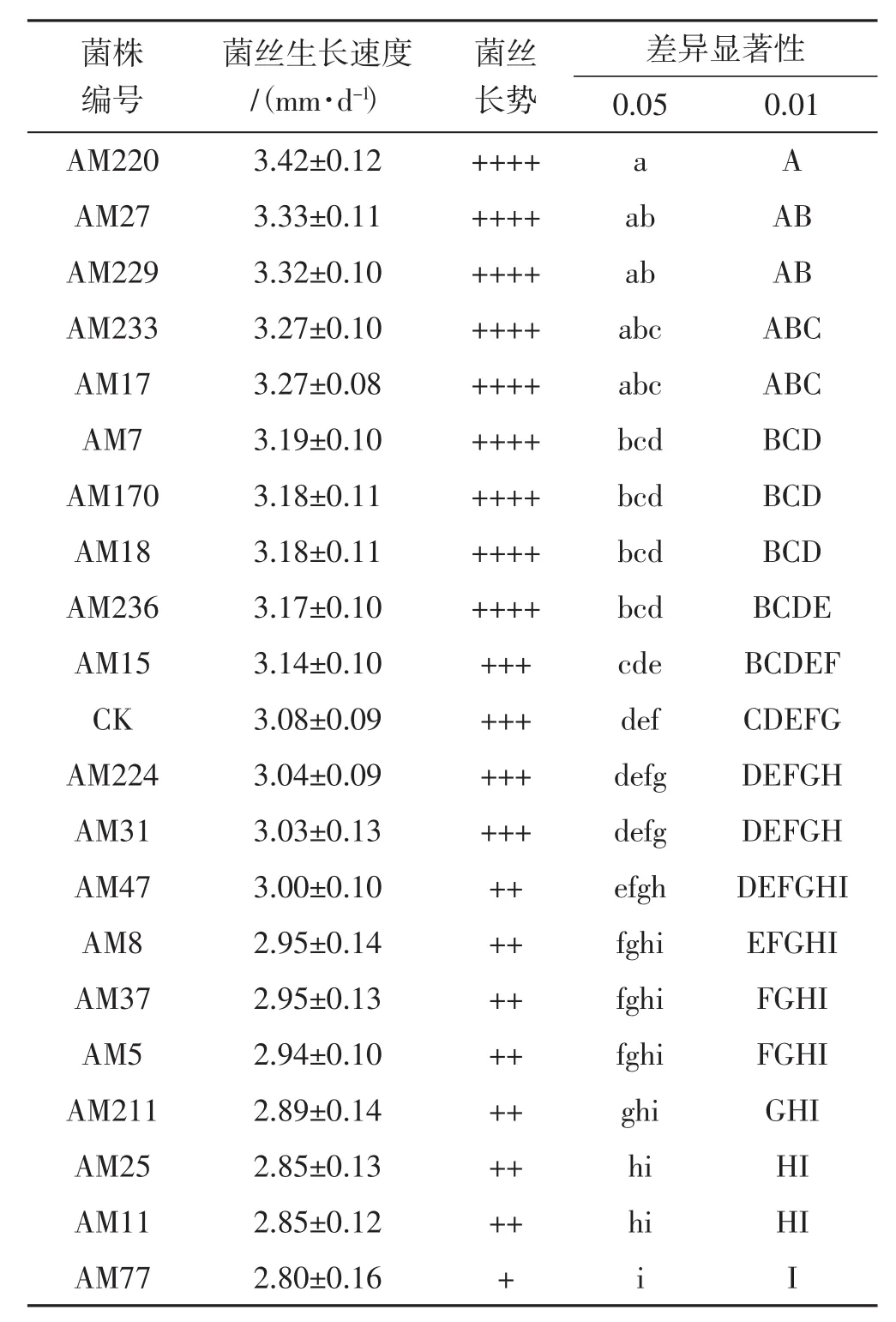
表2 诱变菌株长势与生长速度对比结果Tab.2 Comparison on growth rate and tendency of regeneration strains
2.3.2 诱变菌株与出发株胞外酶活性对比
1)葡萄糖标准曲线
根据数据绘制葡萄糖标准曲线见图3。
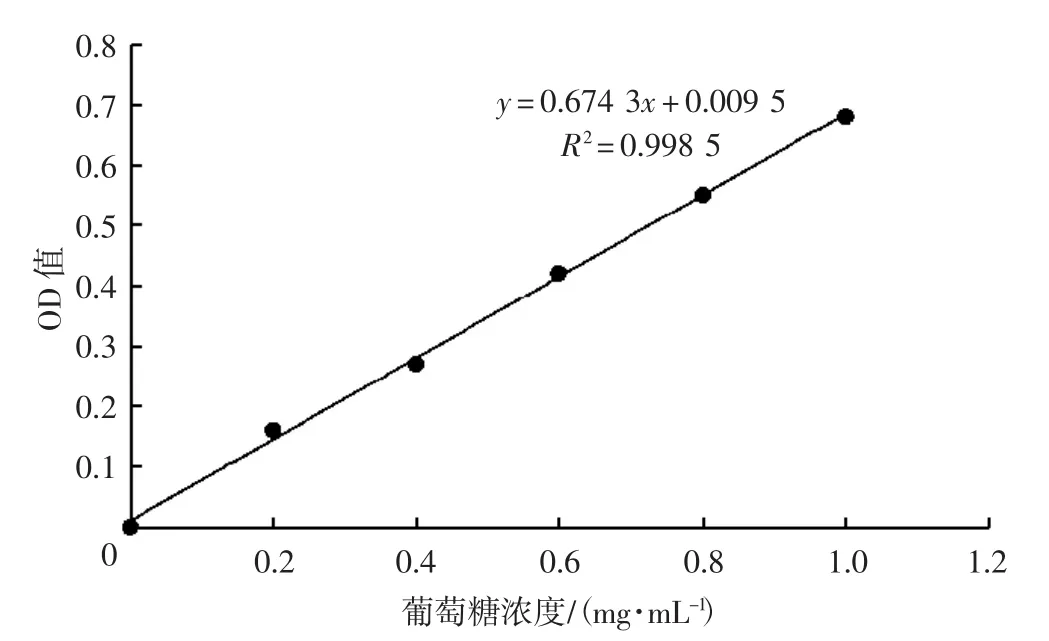
图3 葡萄糖标准曲线Fig.3 Glucose standard curve
由图3可知,葡萄糖标准曲线方程为:
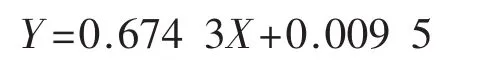
葡萄糖标准曲线方程的回归系数R2为0.998 5。
2)诱变菌株多酚氧化酶酶活比较
荆条枝屑再生筛选培养基中诱变菌株多酚氧化酶酶活测定结果统计见表3。
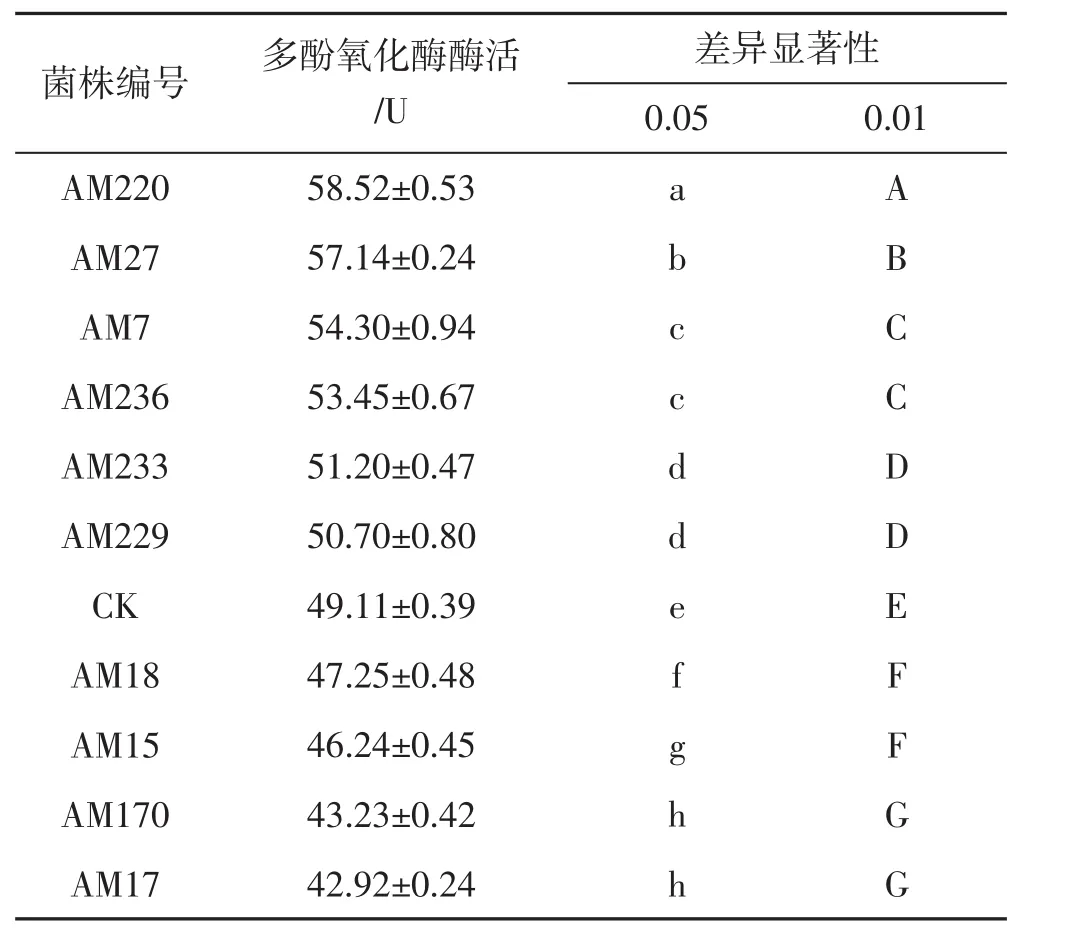
表3 诱变菌株多酚氧化酶活比较Tab.3 Comparison of polyphenol oxidase activity of regenerated strains
由表3可知,诱变菌株AM220、AM27、AM7、AM236、AM233、AM229等6株多酚氧化酶活性均高于出发菌株,且与出发菌株相比有极显著性差异,其中诱变菌株AM220的多酚氧化酶活性最高。
2.3.3 优良诱变菌株生物学效率比较
优良诱变菌株于荆条枝屑栽培培养基中培养,其生物学效率统计结果见表4。
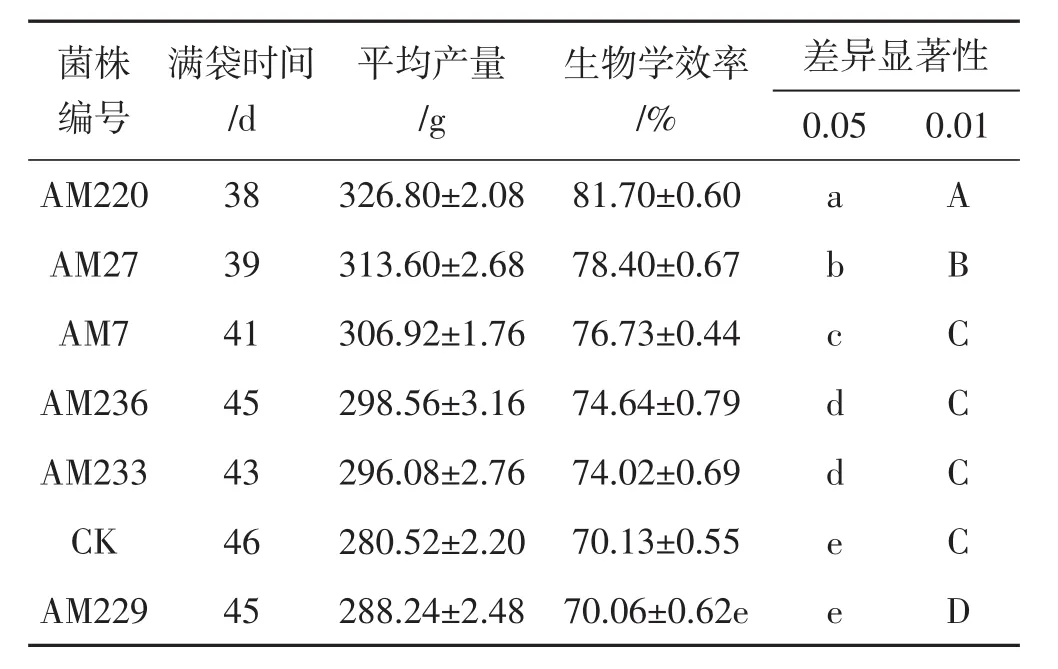
表4 优良诱变菌株生物学效率对比Tab.4 Comparison of biological efficiency of regenerating strain
由表4可知,优良诱变菌株AM220、AM27、AM7、AM236、AM233与出发菌株相比有显著性差异,优良诱变菌株AM220、AM27与出发菌株相比有极显著性差异。菌株AM220的满袋时间为38 d,比出发菌株满袋时间提前8 d,生物学效率提高11.57%,因此确定菌株AM220是最适宜分解荆条的茶树菇菌株。
2.4 ISSR试验结果
2.4.1 优良诱变菌株ISSR指纹图谱
通过复筛筛选得出优良诱变菌株,其部分ISSR指纹图谱见图4。
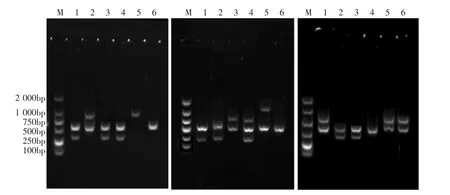
图4 引物807、811和P6对6株菌株的ISSR扩增图谱Fig.4 ISSR profiles from primer 807、811 and P6 for 6 strains
由图4所示,对筛选得到的优良诱变菌株AM7、AM27、AM220、AM233、AM236与出发菌株AS7进行ISSR-PCR扩增后发现,在挑选的21条引物中,引物 807、809、811、815、852、P1、P2、P6 的扩增图谱效果较好,条带清晰稳定、分布合理且具有差异性。共获得34条扩增条带,各条引物可获得2条~6条扩增条带,其中有17条扩增条带与出发菌株有差异,扩增条带大小在250 bp~2 000 bp。
2.4.2 优良诱变菌株亲缘关系分析
优良诱变菌株与出发菌株遗传关系见图5。
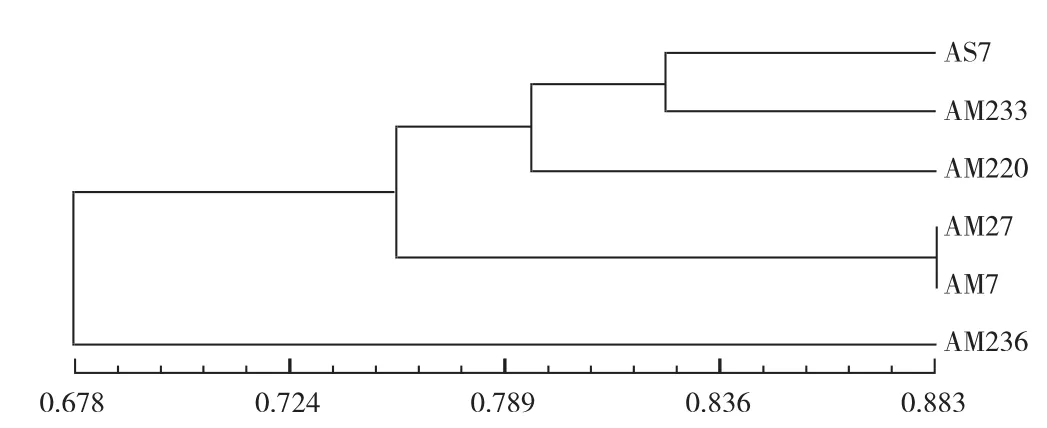
图5 优良诱变菌株与出发菌株遗传关系聚类树状图Fig.5 UPGMA dendrogram based on the similarity coefficient within superior regeneration strains and parents
由图5可知,对筛选所得的诱变菌株AM7、AM27、AM220、AM233、AM236,与出发株进行聚类分析,5株优良诱变菌株与出发菌株的遗传相似系数变异为0.678~0.883,当遗传相似系数为0.745时,菌株可分为3个类群。第一类是菌株AM236,第二类是菌株AM27和菌株AM7,第三类是菌株AM220、AM233和出发菌株AS7。说明5种优良诱变菌株均与出发株存在不同程度差异。诱变菌株AM236与出发菌株AS7的遗传相似系数最小,说明菌株AM236发生了明显的基因突变。
3 讨论
研究使用MPMS诱变育种技术进行育种,确定最佳诱变时间为60 s,共选育出茶树菇诱变菌株262株。通过与出发菌株的拮抗试验筛选出20株诱变菌株。复筛通过生长速度、长势试验测定,筛选出10株优于出发株的诱变菌株;另通过多酚氧化酶酶活测定,筛选出6株优于出发株的优良诱变菌株;最后通过优良诱变菌株生物学效率的比较,确定出一株善于分解荆条的诱变菌株AM220,其生长速度可达3.42 mm·d-1,比出发菌株快0.34 mm·d-1,生物学效率可达81.70%,比出发株高11.57%。
ISSR分子鉴定结果表明,5株优良诱变菌株与出发菌株的遗传相似系数变异范围为0.678~0.883,5株优良诱变菌株与出发菌株均存在不同程度的差异。
MPMS可以用作食用菌诱变育种新技术。荆条屑具备栽培茶树菇的前景,是产业扶贫、生态农业可以利用的技术途径之一。
——读袁鹰的散文《荆条蜜》

