抗生素治疗对胚胎反复着床失败合并子宫内膜炎患者妊娠结局的影响
李洁,肖卓妮,李雪瑶,丁锦丽,赵璟,管枫,杨亦青,杨菁*
(1.武汉大学人民医院生殖医学中心 湖北省辅助生殖与胚胎发育医学临床研究中心,武汉 430000;2.武汉大学人民医院病理科,武汉 430000)
近年来,随着体外受精-胚胎移植(IVF-ET)及其衍生技术的发展,辅助生殖技术临床妊娠率有了较大的提高,胚胎能否着床成功是妊娠的关键环节,其中有15%~20%左右的患者出现反复着床失败(recurrent implantation failure,RIF),他们承受着生理、心理及经济的巨大负担。RIF病因涉及到卵母细胞及胚胎质量、植入胚胎数量、子宫内膜容受性,以及母胎界面免疫因素等方面,如何提高RIF患者胚胎着床率为临床亟需解决的热点问题,近年来有研究发现子宫内膜炎在RIF患者中发生率较高并逐渐引起关注。
慢性内膜炎(Chronic endometritis,CE)是子宫内膜间质内异常浆细胞渗出导致的局部的持续炎性疾病,患者通常无明显临床症状或者仅伴有轻微下腹不适、白带增多,盆腔隐痛或痛经等。虽然CE临床无明显症状,但严重影响了女性生殖健康。有研究报道在不孕患者中CE发生率为 2.8%~56.8%[1-2],在RIF患者中的发生率则达到14%~30.3%[3-4],这些研究结果提示CE与妊娠结局密切相关。本研究主要观察CD138标记浆细胞在RIF患者子宫内膜中浸润的情况,对合并CE的RIF患者进行抗生素治疗后再次评估浆细胞表达,并评估行冻融胚胎移植(FET)患者的妊娠结局,旨在探讨抗生素治疗对RIF合并CE患者行FET后妊娠结局的影响。
资料和方法
一、研究对象
选取2018年1月至2019年12月在武汉大学人民医院生殖中心行IVF/ICSI-ET助孕的RIF患者为研究对象。纳入标准为:(1)40岁以下,至少经历2次新鲜或FET周期,且累计移植≥4 枚优质胚胎仍未获临床妊娠[5];(2)夫妇双方染色体核型均正常,(3)女方彩超提示子宫形态及内膜厚度正常,无内分泌疾病,无血液高凝倾向。排除标准:(1)子宫解剖结构异常;(2)患有自身免疫性疾病;(3)患者BMI>29 kg/m2或<18 kg/m2。
本研究已经通过了我院伦理委员会的伦理审查,纳入患者均签署了知情同意书。
二、研究方法
1.子宫内膜标本收集:所有患者在黄体中期经阴道B超确定子宫内膜为分泌期形态,使用一次性子宫内膜取样器(江苏嘉鼎诚医疗器械)收集少量子宫腔内膜组织,经盐酸缓冲液(PBS)漂洗,于10%中性甲醛固定后行苏木精伊红(HE)染色、常规组织病理学检查及CD138免疫组化检查。
2.CE诊断:根据CD138免疫组化染色结果判定,以高倍镜视野下发现≥5个CD138+标记的浆细胞为阳性[6],计数30个高倍镜视野。若阳性视野数≥3个为强阳性,阳性视野数1~2个为弱阳,镜下仅见到1~4个CD138+标记的浆细胞或未见到浆细胞浸润,为非CE组,即对照组。
3.CE治疗:对于CE阳性患者给予口服盐酸多西环素(江苏联环药业)100 mg 2次/日 ×14 d 和甲硝唑(金日制药)500 mg 3次/日×14 d,疗程结束后再次在黄体中期取内膜行CD138免疫组化检测判断治疗效果。
4.分组:根据抗生素治疗后患者CE转归情况分为CE持续阳性组(n=5)、CE弱阳组(n=27)、CE转阴组(n=82)及非CE组(n=217)组,除持续强阳性组外,其余3组进行胚胎移植。
5.胚胎移植内膜准备:(1)GnRH-a 降调节+激素替代周期:月经第2~3 天肌肉注射 GnRH-a醋酸亮丙瑞林微球注射液(抑那通,武田,日本)3.75 mg,28 d后给予戊酸雌二醇片(补佳乐,拜耳,德国),4~6 mg/d,根据内膜厚度调整用药剂量及用药时间,内膜厚度在 7 mm 及以上后给予患者肌肉注射黄体酮油剂40 mg/d(浙江仙琚)转化内膜,第 4天或第6天行卵裂期胚胎移植或囊胚移植。
6.胚胎移植及黄体支持:按照玻璃化解冻常规对胚胎进行解冻、复苏。卵裂期优质胚胎为:卵裂球数量为 7~12 个,细胞大小符合发育阶段,碎片<10%,无多核化现象;优质囊胚评分在3BB 以上[7]。常规在 B 超引导下行优质胚胎移植,卵裂期每次移植不超过2枚胚胎,囊胚建议单囊胚移植。移植后每天给予黄体酮油剂40 mg/d肌肉注射及口服地屈孕酮片(达芙通,雅培,荷兰)10 mg,2次/日,进行黄体支持至孕10周左右。
7.妊娠判断:卵裂期胚胎移植12 d或囊胚移植10 d后查血HCG,HCG≥10 U/L为HCG阳性,移植30 d后经阴道超声检查见孕囊为临床妊娠,阴道超声检查发现异位妊娠或患者HCG升高但宫内未见孕囊为异位妊娠,孕28周之前的胚胎丢失记为流产。
8.观察指标:(1)患者一般情况包括年龄、体质量指数(BMI)、窦卵泡计数(AFC)、抗苗勒管激素(AMH)、不孕年限、不孕类型、既往移植周期数、移植日内膜厚度、移植胚胎个数;(2)移植周期妊娠结局包括HCG阳性率、临床妊娠率、着床率、异位妊娠率、流产率、活产率。HCG阳性率=HCG阳性周期数/冻融周期数×100%;临床妊娠率=临床妊娠周期数/冻融周期数×100%;着床率=孕囊数/移植胚胎数×100%;异位妊娠率=异位妊娠周期数/临床妊娠周期数×100%;流产率=胚胎丢失周期数/临床妊娠周期数×100%;活产率=活产分娩数/冻融胚胎移植周期数×100%
三、统计学处理

结 果
一、RIF患者中CE的检出及治疗情况
在2018年1月至2019年12月期间,我们共纳入观察 331 例RIF患者,经CD138免疫组化染色进行CE确诊,发现114例患者合并CE,检出率为34.44%(114/331),其中CE呈强阳性患者占 25.98%(86/331),CE呈弱阳性患者占8.46%(28/331);CE阴性者共217例,占65.56%(217/331)。
114例CE阳性患者经抗生素治疗后再次在黄体期取子宫内膜行CD138免疫组化检测结果显示5例患者持续强阳性,27例患者为弱阳性,82例患者转为阴性。其中86例RIF合并CE强阳性患者有59例转为CE阴性,占 68.60%(59/86);有22例患者CE转为弱阳性,占25.58 %(22/86);CE持续强阳患者为5例,占5.81%(5/86)。28例RIF合并CE弱阳性患者经抗生素治疗后有23例转为CE阴性,占 82.14%(23/28);有5例患者持续呈弱阳性,占17.86%(5/28)。根据治疗及检查情况将除持续强阳性外的患者分为3组,详细分组流程见图1。
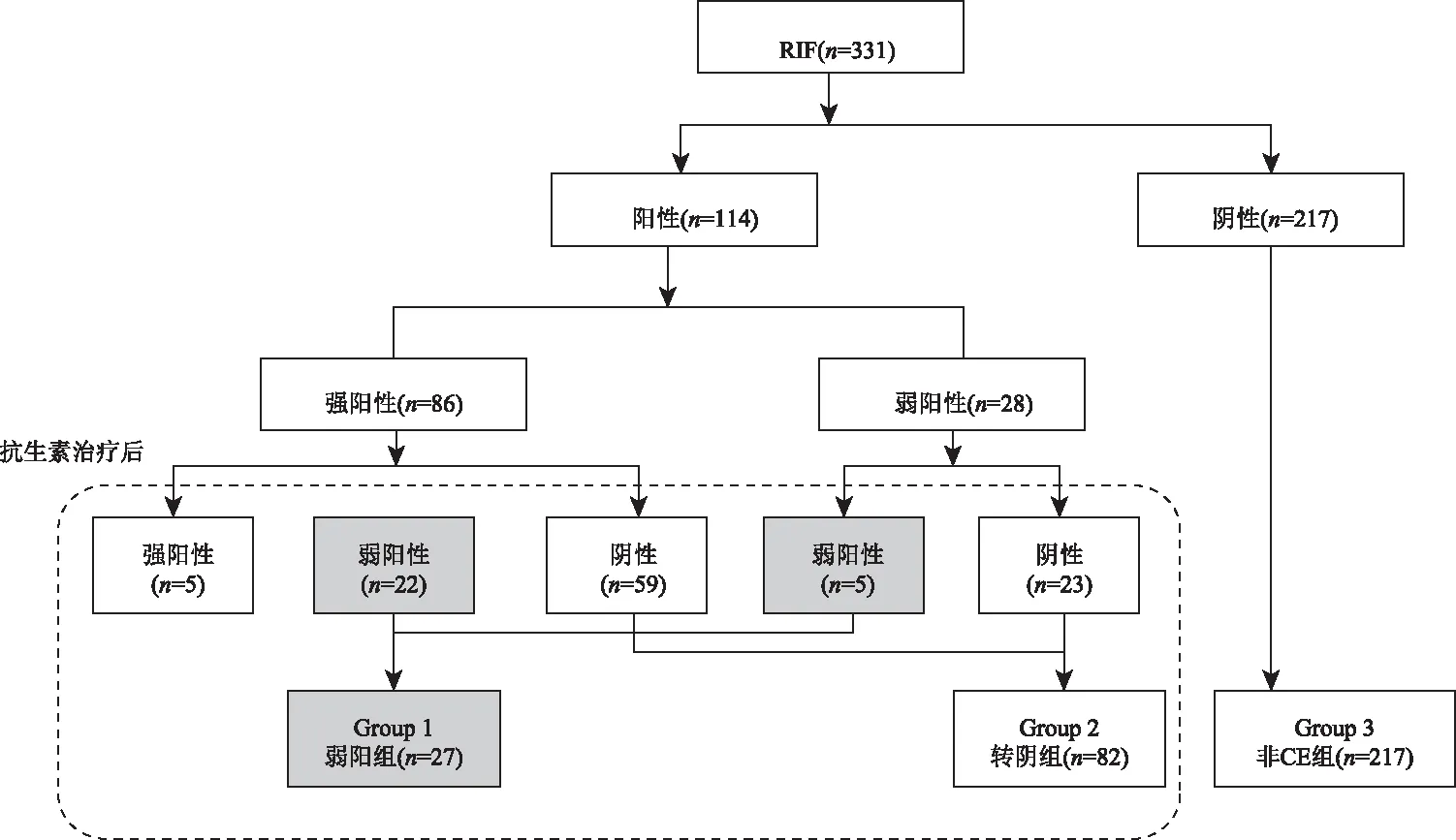
图1 RIF患者分组流程
二、3组患者的临床基本资料
分析3组患者基础资料显示,3组患者的年龄、BMI、AFC、AMH、不孕类型、既往移植周期数差异均无统计学意义(P>0.05)(表1)。
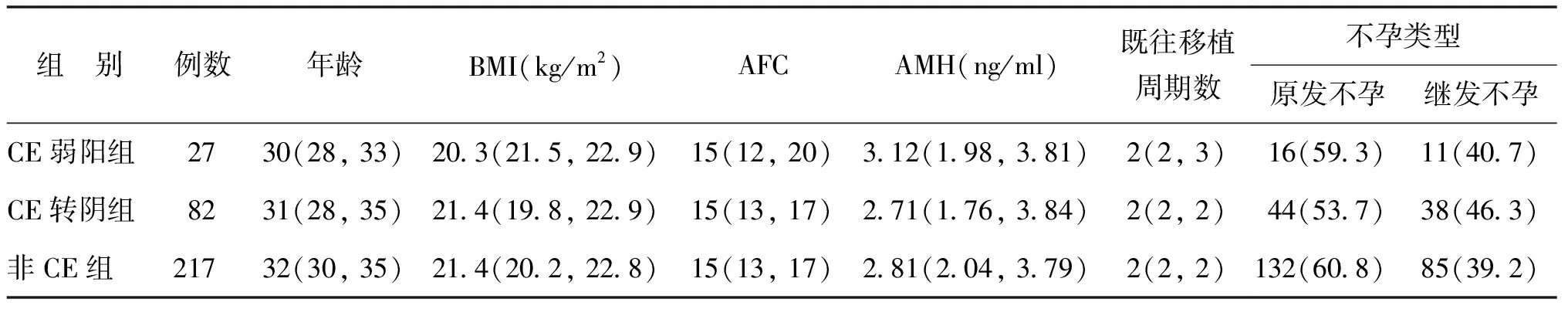
表1 三组患者基本资料比较[M(P25,P75),n(%)]
三、3组患者胚胎移植情况及妊娠结局
统计结果显示,3组患者行FET的周期移植胚胎个数及移植日内膜厚度均无显著性差异(P>0.05);妊娠结局比较中,与CE弱阳组比较,CE转阴组的HCG阳性率、临床妊娠率、着床率及活产率均显著升高(P<0.01),非CE组的HCG阳性率及着床率均显著升高(P<0.05);非CE组临床妊娠率及活产率高于CE弱阳组,但差异尚无统计学意义(P>0.05);CE转阴组与非CE组相比,HCG阳性率、临床妊娠率和流产率均显著升高(P<0.05),而临床着床率和活产率无显著性差异(P>0.05)(表2)。
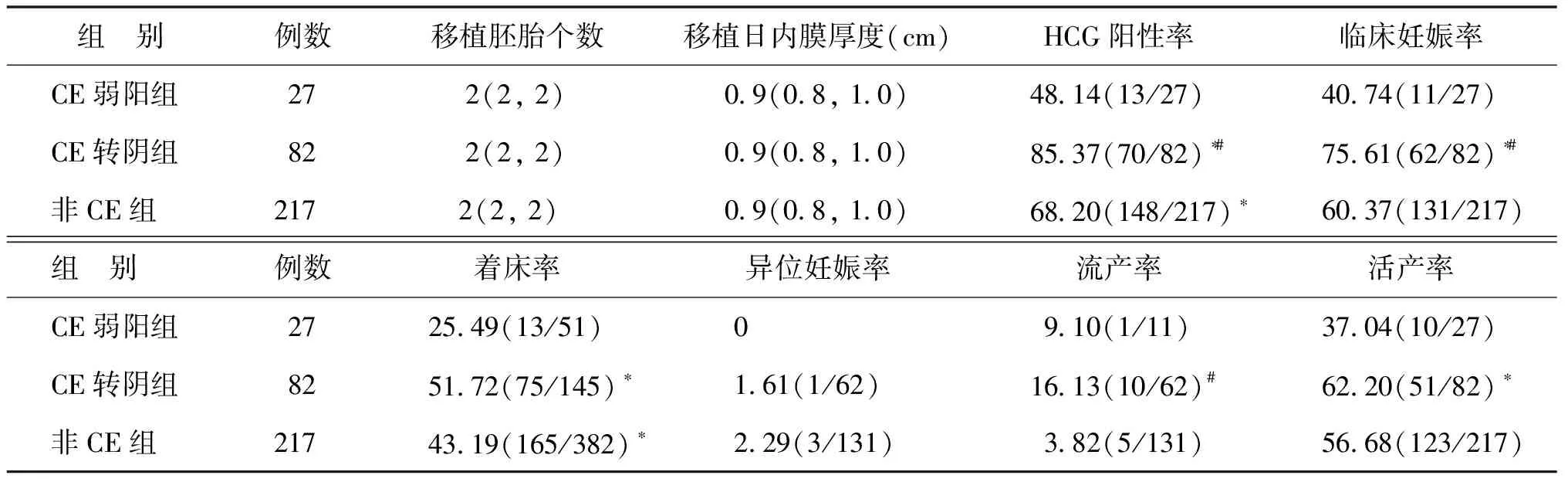
表2 三组患者冻胚移植临床妊娠结局比较[M(P25,P75),%]
讨 论
RIF一直是辅助生殖临床工作的热点问题,近年来临床上为改善原因不明RIF的妊娠结局,而逐步完善的治疗策略有个体化促排方案、实验室质量控制、移植方法的改进、以及免疫调节药物的使用[8]、宫腔内注射粒细胞集落刺激因子(granulocyte colony stimulating factor,G-CSF)[9]、自体外周血单核细胞(autologous peripheral blood mononuclear cells,PBMC)[10]或淋巴细胞主动免疫治疗、富血小板血浆(platelet-rich plasma,PRP)灌注[11-12]、子宫内膜容受性芯片检测[13]等等,但仍然有患者面临反复着床失败的困扰。最近有报道显示CE通过改变子宫内膜容受性影响胚胎着床,研究者认为女性子宫内膜间质本身存在一定量的浆细胞,但异常表达的浆细胞可能导致CE,从而影响胚胎植入,其机制可能为微生物感染宫腔释放致病原,导致子宫内膜上皮细胞、基质细胞和血管上皮细胞异常表达趋化因子和粘附因子,扰乱子宫内膜微环境。且外周血B细胞进入子宫内膜基质,一部分B细胞在基质内分化为浆细胞,另一部分B细胞迁移进入子宫内膜上皮和腺腔中,使子宫内膜窗口期发育延迟且子宫内膜容受态性相关基因及因子表达下降,降低子宫内膜容受性,导致胚胎着床失败[14]。此外有多项研究报道CE与IVE-ET妊娠结局密切相关[3,15-16]。
目前CE的诊断方法主要包括宫腔镜检查[17]、病理学HE染色结合CD138免疫组化法[18]、病原学培养[19]或测序[20]。CE在宫腔镜下表现为子宫内膜间质水肿、散在的直径小于1 mm的微小息肉、不规则的子宫内膜增厚以及伴发局部点状或弥漫性子宫内膜充血。病理检查可发现子宫内膜间质中存在异常浆细胞,但常规的HE染色是根据形态学寻找浆细胞,容易漏掉圆形浆细胞和纺锤形浆细胞,并且存在一定程度的主观判断偏差,影响CE的诊断。跨膜硫酸乙酰肝素蛋白多糖配体蛋白聚糖1即CD138是浆细胞特异性标志物之一,有效弥补HE染色形态学检查的不足,可将子宫内膜间质浆细胞的检出率由6%上升至52%[21]。子宫内膜病原学检查可发现主要致病菌为链球菌属、大肠杆菌属、粪肠杆菌属,其次为支原体[14]。这些检查方法为CE诊断提供了有益帮助,尤其CD138免疫组化法具有较高的灵敏度且便于开展,已广泛应用于临床上。
目前国内外对于应用CD138免疫组化的方法诊断CE的标准尚未完全统一,Bouet等[3]认为每10个高倍镜下子宫内膜间质中存在至少5个浆细胞可诊断为CE,其在RIF中检出率为14%,Cicinelli等[19]认为只要每张切片上有一个浆细胞出现,就可诊断为CE,其检出率为56.8%,Kitaya等[14]发现在278例具有正常生育功能的女性中,48.6%的女性子宫内膜间质中也存在一个以上的浆细胞,但多小于5个,而327例RIF中58.4%的患者子宫内膜间质中有浆细胞的存在,其中大于5个的有35.5%,提出需计算子宫内膜间质浆细胞密度大于等于0.25 情况下,可诊断CE,其发生率为34%。因此,以镜下见到CD138阳性浆细胞数还是子宫内膜间质浆细胞密度作为CE诊断标准,暂无共识,并且,内膜间质中CD138阳性的浆细胞有多少个需要进行治疗,目前尚无统一标准。本研究参考Zargar等[6]研究方法,以高倍镜视野下发现≥5个CD138+标记的浆细胞为阳性,且计数30个高倍镜视野,≥5个CD138+标记的浆细胞视野数≥3个为强阳性,≥5个CD138+标记的浆细胞视野数1~2个为弱阳性,镜下仅见到1~4个CD138标记的浆细胞或未见到浆细胞浸润,为阴性及非CE。本文CE强阳性、弱阳性及非CE,其在RIF中发生率分别为25.98%,8.46%,65.56%。
CE主要是因为宫腔内微生物感染所引起,临床上主要根据宫腔内细菌培养或微生物检测结果来进行针对性治疗,控制原发感染。然而,由于宫腔液体及子宫内膜细菌培养或微生物检测存在较大的局限性,目前临床对于RIF合并CE多采用经验性抗生素治疗。多西环素抗菌谱广泛,对支原体、革兰氏阳性球菌和阴性杆菌均有效,多项研究认为多西环素是治疗CE的一线药物,已被用于临床,并取得较好疗效推荐使用[4,22-23]。因此,本研究采用多西环素及针对厌氧菌的甲硝唑联用治疗CE,疗程结束后再次行黄体期子宫内膜CD138免疫组化检测结果显示5例患者持续强阳性,27例患者转为弱阳,82例患者转阴,转阴率为71.93%(82/114)。5例持续强阳性患者未行胚胎移植,27例弱阳患者、82例CE转阴患者、以及217例非CE患者再次行冻融胚胎移植的临床结局分析显示,经过治疗后CE转阴组HCG临床妊娠率及活产率得到明显改善,差异有统计学意义。但CE转阴组早期流产率较高,因此对于RIF仍需考虑胚胎因素,可行胚胎移植前遗传学检测。
综上,CE是导致RIF的重要因素,建议完善相关检查,病理学检查结合CD138免疫检测可提高检出率。同时本研究发现,CE阳性患者给予抗生素治疗后转阴可改善RIF患者临床妊娠结局,倡议多中心大样本研究CE镜下诊断标准的确立,避免遗漏或过度治疗。对于持续阳性者可考虑行子宫内膜菌群培养或DNA测序技术,以查明感染的病原微生物类别,有助于临床抗生素的精准使用。

