肺移植术后气道吻合口狭窄的诊治进展
刘明昭 史灵芝 杨航 卫栋 范立 吴波 陈静瑜
自首例获得远期成功的肺移植由加拿大多伦多总医院于1983年完成以来[1],气道并发症一直是影响肺移植术后并发症发生率和受者病死率的主要因素[2-3],特别是在20世纪90年代初,气道并发症的发生率高达60%~80%。受者选择、器官保存、外科技术、术后重症监护、免疫抑制、抗真菌治疗及内镜治疗等方面的改进,一定程度上降低了气道并发症的发生率,改善了肺移植的疗效,但气道并发症的发生仍然需要肺移植科医师的重视[4-6]。气道吻合口狭窄是最常见的气道并发症,而肺移植术后气道吻合口狭窄部位均为支气管,支气管狭窄通常在肺移植术后2~9个月出现,但也可能发生在数年后[7]。支气管狭窄不仅会导致移植后医疗费用明显增加,还会明显降低受者的生活质量,增加受者病死率。本文就肺移植术后气道吻合口狭窄病因及危险因素、诊断与治疗的研究进展做一综述。
1 气道吻合口狭窄的病因及危险因素
1.1 支气管吻合口局部缺血
肺移植术后气道吻合口局部缺血是造成支气管狭窄的一个重要原因。支气管血液供应通常来源于肺动脉和支气管动脉,肺移植术中支气管动脉切断后一般不予重建,因此支气管血供只能依赖于低压、低氧肺动脉系统的逆行血流。而供肺支气管经受者支气管动脉血运重建需长达4周的时间[8]。Dhillon等[9]报道了15例单肺移植受者术后1年后支气管血供情况,发现虽然术后肺动脉血液被分流到移植肺,但与自体肺支气管相比,供肺支气管仍表现出明显的缺氧。Kraft等[10]评估肺移植受者的气道缺氧反应时,检测到从手术时起一直持续到术后至少30 d供者支气管黏膜都存在氧饱和度的降低,且低氧反应基因如血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)及其受体KDR,在供者气道中显著上调,并与支气管狭窄相关。在新生血管形成之前,肺血流量减少或肺血管阻力增加都会加重供肺支气管缺血,导致支气管狭窄。
1.2 支气管吻合技术
支气管吻合技术对术后气管的愈合有显著影响。吻合技术的改进,如吻合口缝合技术,应用可吸收缝合线和缩短供者支气管等,降低了支气管吻合口狭窄的发生率[11-13]。主要的吻合技术包括膜部连续缝合和软骨部间断八字形缝合、可伸缩缝合、单纯连续缝合[14-15]。Schweiger等[16]对肺移植术后1 555例采用单纯连续缝合与其他吻合技术的结果进行比较时发现,单纯连续缝合更容易调整支气管之间的大小匹配,吻合更简单、快速和方便,吻合口狭窄发生率较低。同时,通过使用普迪思(polydioxanone,PDS)等可吸收缝线代替不可吸收缝线,可以显著降低吻合口狭窄的发生率。Samano等[17]在对手术吻合方式的回顾性研究(包括14例套叠吻合方式和57例端端吻合方式)中发现,与套叠吻合比较,端端吻合显著降低了气道并发症的发生率。van Berkel等[15]通过实施支气管叶间小嵴水平吻合来缩短供者支气管长度,48例受者中仅1例出现支气管狭窄,吻合口并发症发生率从8.2%降至2.1%。Choong等[18]在一项针对65例儿童肺移植受者的研究中,也采用供者支气管叶间小嵴水平吻合来缩短供者支气管长度。结果发现,与常规移植技术相比,缩短供者支气管术后1年受者气道并发症发生率显著降低(11.1%比2.6%)。目前,支气管端端吻合,吻合口尽可能靠近支气管叶间小嵴,是大多数中心的首选方式。
1.3 肺部感染
与其他实体器官移植不同,肺部不断暴露于外部环境中,能够直接接触病原体,而微生物污染极大地影响气道吻合口的愈合,最终导致支气管狭窄[19]。Nęcki等[20]对116例肺移植受者微生物学资料进行多因素分析,排名前4位的病原菌分别为白假丝酵母菌、曲霉菌、铜绿假单胞菌和耐甲氧西林金黄色葡萄球菌。多因素logistic回归分析显示曲霉菌显著增加了气道并发症的风险,同时使需要支气管镜介入治疗的气道并发症风险增加了3.35倍。高达8.6%的受者在术后1年内会发生真菌感染[21],其中曲霉菌定植被证明是支气管狭窄发生的危险因素[22]。即使肺移植术前使用无菌技术构建吻合口,气道微生物定植的发生仍可能导致支气管狭窄。术前气道微生物定植的管理和术后早期支气管感染的预防性治疗有助于降低支气管狭窄的发生率[11]。
1.4 急性排斥反应
支气管狭窄形成的病理生理过程涉及肉芽组织增生和管腔内组织纤维化,包括炎症介质的过度刺激和巨噬细胞对支气管内皮的募集[23]。肺移植受体支气管组织学变化的早期动物模型显示,在中度或重度排斥反应的情况下,供体支气管膜部和软骨部的黏膜都有单核细胞浸润,提示早期排斥反应和支气管狭窄之间的联系[24]。Ruttmann等[25]对10例肺移植术后吻合口狭窄受者进行危险因素分析时发现,早期排斥反应与支气管狭窄的风险增加有关。Castleberry等[24]对器官资源共享网络(United Network for Organ Sharing,UNOS)数据库中9 335例肺移植受者进行回顾性分析,发现早期急性排斥反应与支气管狭窄发生率增加有关,且支气管狭窄的受者术后肺功能和生存率较差。目前认为急性排斥反应和气道并发症之间存在一定的相关性,但还需要进一步的研究来验证。
1.5 其他危险因素
此外,还存在多个与支气管狭窄有关的危险因素,支气管血流受损可能是众多危险因素的最终共同途径[6]。(1)供、受者因素:供者在移植前的机械通气时间较长(>50~70 h)以及供、受者身高不匹配都是支气管狭窄的危险因素。心脏死亡器官捐献(donation after cardiac death,DCD)和脑死亡器官捐献(donation after brain death,DBD)肺移植受者气道缺血发生率差异无统计学意义。(2)低灌注:由于病理生理因素(低血压或低心输出量)或医源性因素导致的长时间低灌注可能会增加肺移植受者支气管狭窄的发生风险。(3)右侧支气管吻合口:右侧支气管吻合口在肺移植术后发生支气管狭窄的可能性是左侧支气管吻合口的2倍以上。(4)器官保存:器官保存与获取不当导致血管内皮水肿和再灌注损伤,减少了逆行支气管灌注,从而增加了缺血的风险,导致支气管狭窄。(5)机械通气:呼吸机支持的模式和时间都可能导致气道缺血,呼气末正压(positive expiratory end pressure,PEEP)对支气管黏膜血流量存在不利影响。(6)原发性移植物功能障碍(primary graft dysfunction,PGD):有些供肺出现肺泡损伤和血管通透性增加,导致间质水肿和肺血流量减少。重度PGD受者需要更长时间的机械通气以及更高的PEEP,进一步增加了支气管缺血风险。(7)供肺冷缺血时间:冷缺血时间延长不可避免地导致支气管缺血风险增加。Mendogni等[26]在对147例肺移植受者多因素生存分析中发现,当供肺冷缺血时间>600 min时,吻合口狭窄的风险显著增加。冷缺血损伤后,三磷酸腺苷(adenosine triphosphate,ATP)合成酶(复合体Ⅴ)也出现损伤,并通过线粒体诱导细胞凋亡,而过度的细胞丢失导致支气管管腔组织细胞纤维化重排和晚期支气管狭窄。
2 气道吻合口狭窄的诊断
国际心肺移植学会(International Society for Heart and Lung Transplantation,ISHLT)共识定义了气道吻合口狭窄的类型:(1)位于支气管吻合口或在吻合口2 cm范围内,称为中央气道狭窄(central airway stenosis,CAS);(2)位于吻合口远端或肺叶支气管的气道,称为远端气道狭窄(distal airway stenosis,DAS),可伴或不伴CAS[6]。DAS最常发生在支气管中间段,导致完全狭窄或中间段支气管消失综合征(vanishing bronchus intermedius syndrome,VBIS),发生率约为2%。气道吻合口狭窄分级及相应支气管镜下表现见图1[6]。无症状受者经常在气管镜随访检查中被诊断,有症状受者可能会出现呼吸困难、咳嗽、喘息、阻塞性肺炎或肺活量测定中的流速下降[7]。
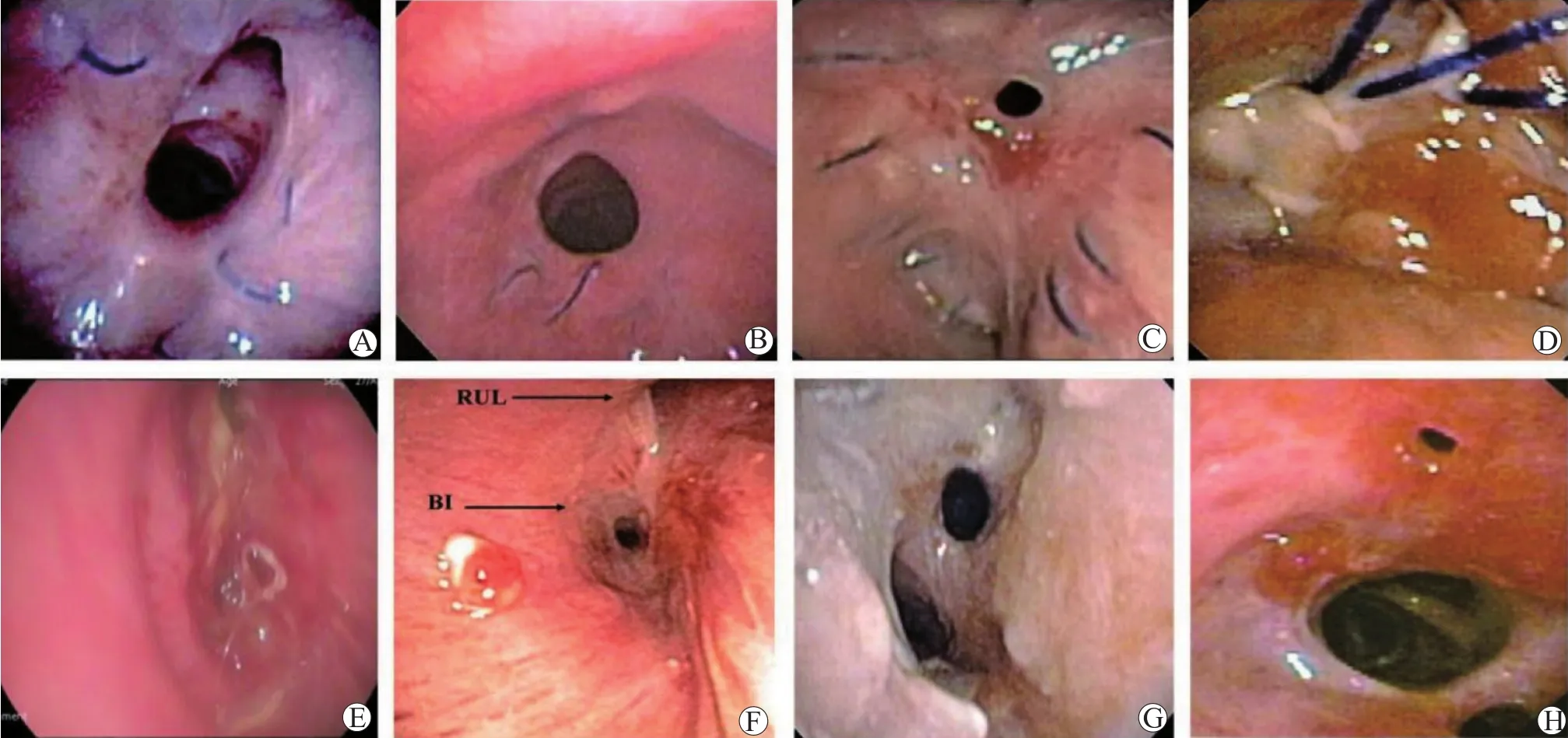
图1 气道吻合口狭窄的支气管镜下表现Figure 1 The bronchoscopy manifestation of airway anastomotic stenosis
气道吻合口狭窄的影像学表现为:(1)吸气和呼气图像上的支气管管腔狭窄;(2)吻合口狭窄或节段性非吻合口支气管狭窄;(3)节段性非吻合口支气管狭窄(包括VBIS),通常会影响支气管镜的介入治疗;(4)支气管内径缩小<50%(无症状的支气管狭窄)或>50%(有症状的支气管狭窄);(5)中、重度支气管狭窄阻塞后的改变包括肺不张和肺炎[27]。CT扫描成像可能是诊断支气管狭窄的敏感方法,但支气管镜检查仍是诊断的金标准。CT多平面重建可以获得有关远端气道的确切位置、结构长度和通畅性的更多信息,这有利于支气管镜介入治疗的实施[28]。Mendogni等[29]观察到支气管吻合口狭窄与常规自体荧光支气管镜检查检测到的红绿(red/green,R/G)比值延迟降低相关,建议在自体荧光成像R/G比值延迟降低的情况下引入严密的内镜监测,为支气管狭窄的早期诊断和及时干预提供参考。
3 气道吻合口狭窄的治疗
目前对肺移植术后气道吻合口狭窄的治疗通常根据支气管狭窄的程度和位置以及各中心的技术,选择不同的治疗方法。治疗策略包括球囊扩张、支气管内支架置入、激光、电灼、氩等离子体凝固和冷冻治疗。这些治疗方法可以单独进行,也可以联合进行。极少数情况下采用手术切除,部分受者可通过接受再次移植治疗难治性支气管狭窄。
支气管内扩张是治疗支气管狭窄的首选治疗方式,可以通过内镜球囊扩张、硬镜或探条来完成。球囊扩张是常规手术,尤其在出现炎症组织到形成纤维化结构期间,是治疗的首要选项[7]。清醒镇静下行支气管镜治疗是一种快速、安全的方法[30-31]。在轻度狭窄的情况下,大多数受者的症状都能立即改善。26%患有支气管狭窄的肺移植受者在球囊扩张后不需要支架置入[12]。多数情况下需要不止1次扩张手术,在考虑支架置入之前至少尝试2次。其他支气管内治疗方式,如冷冻、电灼或激光,可以单独实施或应用到球囊扩张中,特别是在有瘢痕组织的情况下。因支架置入存在高达50%的并发症发生率,因此主要用于严重和顽固性狭窄。45%的受者支架置入后能够长期维持较佳的气道管腔。支架的种类一般根据各中心的经验进行选择,以减少严重的并发症,支架的类型见表1[7]。

表1 治疗支气管狭窄的支架类型Table 1 Stent option for bronchial stenosis
对于顽固性狭窄,当内镜干预失败时,则需要手术治疗,但应尽可能保留肺实质。不同的手术方式都具有良好的预后,包括支气管吻合口重建、狭窄区域袖状切除、袖状肺叶切除、全肺切除和再次移植等[11]。但这些手术仍存在挑战性,因为受者接受免疫抑制治疗,一般功能状态也相对较差。也有一些中心将支气管黏膜下注射丝裂霉素C(mitomycin C,MMC)应用于肺移植术后支气管狭窄,并取得了良好的效果。Davidson等[32]在一项回顾性队列研究中,将11例接受MMC治疗的肺移植术后支气管狭窄受者纳入分析,发现支气管黏膜下应用MMC可减少支气管镜球囊扩张的需求。但还没有相关前瞻性研究或临床试验支持将其作为支气管狭窄的标准治疗方法。
4 小 结
气道吻合口狭窄是导致肺移植术后并发症发生率和受者病死率升高的重要原因。虽然气道吻合口狭窄的发生率低于其他常见的移植相关疾病,但其管理是临床医师面临的难题。反复住院和重复的支气管镜介入治疗,严重影响受者的生活质量。尽管在外科技术、免疫抑制策略和术后重症监护等方面已取得了重大进展,但肺移植术后气道吻合口狭窄的病因及危险因素仍未完全明确。关于治疗气道吻合口狭窄的最佳方法,仍需要大规模的随机对照研究继续探索。

