去氢骆驼蓬碱对线虫神经毒性机制的内源性代谢研究
孙倩倩,杜 裕,刘 明,宋星卓,邢彦焘,王析瑞,蒋坤秀,王 娜,刘永刚
(1.北京中医药大学,北京 102488;2.生物医学分析中心,北京 100850)
去氢骆驼蓬碱(harmine, HM),又称肉叶芸香碱,是一种三环β-咔啉类生物碱,主要来源于多年生草本蒺藜科骆驼蓬(PeganumharmalaL.),在骆驼蓬子中含量较高,具有抗菌、抗肿瘤、降血糖、抗氧化和抗寄生虫等药理活性[1-2]。但骆驼蓬子有毒,去氢骆驼蓬碱具有严重的神经毒性,会引起患者呕吐、震颤、幻觉甚至死亡,因此未应用于临床[3]。有研究表明[4],去氢骆驼蓬碱可能通过诱导小胶质细胞的活化,激活的小胶质细胞促使炎症因子释放增加,导致神经组织损伤。但是,目前对去氢骆驼蓬碱的神经毒性机制尚不明确。
秀丽隐杆线虫(Caenorhabditiselegans,C.elegans)属于线虫动物门动物。线虫作为模式生物,具有培养简单、易保存和传代、便于观察、遗传背景清晰和造模简单等优势[5-8]。线虫以尿嘧啶渗漏突变型大肠杆菌(E.coliOP50)为食,在培养箱中培养,且单个培养基上(直径9 cm)可存活几百条线虫,简单易行。线虫拥有简单但完整的神经系统,有利于深入研究人类神经系统结构和功能[9]。目前研究发现[10-11],可通过线虫的运动行为、摄食行为、乙酰胆碱酯酶、基因表达定量分析和神经元形态反映神经毒性。
代谢组学通过观察生物体系受刺激或干扰后,其代谢产物随时间的变化来研究完整生物体的功能和代谢[12]。通常采用高效液相色谱(HPLC)、液相色谱-质谱(LC-MS)、气相色谱-质谱(GC-MS)以及核磁共振(NMR)等高通量、高分辨和高灵敏度的分析手段研究生物体体液中的内源性代谢产物,并结合模式识别等化学信息学技术,分析生物体在不同状态下代谢指纹图谱的差异,获得相应的生物标志物群(Biomarkers),从而揭示生物体在特定时间、环境下的整体功能状态[13]。近年来,代谢组学技术被越来越多地应用于药物毒理研究领域,在揭示药物的毒性机制、识别与靶器官损害,尤其是与肝肾损害相关联的代谢生物标志物方面发挥着重要作用[14]。
本课题组前期研究表明[15],去氢骆驼蓬碱可以降低秀丽隐杆线虫的体长,神经毒性与能量代谢相关,但作用机制和通路并不明确。基于此,本实验将基于内源性代谢探究去氢骆驼蓬碱对秀丽隐杆线虫的神经毒性机制。
1 实验部分
1.1 主要仪器与装置
超高效液相色谱-四极杆-飞行时间质谱仪:日本岛津公司产品;TripleTOF6600 高分辨质谱仪:美国SCIEX公司产品;超低温冰箱、超净工作台:美国Thermo公司产品;生化培养箱:北京虹湖化工有限公司产品;体视显微镜:日本Nikon公司产品;高温高压灭菌锅:上海博迅医疗生物仪器股份有限公司产品;KQ100VDB双频数控超声波清洗器:昆山禾创超声仪器有限公司产品;电子天平:美国Ohaus公司产品;万分之一电子分析天平:瑞士Mettler Toledo公司产品;微量移液器:德国Eppendorf公司产品;智能数显恒温水浴锅:江苏金怡仪器科技有限公司产品;离心机、涡旋振荡器:赛普锐思科技有限公司产品。
1.2 主要材料与试剂
胰蛋白胨、酵母提取物、琼脂、蛋白胨、胆固醇、无水乙醇、次氯酸钠、二甲基亚砜(DMSO)等:北京虹湖化工有限公司产品;氯化钠、氯化钙、磷酸二氢钾、氢氧化钾、硫酸镁、磷酸氢二钠、氯化铵、氢氧化钠等试剂:兰博利德生物科技有限公司产品;甲醇、乙醇、甲酸、乙腈:质谱级,美国Fisher公司产品;去氢骆驼蓬碱:实验室自制;培养皿(直径3、6 cm):北京拜尔迪有限公司产品;野生型秀丽隐杆线虫(N2 Bristol):由遗传所丁梅老师惠赠。
1.3 实验条件
1.3.1色谱条件 色谱柱:ACQUITY UPLCTM HSS T3 柱(100 mm×2.1 mm×1.8 μm);柱温:40 ℃;进样量:3 μL;流动相:A为0.1%甲酸-水溶液,B为0.1%甲酸-乙腈溶液;流速:0.3 mL/min;梯度洗脱程序:0~1.5 min(1%B);1.5~13.0 min(1%~99%B);13.0~16.5 min(99%B);16.5~20.0 min(1%B)。
1.3.2质谱条件 电喷雾离子源(ESI),正、负离子模式下检测;数据采集方式为依赖采集模式 (IDA);全扫描一级谱图及二级谱图可以在一次分析中获得;质量扫描范围m/z50~1 000;质量偏差50 mu;离子源雾化气Gas1和辅助气Gas2压强均为50 Pa,气帘气压强35 Pa,温度500 ℃;喷雾电压 (ISVF) 5 500 V/-4 500 V,去簇电压(DP)80 V/-80 V,碰撞能量(collision energy)30±15 eV。
1.4 培养基(NGM)的配制
为保证线虫能够与药物充分接触,在NGM中补充对应浓度的去氢骆驼蓬碱,以DMSO作为空白对照。用DMSO溶解药物,配制成50 mmol/L母液,于4 ℃或-20 ℃保存,待NGM灭菌结束后,将配制好的药物母液与NGM混合,制成含去氢骆驼蓬碱浓度为160、300 μmol/L的培养液,然后倒入培养板中。将培养板置于室温下,待其凝固,将培养皿倒置,4 ℃保存,备用。
1.5 秀丽隐杆线虫的培养
无菌环境下,在培养基中接种50 μL缺陷型大肠杆菌(E.coliOP50)后,再放置于生化培养箱中1天用于培养线虫,秀丽隐杆线虫在培养基上生长发育,于22 ℃恒温培养箱培养。根据实验需要,大约3~4天转一次板,避免线虫过于拥挤或处于饥饿状态而进入dauer时期(该时期线虫为永久性幼虫),同时还需要保证线虫的干净,防止霉菌、细菌以及螨虫等污染。
1.6 暴露实验
在含有300 μmol/L去氢骆驼蓬碱的培养板上分别接种同步化后处于卵期、L4时期的秀丽隐杆线虫,卵期秀丽隐杆线虫在22 ℃下暴露72 h,L4时期秀丽隐杆线虫分为2组,分别暴露2 h和24 h,对照组为含300 μmol/L DMSO浓度的培养基。暴露结束后,用于后续实验,每个给药组和空白组至少含有5 000只秀丽隐杆线虫。
1.7 秀丽隐杆线虫样本的代谢物提取以及样品制备
用M9缓冲液收集不同浓度去氢骆驼蓬碱暴露1天后的秀丽隐杆线虫,静置3~5 min,弃去多余的M9,用800 μL 80%甲醇冲洗3次,然后用手持匀浆机充分匀浆(冰浴)。将研磨液在4 ℃下以12 000 r/min离心20 min,上清液转移至2 mL EP管中;再加入0.4 mL 80%甲醇提取1次,合并2次提取的上清液,在-20 ℃保存沉淀1 h,放置于离心机中,在4 ℃下以12 000 r/min离心15 min,吸取150 μL至新EP管,并备份1份。将样品与备份样品冷冻干燥(样品干燥时间3~5.5 h),于-20 ℃保存。进行UPLC-QTOF MS检测前,向每份样品冻干粉中加入100 μL乙醇-水(1∶1,V/V)混合液,反复吹打管底和管壁,使其充分混合均匀,常温下超声5 min,以14 000 r/min离心10 min;每个样品吸取2 μL上清液制备成质控样品(QC),吸取20 μL上清液至塑料上样管,将上样管样品转移至样品瓶中,按照空白、QC、待测样品的顺序依次放入上样品盘中,待UPLC-QTOF MS检测。
1.8 秀丽隐杆线虫内源性代谢物代谢组学分析
在网站(https:∥www.metaboanalyst.ca/MetaboAnalyst/faces/home.xhtml)进行信号通路的分析,分为以下几个步骤:1) 在MetaboAnalyst home界面,点击click here to start,进入模块选择页面;2) 在模块选择页面,选择Pathway Analysis模块;3) 上传数据,参数设置完成后,点击Submit;4) 对网页所显示的物质进行校对;5) 选择相应的物种以及数据库;6) 下载检测结果。
2 结果与讨论
2.1 秀丽隐杆线虫代谢物检测质谱条件
秀丽隐杆线虫代谢样品在正、负离子模式下的离子流图示于图1。通过总离子流图可以查看实验结果的稳定性,色谱峰重叠部分越多则表明稳定性越好。
2.2 秀丽隐杆线虫内源性代谢物代谢组学分析
秀丽隐杆线虫内源性代谢物的代谢通路示于图2。在信号通路分析结果中会出现代谢组视图,可以显示所有匹配到的通路,将鼠标放在每个节点上将显示其通路名称,单击每个节点将在右侧面板上显示对应通路。通路中,浅蓝色表示这些代谢物仅作为富集分析的背景信息,并未被匹配到;灰色表示该物质既不在数据中,富集分析时也不包括这些数据;其他颜色(从黄色到红色不等)表示代谢物在数据中具有不同的显著性水平。代谢物代码信息可以直接链接到京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes, KEGG)查找。
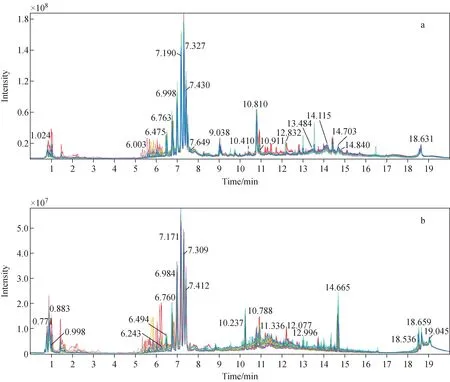
注:每个秀丽隐杆线虫样本重复3次进针;不同颜色代表不同线虫样本的不同进针图1 秀丽隐杆线虫代谢物在负(a)、正(b)离子模式下的离子流图Fig.1 Ion current chromatography of metabolite of caenorhabditis elegans in negative (a) and positive (b) ion modes
卵期给药的结果示于图2,图中所示编号信息列于表1。所涉及显著性水平较高的前3个通路有:嘌呤代谢通路、精氨酸和脯氨酸代谢通路以及烟酸酯和烟酰胺代谢通路。与空白组相比,嘌呤代谢通路中的ADP、cGMP、腺嘌呤、腺苷琥珀酸、鸟苷、鸟嘌呤、黄嘌呤5′-磷酸、肌苷、次黄嘌呤含量均下调,尿酸含量上调;精氨酸和脯氨酸代谢通路中,L-精氨酸、S-腺苷-L-蛋氨酸、L-脯氨酸以及L-谷氨酸盐含量均下调;烟酸酯和烟酰胺代谢通路中,烟酰胺D-核糖核苷酸以及烟酰胺含量均下调。
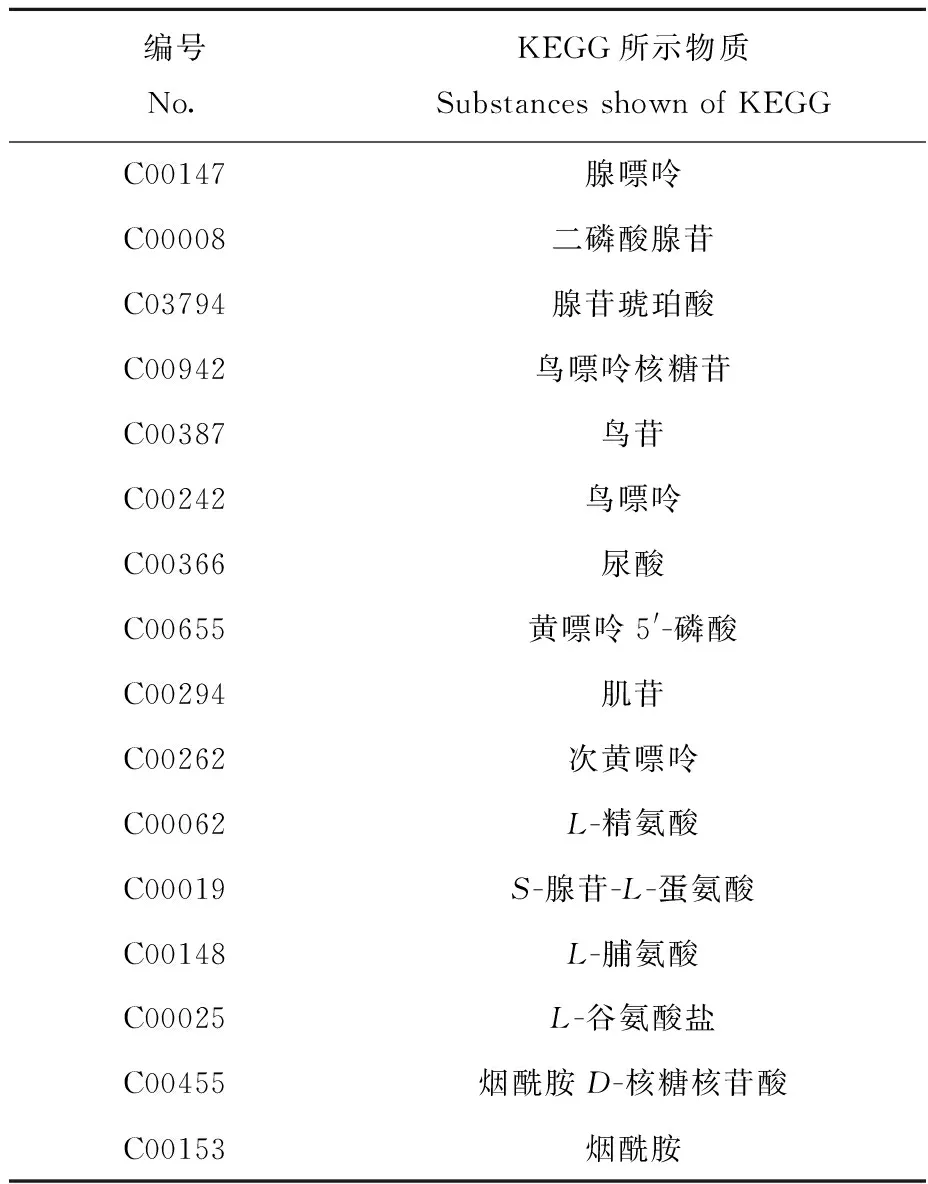
表1 卵期给药72 h涉及到的3个代谢通路有差异的代谢物信息Table 1 Specific information of the different metabolites of the 3 metabolic pathways after 72 h exposure during embryo
L4时期给药24 h所涉及到的通路结果示于图3,图中所示编号信息列于表2。所涉及显著性水平较高的前3个通路有:嘌呤代谢通路、氨酰基-tRNA的生物合成通路,以及烟酸酯和烟酰胺代谢通路。其中,与空白组相比,嘌呤代谢通路中腺嘌呤、黄嘌呤、鸟苷、鸟嘌呤、黄嘌呤5′-磷酸、肌苷以及ADP含量均下调,尿酸含量上调;氨酰基-tRNA的生物合成通路中,L-蛋氨酸、L-异亮氨酸、L-酪氨酸 、L-谷氨酸盐以及L-脯氨酸含量均下调;烟酸酯和烟酰胺代谢通路中,烟酰胺D-核糖核苷酸以及烟酰胺含量均下调。

表2 L4时期给药24 h涉及到3个代谢通路有差异的代谢物信息Table 2 Specific information of the different metabolites of the 3 metabolic pathways after 24 h exposure during L4 larva
L4时期给药2 h所涉及到的通路结果示于图4,图中所示编号信息列于表3。所涉及显著性水平较高的前3个通路有:苯丙氨酸、酪氨酸和色氨酸的生物合成通路,苯丙氨酸代谢通路以及嘌呤代谢通路。与空白组相比,苯丙氨酸、酪氨酸和色氨酸的生物合成通路中,L-酪氨酸和L-苯丙氨酸含量下调;苯丙氨酸代谢通路中,L-酪氨酸以及L-苯丙氨酸含量均下调;嘌呤代谢通路中,腺嘌呤、腺苷琥珀酸、鸟苷、黄嘌呤、黄嘌呤5′-磷酸、ADP以及cGMP含量均下调。

注:a.嘌呤代谢通路;b.精氨酸和脯氨酸代谢;c.烟酸酯和烟酰胺代谢通路图2 卵期给药72 h通路结果 Fig.2 Pathway results of 72 h exposure during embryo

续表2
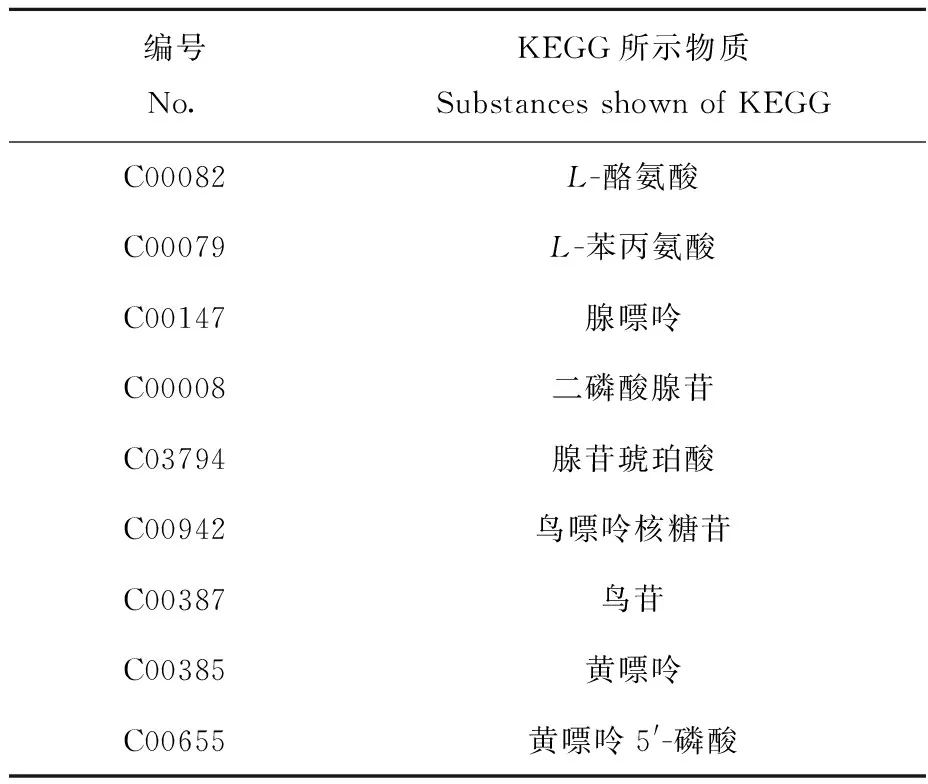
表3 L4时期给药2 h涉及到3个代谢通路有差异的代谢物信息Table 3 Specific information of the different metabolites of the 3 metabolic pathways after 2 h exposure during L4 larva
从以上结果可以看出,3个加药时期共同的通路是嘌呤代谢通路以及与氨基酸代谢相关的通路,且均与能量代谢相关。
在嘌呤代谢中,尿酸是人体嘌呤代谢的终末产物,尿酸含量过高可引起高尿酸血症等疾病。在3个给药时期中,除尿酸外,检测到所有变化的代谢物含量均下调,并且下调趋势几乎是:卵期给药>L4时期给药24 h>L4时期给药2 h。尿酸升高的原因可能是由于线虫嘌呤代谢的增加,使嘌呤等物质含量下调,导致尿酸生成过高,也可能是由于尿酸排泄减少。
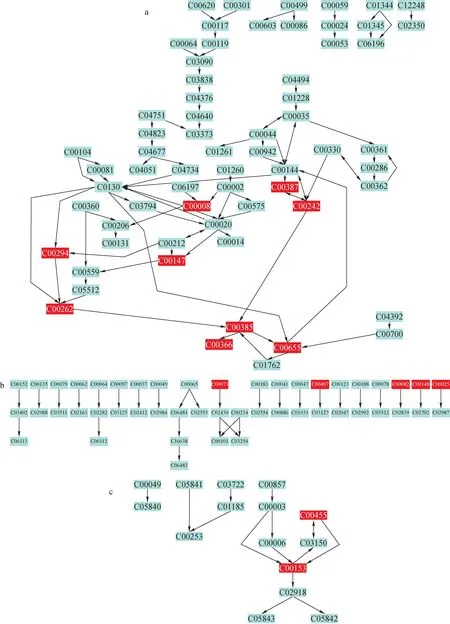
注:a.嘌呤代谢通路;b.氨酰基-tRNA的生物合成通路;c.烟酸酯和烟酰胺代谢通路图3 L4时期给药24 h的通路结果 Fig.3 Pathway results of 24 h exposure during L4 larva

注:a.苯丙氨酸,酪氨酸和色氨酸的生物合成通路;b.苯丙氨酸代谢通路;c.嘌呤代谢通路图4 L4时期给药2 h通路结果Fig.4 Pathway results of 2 h exposure during L4 larva
在氨基酸代谢通路中,所有涉及氨基酸代谢通路有变化的代谢物含量均下调。蛋氨酸缺乏时,可导致食欲减退、生长减缓、肝坏死。异亮氨酸减少也会引起食欲减退,影响肌肉蛋白质代谢。精氨酸减少会导致血氨过高,甚至昏迷,影响生长发育。
3 结论
本文建立了超高效液相色谱-四极杆-飞行时间质谱法分析去氢骆驼蓬碱的秀丽隐杆线虫神经毒性模型的代谢物以及代谢通路变化。结果表明,在去氢骆驼蓬碱的线虫神经毒性模型中,嘌呤代谢和氨基酸代谢等与能量相关的通路发生显著变化,嘌呤代谢通路中尿酸含量升高,腺嘌呤、腺苷琥珀酸、鸟苷、黄嘌呤等代谢物含量下调;氨基酸代谢通路中,蛋氨酸、异亮氨酸、精氨酸等含量下调,且下降趋势与给药时间成正相关。本研究提示能量代谢与神经毒性的相关性,为下一步阐释骆驼蓬总生物碱神经毒性机制提供了研究思路,也为骆驼蓬的体内安全性评价研究提供依据。

