响应面法优化紫丁香愈伤组织诱导条件及防褐化研究
郭彩珍
(吕梁学院生命科学系, 山西 吕梁 033000)
anti-browning agent
紫丁香(SyringaoblataLind.)别名丁香、华北紫丁香、百结、情客,具有较强的适应能力。紫丁香的叶和树皮均可入药;从紫丁香中提取的紫丁香苷有强烈的抗肝毒作用[1-2]。但因紫丁香是木本植物,相比较草本植物需要较长的营养生长期,这是利用传统育种方法改良其性状的主要障碍,所以木本植物的遗传转化远远落后于草本植物,而利用植物细胞离体培养技术对研究紫丁香的高频再生体系及高效遗传转化体系都有一定帮助[3]。
植物外植体在进行离体培养时,容易发生组织和细胞的褐化、玻璃化及枯死现象[4-5],会很大程度地影响组织细胞的生长繁殖以及其愈伤组织的诱导。关于紫丁香的栽培及化学成分的研究等方面已有过报道,但是对其外植体进行诱导愈伤组织方面的研究较少[6-7]。本试验以紫丁香为材料,从最佳外植体的筛选、愈伤组织诱导条件的优化及不同抗褐化剂对紫丁香茎愈伤组织诱导情况的影响方面进行综合研究,以期为紫丁香植物资源保护和愈伤组织的进一步开发利用提供一定的科学依据。
1 材 料
紫丁香采自吕梁学院校园内。采用的试剂为6-BA、NAA、2,4-D(均为分析纯);聚乙烯吡咯炕酮(PVP)、活性炭(AC)、柠檬酸(CA)。
2 方 法
2.1 紫丁香诱导愈伤组织的最佳外植体筛选
先将紫丁香的根、茎、叶和花用紫外灯灭菌30 min,后依次用75%酒精浸泡30 s、0.1%次氯酸钠消毒20 min、蒸馏水冲洗4~5次,将紫丁香叶、茎和花剪成0.5 cm×0.5 cm大小,根长大约为0.5 cm[5],然后在改良的MS+6-BA 0.5 mg·L-1+2,4-D 0.4 mg·L-1+NAA 0.3 mg·L-1培养基上进行接种,光照13 h·d-1,温度(23±2)℃,经过3周的培养后观察其愈伤组织的生长情况及诱导率:
诱导率(%)=(紫丁香诱导出愈伤组织的外植体数目/紫丁香共接种的外植体数)×100%,
同时观察愈伤组织生长状况:+++为生长非常好、++为生长较好、+为生长非常差,根据指标进行诱导紫丁香愈伤组织最佳外植体的筛选。
2.2 单因素实验
按表1中的激素浓度比例配置MS培养基,进行紫丁香茎愈伤组织诱导的单因素试验。进行3周的培养后观察其愈伤组织的质地、生长情况和愈伤组织数目,根据公式进行其诱导率的计算。
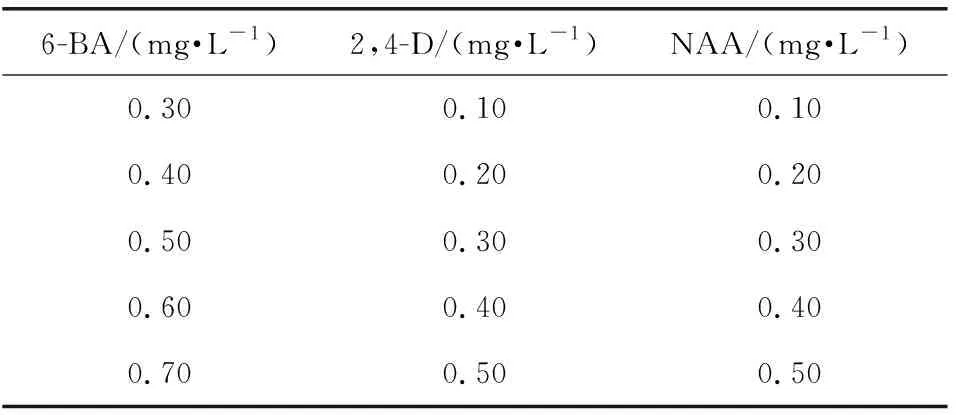
表1 单因素试验浓度
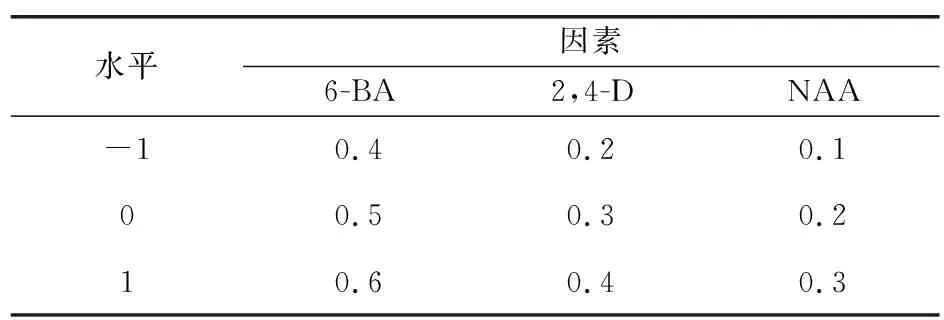
表2 响应面实验的因素和水平Table 2 Factors and levels of response surface experiments
2.3 响应面法优化紫丁香愈伤组织的诱导工艺
利用Design-Expert 8.0.6软件按照表2中的因素水平进行响应面实验,以紫丁香愈伤组织的诱导率为响应值,优化紫丁香茎愈伤组织诱导的工艺。
2.4 不同抗褐化剂对紫丁香茎愈伤组织诱导的影响
在经过响应面试验确定的最佳改良MS培养基中分别添加不同的抗褐化剂(AC、PVP、CA)见表3,对紫丁香茎愈伤组织进行诱导,观察3周后记录外植体褐化和愈伤诱导状况,从中选出其最佳的抗褐化剂。
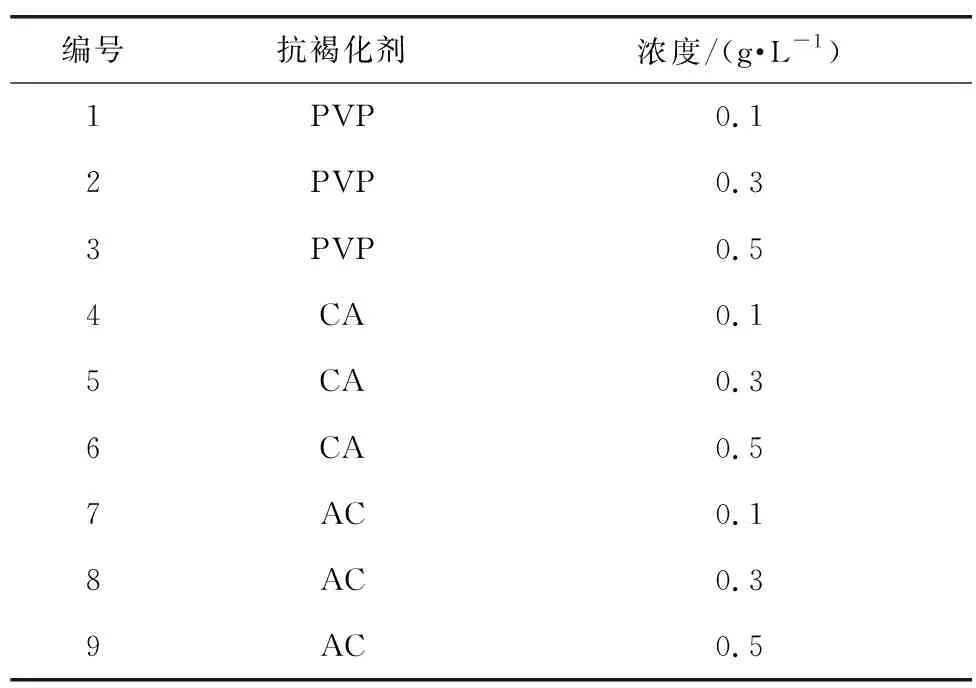
表3 不同浓度的抗褐化剂Table 3 Different concentrations of anti-browning agents
目视观察其愈伤组织的褐化程度:-表示培养基成半透明状,无褐化情况;+表示其切口处有褐色物质;++表示培养基有少许的变色,切口处有褐色物质;+++表示周围培养基大范围变色及发生严重褐变;++++表示培养基周围有深度黑色及发生严重褐变。
愈伤组织大小的判断标准:A是其愈伤的直径大于0.5 cm;B是其愈伤的直径大于0.3 cm;C是其愈伤的直径小于0.3 cm。
褐化率(%)=(愈伤组织发生褐化的数目/共接种的数目)×100%
3 结果与分析
3.1 最佳外植体筛选
将紫丁香4种外植体接种到改良培养基中,进行3周的愈伤组织诱导后发现,都可以成功诱导出其愈伤组织,但其愈伤组织间有较大差异。由表4可见,茎的诱导率最高,达83.3%,且褐化率较低及生长状况较好;叶诱导率为56.7%,褐化率为40%;根的诱导率较高,为73.3%,但褐化严重、生长状况较差;花的诱导率最低,为46.7%,但生长状况非常差。综合分析,诱导紫丁香愈伤组织的最佳外植体是茎。
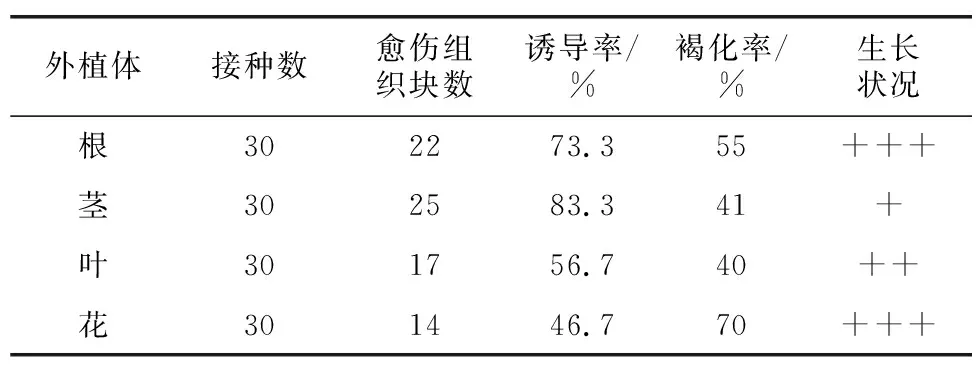
表4 不同外植体愈伤组织的诱导情况Table 4 Comparison of callus induction from different explants
3.2 单因素实验
3.2.16-BA对紫丁香茎愈伤组织诱导的影响
由表5可知,当2,4-D和NAA浓度一定,6-BA浓度达到0.5 mg·L-1时,紫丁香愈伤组织的诱导率最高,达76.7%,且愈伤组织生长状况非常好;当浓度低于或高于0.5 mg·L-1时,其诱导率呈下降趋势且生长状况较差。如果培养基中分裂素的含量超过一定值时,会相应抑制其愈伤组织的诱导[10]。因此,6-BA浓度为0.5 mg·L-1时紫丁香愈伤组织的诱导率最高且生长情况最好。

表5 6-BA对紫丁香茎愈伤组织诱导的影响Table 5 Effects of 6-BA on callus induction from S. oblata stem
3.2.22,4-D对紫丁香茎愈伤组织诱导的影响
由表6可知,当6-BA与NAA浓度一定,2,4-D浓度达到0.3 mg·L-1时,诱导率达到最高,愈伤组织的生长情况也是最好;但当2,4-D浓度低于或高于0.3 mg·L-1时,其愈伤组织的诱导率下降,生长状况较差。适度的生长素浓度会在一定程度上促进愈伤组织的形成,而如果生长素的浓度过高时又会升高多酚氧化酶的活性,使褐化加重[10-11]。因此,2,4-D浓度为0.3 mg·L-1时,紫丁香愈伤组织的诱导率最高且生长情况最好。
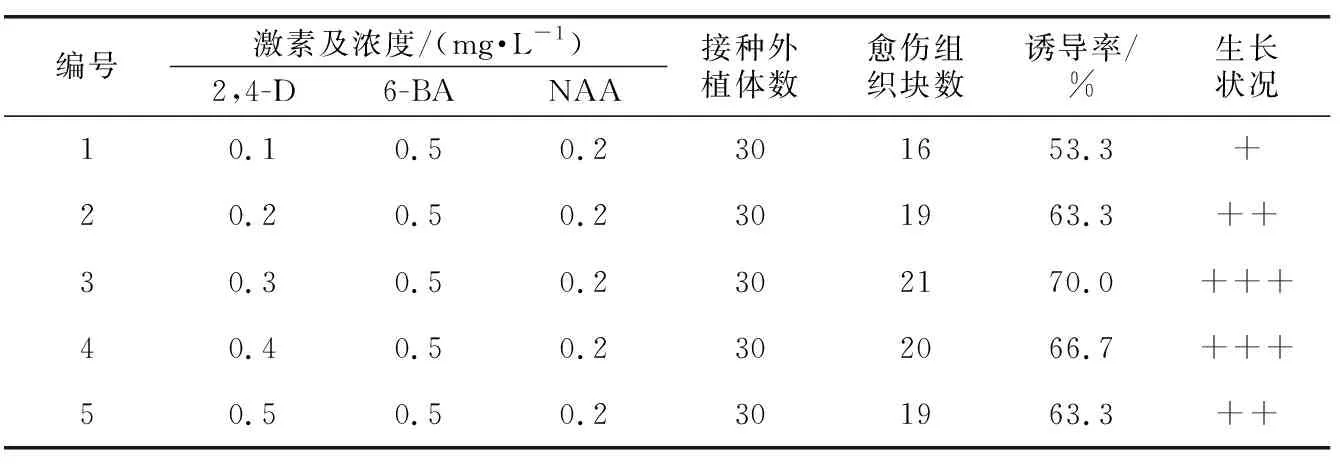
表6 2,4-D对紫丁香茎愈伤组织诱导的影响Table 6 Effects of 2,4-D on callus induction from S. oblata stem
3.2.3NAA对紫丁香茎愈伤组织诱导的影响
从表7可知,当2,4-D与6-BA浓度一定,NAA浓度为0.2 mg·L-1时,其诱导率达到最高;但当NAA浓度低于或高于0.2 mg·L-1时,其诱导率开始下降,愈伤组织的生长状况非常差。由此可见,紫丁香愈伤组织诱导的NAA浓度最佳为0.2mg·L-1。
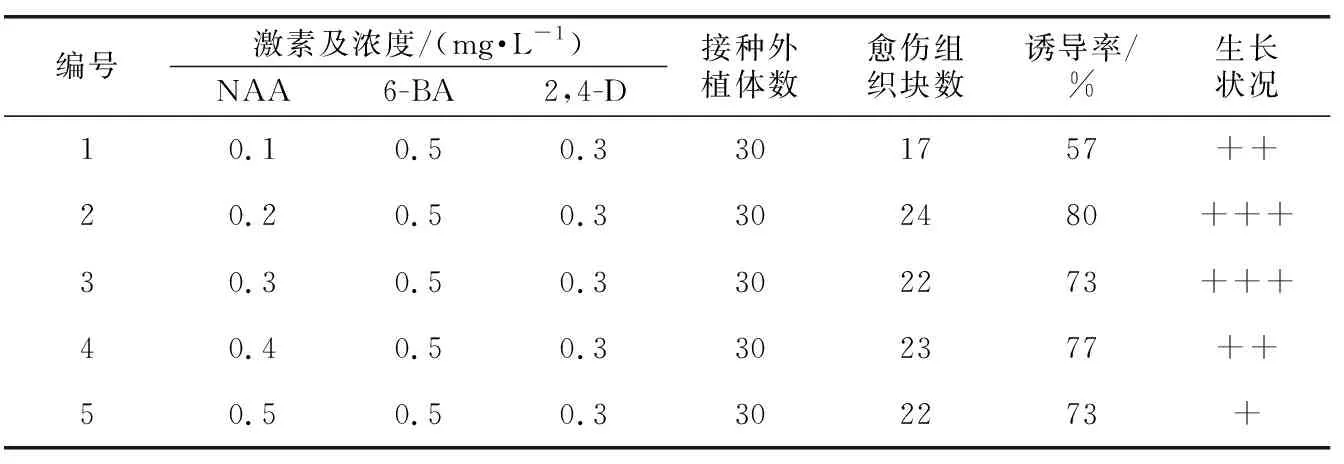
表7 NAA对愈伤组织诱导的影响Table 7 Effects of NAA on callus induction
3.3 利用响应面法对紫丁香茎愈伤组织的诱导工艺进行优化
3.3.1建立模型和方差分析
利用响应面法,根据Design-Expert 8.0.6软件建立3因素3水平的组合试验,优化紫丁香愈伤组织的诱导工艺,结果见表8。
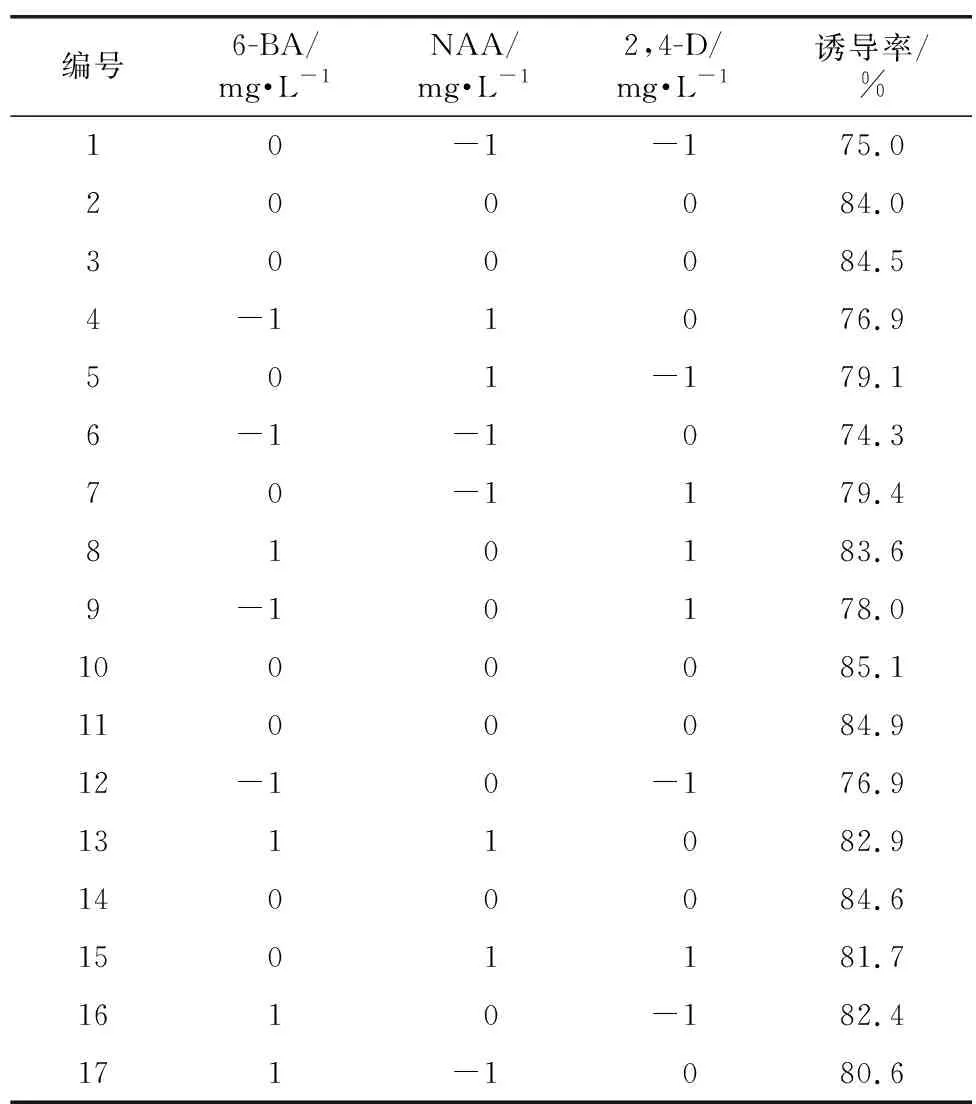
表8 响应面法试验数据Table 8 Tested data from response surface method
对表8的试验数据进行回归拟合后,得到其回归方程:
诱导率=-26.490 00+203.750 00×6-BA+266.650 00×2,4-D+93.600 00×NAA-7.500 00×6-BA×2,4-D+2.500 00×6-BA×NAA+67.500 00×2,4-D×NAA-172.750 00×6-BA2-427.750 00×2,4-D2-272.750 00×NAA2
根据方差分析和显著性检验的结果(表9)可知:该回归模型的p<0.000 1极显著,失拟项(p=0.164 8>0.05)不显著,表明该响应面的回归模型拟合度良好,能较好地预测和分析紫丁香愈伤组织的诱导率。其各影响因素都对愈伤组织的诱导率有显著影响但其影响大小不同,影响紫丁香愈伤组织诱导率的显著性顺序为6-BA>2,4-D>NAA。
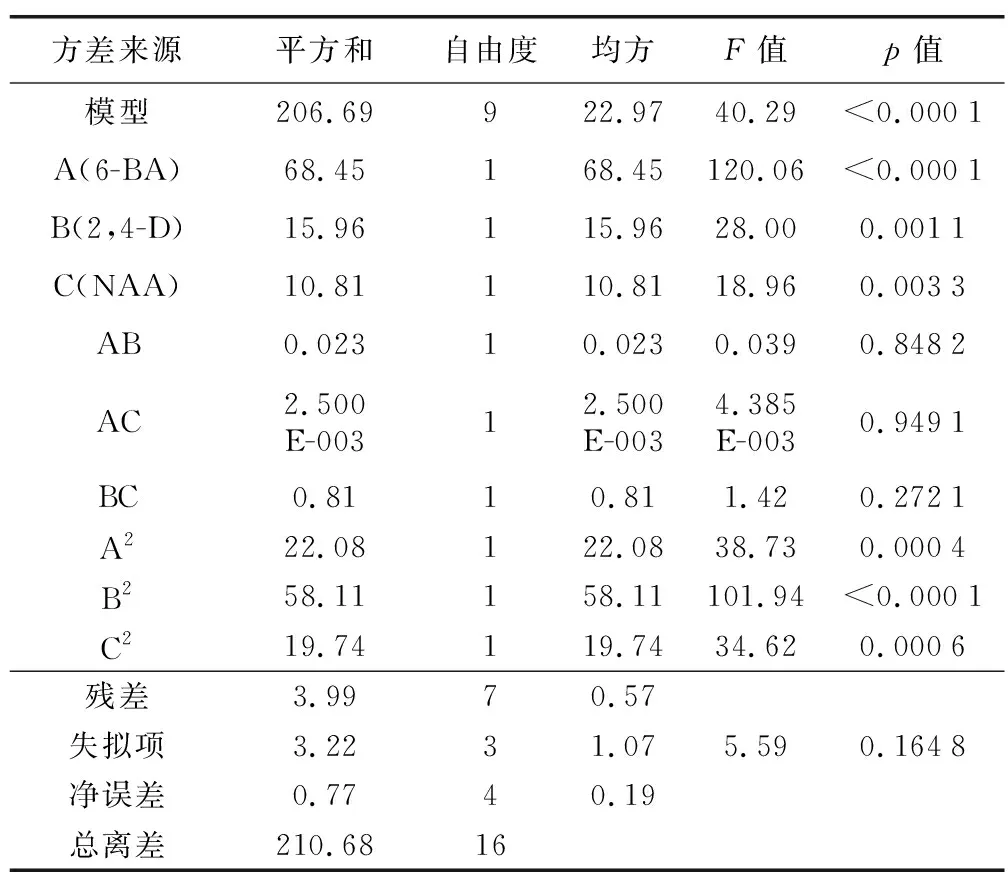
表9 方差分析Table 9 Variance analysis
3.3.2各影响因素的交互作用分析
紫丁香愈伤组织诱导率与各工艺条件之间的响应面和等高线见图1、图2、图3。
通过紫丁香愈伤组织诱导率与各工艺条件之间的响应面和等高线,可以反映出各因素之间的交互作用对其响应值影响的显著性,各因素间相互作用越强响应面的曲线越陡[8-9]。 图1、图2、图3表明,6-BA和NAA、NAA和2,4-D、6-BA和2,4-D之间的相互作用对其诱导率的影响相对较小,这个结论与方差分析的结果一致。
3.3.3模型的验证实验
根据软件对试验结果进行分析:诱导紫丁香茎段愈伤组织的最佳配比为6-BA浓度为0.5 mg·L-1,NAA浓度为0.2 mg·L-1,2,4-D浓度为0.3 mg·L-1,在此条件下重复3次试验,其诱导率平均为84.5%。由此可知通过响应面法优化诱导条件的参数可靠,可用于实际操作。
3.4 抗褐化剂对紫丁香茎愈伤组织诱导情况的影响
抗褐化剂的种类和浓度对紫丁香茎愈伤组织生长状况的影响见表10。3种抗褐化剂对其生长情况都能产生一定影响,紫丁香外植体褐化程度为AC 表10 抗褐化剂种类和浓度对愈伤组织生长的影响Table 10 Effects of types and concentrations of anti-browning agents on callus growth 试验结果表明,紫丁香茎段为愈伤组织诱导的最佳外植体;其诱导愈伤组织的最佳培养基为:MS+6-BA 0.50 mg·L-1+2,4-D 0.3 mg·L-1+NAA 0.2mg·L-1;紫丁香茎愈伤组织诱导的最佳抗褐化剂是浓度为0.2 g·L-1的CA。 植物生长激素在诱导愈伤组织的过程中起到非常重要的作用,而生长激素种类和含量不同,其诱导愈伤组织的影响也不同[10];褐化问题在愈伤组织培养过程中普遍存在,这两方面都对诱导外植体的脱分化和再分化有重大影响[11]。在本次试验中发现3种植物生长调节剂及其不同浓度对紫丁香愈伤组织的影响是有差异的;PVP与AC作为无机吸附剂,其吸附性较好,能够防止植物体自身酚类物质的排出。而CA是抗氧化剂,可以通过改变周围的氧化还原电势而抑制酚类物质氧化,但是具体的作用机理还有待进一步研究。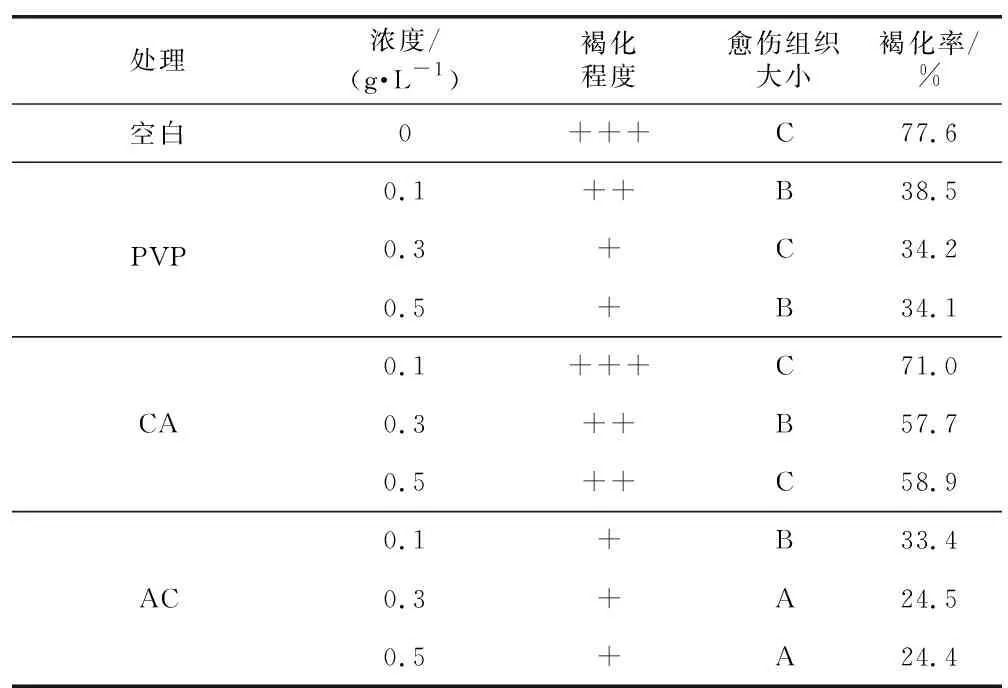
4 结论与讨论

