腹腔镜与开腹脾切除术治疗原发性脾肿瘤的临床效果比较
胡春东,郑立平,王 兢,吴 斌,费发明,吴绍汉,沈亦钰
(嘉兴学院附属第二医院肝胆外科,浙江 嘉兴,314000)
原发性脾肿瘤临床发病率低,早期无明显典型临床症状与体征,常在体检时发现,而脾脏切除为明确诊断与后续治疗提供了可靠依据[1]。随着对脾脏解剖的认识及腹腔镜技术的不断发展,临床开展腹腔镜脾切除术(laparoscopic splenectomy,LS)治疗原发性脾肿瘤越来越受到关注。与开腹脾切除术(open splenectomy,OS)相比,LS具有创伤小、疼痛轻、康复快、住院时间短等优点。本文回顾分析近9年我院采用LS与OS治疗原发性脾肿瘤的临床资料,探讨LS治疗原发性脾肿瘤的可行性与临床疗效。
1 资料与方法
1.1 临床资料 收集2011年1月至2019年12月我院肝胆胰外科收治的52例原发性脾肿瘤患者的临床资料,其中男30例,女22例;23~72岁,平均(46.9±12.3)岁。病理类型:(1)良性肿瘤:海绵状血管瘤18例,脾囊肿13例,错构瘤7例,动脉瘤4例;(2)恶性肿瘤:恶性淋巴瘤9例,淋巴肉瘤1例。21例患者主诉左上腹部不适,2例主诉恶心、呕吐,2例表现为左上腹部肿块;27例无明显症状。术前行腹部超声、增强CT或增强MRI检查,诊断为原发性脾肿瘤,病变大小3~6 cm(图1),未见明显周围淋巴结肿大及其他脏器转移。患者均无腹部手术史,32例行LS(LS组),20例行OS(OS组)。两组患者一般资料差异无统计学意义,见表1。

表1 两组患者一般资料的比较
1.2 手术方法
1.2.1 LS组 术前留置胃管及导尿管,气管插管全身麻醉成功后患者取头高脚低右侧斜卧位,一般为15°~30°,根据腹腔镜探查结果决定右侧倾斜角度,以能充分显露脾脏、便于操作为原则。脐下缘穿刺10 mm Trocar作为观察孔,建立CO2气腹,压力维持在13 mmHg,置入30°斜面腹腔镜,左锁骨中线与脐水平线交界处上方2 cm处穿刺12 mm一次性塑料Trocar为主操作孔,剑突下2 cm及左侧腋前线穿刺5 mm Trocar为辅助操作孔。观察脾脏大小、形态及与周围组织的粘连情况(图1),用超声刀游离脾胃韧带、脾结肠韧带、脾肾韧带及脾膈韧带,抬起脾脏后,先后分离脾动静脉的二级分支(图2、图3),Hem-o-lok闭合后用超声刀离断,切割闭合器(Endo-GIA)或血管闭合器系统(LigaSure)离断脾蒂(图4),完整切除脾脏,将脾脏放入特制标本袋内,通过延长脐下切口取出,尽量保持脾脏完整或组织成大片状,立即送术中冰冻病理检查,如提示恶性肿瘤,则行脾门周围淋巴结清扫。冲洗术野,查无活动性出血后吸尽积液,放置脾窝腹腔负压引流管(直径5 mm)1根,自左侧腋前线Trocar孔引出并固定。术后观察引流液量与性质,同时动态监测引流液淀粉酶。
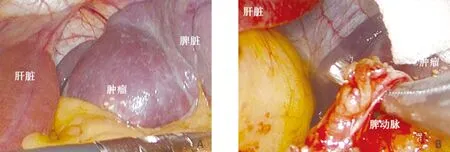
图1 探查肿瘤位于下极,突出脾脏表面 图2 游离解剖脾动脉
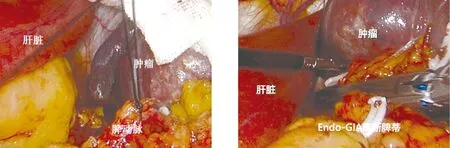
图3 结扎脾动脉 图4 应用Endo-GIA离断脾蒂
1.2.2 OS组 麻醉同LS组,于左上腹部肋缘下做约20 cm斜切口,逐层入腹,游离脾胃韧带、脾结肠韧带、脾肾韧带及脾膈韧带,最后处理脾蒂,取出脾脏,放置引流管并关腹。
1.3 评价指标 (1)手术相关指标:对比分析两组手术时间、术中出血量、术后进食时间、术后住院时间、术后疼痛评分。采用视觉模拟评分法评估疼痛情况(0=无痛,10=最痛)。(2)术后并发症:术后出血、切口感染、腹腔积液、胰瘘、门静脉血栓等发生率。(3)远期效果:以门诊复查与电话访谈相结合的方式进行随访。患者于术后1个月门诊复查,此后每半年随访1次,两组患者术后复查血常规、生化系列、血凝、D-二聚体、肿瘤标志物及腹部彩超,必要时复查全腹部CT,观察术后两组远处转移、切口与局部复发情况。

2 结 果
2.1 两组手术相关指标的比较 LS组中31例顺利完成手术,1例由于脾脏周围炎症与周围组织粘连致密,中转开腹,OS组均顺利完成。LS组手术时间长于OS组(P=0.023),术后住院时间(P=0.012)、术后疼痛评分优于OS组(P=0.031),差异有统计学意义;两组术中出血量、术后进食时间差异无统计学意义(P>0.05)。见表2。

表2 两组患者手术相关指标的比较
2.2 两组术后并发症的比较 两组术后出血、切口感染、腹腔积液、胰瘘及门静脉血栓的发生率差异无统计学意义(P>0.05),见表3。术后发生出血时,先采取保守治疗,若出血量较大,再手术止血;切口感染经换药或清创等处理,多于1周内好转;少量腹腔积液无需处理,合并腹胀或发热等症状时,可行超声引导下穿刺引流;胰瘘的处理与腹腔积液处理类似,采用穿刺引流,均恢复良好。

表3 两组患者术后并发症发生率的比较[n(%)]
2.3 两组手术远期效果的比较 术后51例患者获得随访,1例淋巴肉瘤患者失访。42例良性脾肿瘤患者均无复发;9例脾淋巴瘤患者,经血液科采用CHOP方案(环磷酰胺、长春新碱、强的松)或MOPP方案(氮芥、长春新碱、甲基卞肼、强的松)化疗,随访无远处转移及戳孔、切口、局部复发,无死亡。
3 讨 论
原发性脾肿瘤临床较少见,文献报道[2],其发病率约0.03%。早期缺乏典型临床症状,常于体检时发现,随着肿瘤的不断增大,常出现左上腹不适、疼痛、腹部肿块等症状。Morgenstern等[3]根据组织来源将脾肿瘤分为4类:(1)类肿瘤性病变:错构瘤、非寄生虫囊肿;(2)血管源性肿瘤:血管瘤、淋巴管瘤、血管内皮细胞瘤、血管外皮细胞瘤等;(3)淋巴源性肿瘤:霍奇金病、非霍奇金淋巴瘤、滤泡假性淋巴瘤、炎性假瘤等;(4)非淋巴肿瘤:脂肪瘤、平滑肌肉瘤、恶性畸胎瘤、恶性纤维组织细胞瘤等。其中良性病变多见,占60%~76%,以血管瘤最为常见,恶性肿瘤又以恶性淋巴瘤为多见[4],恶性肿瘤实验室检查时常出现外周血淋巴细胞比例增高,少数患者合并贫血,通常影像学检查鉴别良、恶性脾肿瘤比较困难,而脾脏细针穿刺活检有助于术前确诊,但有一定的并发症,可能引起脾脏出血及脾脏肿瘤的扩散[5]。术前可行骨髓穿刺,以此鉴别血液性疾病,因此,早期脾切除非常重要,可达到诊断与治疗的目的[6]。
1991年Delaitre等[7]首次开展LS,随着腹腔镜技术与器械的不断发展,LS也得到了快速开展,与OS相比,具有住院时间更短、切口更小、疼痛更轻、恢复正常生活更快等优点。Musallam等[8]指出,与OS相比,LS虽然手术时间延长,但住院时间短,术后并发症无明显差别,本文数据支持这一结论。本研究中LS组手术时间长于OS组,主要是因为术中精细化处理脾脏血管,以免术中出血影响术野;术后疼痛评分、住院时间优于OS组,主要因手术切口小、微创,康复快。近年,LS成为治疗良性或恶性血液系统疾病的标准术式[9],而LS治疗脾肿瘤主要应用于良性肿瘤,治疗恶性肿瘤仍存在争议,考虑脾恶性肿瘤脾门及脾周淋巴结清扫存在困难,但腹腔镜下淋巴结清扫具有高清、放大术野等优点,随着腹腔镜胃癌根治术中No.10、11组淋巴结清扫及腹腔镜胰体尾癌根治术等技术的不断发展,清扫脾门及周围淋巴结已完全可行[2]。2008年欧洲内镜外科协会将LS作为脾切除疾病治疗的金标准,不论血液系统疾病抑或脾脏肿瘤,均建议在全腹腔镜方式下完成,LS成为脾切除术的标准术式[10]。
LS成功的关键是预防与避免术中出血[11],而脾蒂的妥善处理最为关键,如果脾蒂处理不当,容易造成大出血影响手术操作。目前处理脾蒂常用方式有4种[12]:(1)一级脾蒂离断法:采用Endo-GIA离断脾蒂,此操作简便,技术难度小,但存在以下危险:枪钉脱落引起出血,损伤胰尾引起胰瘘。(2)LigaSure离断法:LigaSure可凝闭7 mm内的动静脉血管,为增加安全性,仍需游离一定长度的血管,严格意义上亦属于下文的二级脾蒂离断法。(3)圈套器双重结扎法:此方法需游离脾蒂,再套入结扎线结扎脾蒂,耗时费力,已很少使用。(4)二级脾蒂离断法:应用超声刀先后游离脾动、静脉的二级分支,再用Hem-o-lok分别夹闭后离断,此方法国内外较多采用,可更好地清扫脾门部淋巴结及脂肪组织,并减少胰尾的损伤。而术后出血的常见原因是结扎线脱落或夹子闭合不牢,若处理不及时可导致不良后果,胰瘘的发生常与使用Endo-GIA或LigaSure切割脾门时脱钉、闭合不牢、损伤胰腺有关;一般击发Endo-GIA或LigaSure前先用无损伤钳夹住脾蒂近端,避免移位从而损伤胰腺。我们的经验是在术中按先易后难、由下至上、由浅入深的原则进行,根据术中情况选择。对术前脾肿瘤良、恶性诊断不明的患者,应行术中冷冻切片检查,以明确是否行区域淋巴结清扫[13]。
虽然本文为回顾性研究,样本量不大,需进一步研究验证腹腔镜技术在脾脏恶性肿瘤中的应用,但国内多个医疗中心数据均证实LS安全、有效及可行[14-15]。腹腔镜具有高清、放大术野的作用,与传统OS相比,LS创伤小、康复快、住院时间短,易于被患者接受,应用前景十分广阔。

