选择性雌激素受体调节剂对高糖血症大鼠胰腺组织氧化损伤等的影响
张昊旻 乔炳龙 李超 齐卫红 卢彩霞 孙平
(1 青岛大学附属医院产科,山东 青岛 266003; 2 诸城市妇幼保健院产科;3 青岛大学附属医院放射科; 4 青岛市第三人民医院产科)
妊娠期糖尿病(GDM)为妊娠期常见的代谢紊乱性疾病,严重威胁孕妇及胎儿身体健康[1]。GDM患者不仅子痫前期的风险增加,而且在以后的生活中患2型糖尿病和心血管疾病的风险也会增高[2-4],其后代在青春期和成年早期更容易发生糖耐量受损及心血管系统疾病[5]。全世界GDM发病率呈逐年上升趋势,受到越来越多国内外学者关注。国际糖尿病联合协会(IDF)2019年的统计结果显示,全球范围内约1/6新生儿受到孕期高糖血症的影响[6]。然而,由于妊娠期的特殊性,孕妇除了控制饮食和适量运动的生活方式干预,以及偶尔的胰岛素治疗之外,GDM没有更为有效的治疗和预防策略[7-8]。
GDM临床过程复杂,其具体发病机制至今尚未十分明确。研究表明,多种因素可引起GDM的发生,如胰岛素抵抗、胰岛β细胞功能缺陷及妊娠期激素分泌异常等[9]。雌激素是女性体内最重要的类固醇激素之一,在调节机体代谢中发挥着重要作用,其中雌二醇(E2)是妊娠期胎盘合成和分泌的主要激素之一,在女性血糖代谢中具有重要功能[10]。雌激素需要与ER结合后激活经典的信号传导途径,发挥多种雌激素效应。ER包括ERα和ERβ两种亚型,其中ERα参与介导多数雌激素效应,特别是雌激素对血糖代谢的调节[11],ERα基因的异常表达可能参与GDM的发生发展[12]。此外,ERα基因敲除的小鼠可有葡萄糖耐量的改变,表明ERα在胰岛素调控葡萄糖稳态中发挥重要作用[13],但具体的作用机制尚不明确。糖类代谢紊乱造成血糖浓度长期偏高,引起高糖血症,持续或波动性高糖环境导致线粒体产生大量活性氧,造成细胞氧化应激损伤和细胞死亡[14]。铁死亡是近年新发现的一种调节性细胞死亡方式,常伴随细胞铁含量和活性氧的积累,被证明与多种疾病的发生发展有关,而铁死亡在高糖血症发生过程中的作用尚不明确。本研究旨在通过构建链脲佐菌素(STZ)诱导的高糖血症大鼠模型,探讨选择性ER调节剂对高糖血症大鼠胰腺组织氧化损伤等的影响。
1 材料与方法
1.1 材料
1.1.1实验动物 清洁级雌性SD大鼠24只,雄性SD大鼠12只,体质量180~220 g,购自湖北省疾病预防控制中心。在室温23~25 ℃、相对湿度65%~70%、12-12 h循环光照环境中饲养。动物实验符合青岛大学附属医院动物伦理委员会制定的标准,并通过我院委员会批准。
1.1.2试剂及设备 过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)活性测定试剂盒(南京建成生物工程研究所),STZ(美国Sigma公司),ELISA试剂盒(武汉依莱瑞特生物科技股份有限公司),兔抗-长链脂酰CoA合成酶4(ACSL4)、ERα、谷胱甘肽过氧化物酶4(GPX4)抗体均购买自中国Abclonal公司,兔抗-铁蛋白重链1(FTH1)抗体购买自美国Affinity公司,兔抗-GAPDH抗体(杭州贤至生物科技有限公司),ECL化学发光试剂盒(北京普利莱基因技术有限公司),逆转录试剂盒(日本TaKaRa公司),自动生化分析仪(日本Hitachi公司),ABI PRISM 7900 PCR仪(Applied美国Biosystems公司)。
1.2 方法
1.2.1动物分组及干预 大鼠经标准饮食适应性饲养1周后,按照雌雄2∶1比例合笼过夜,次日清晨将其分开,雌性大鼠阴道分泌物中镜检观测到精子者确定为孕鼠,记做妊娠D0。随机选取6只孕鼠为正常对照组(A组),常规标准饲养。对剩余孕鼠腹腔注射STZ溶液(45 mg/kg),24 h后空腹尾部采血检测血糖浓度,以血糖浓度>11.1 mmol/L为高糖血症大鼠模型制备成功。取18只模型制备成功的大鼠随机分为高糖血症模型组(B组)、他莫昔芬(TAM)低剂量组(C组)及TAM高剂量组(D组),每组6只。B组大鼠不做任何处理,标准饲养,C、D组大鼠每天分别腹腔注射2.5、5.0 mg/kg的TAM进行药物干预处理,14 d后断颈处死所有大鼠,取大鼠胰腺组织样本进行后续实验。
1.2.2实时荧光定量PCR方法(RT-qPCR)检测胰腺组织中ERα等基因表达水平 将胰腺组织于液氮中研磨后,Trizol法提取总RNA,测定RNA的浓度后,逆转录合成cDNA。使用SYBR®Green Real-time PCR-Msater Mix(Toyobo,日本)进行RT-qPCR反应,反应条件:95 ℃预变性10 min;然后95 ℃变性15 s,60 ℃退火延伸60 s,共进行40个循环,以GADPH作为内参照,引物名称及其序列见表1。采用2-ΔΔCT方法计算胰腺组织中ERα、ACSL4、GPX4及FTH1 mRNA相对表达量。实验重复3次,取均值。

表1 引物名称及其序列
1.2.3Western Blot方法检测胰腺组织中ERα、ACSL4、GPX4和FTH1蛋白的表达水平 将胰腺组织置于含有蛋白酶抑制剂PMSF的裂解缓冲液中裂解,于4 ℃下以13 000 r/min离心15 min,使用BCA蛋白试剂盒检测上清液中的蛋白浓度。取20 μg蛋白样品,使用120 g/L的SDS-PAGE电泳分离后转移至PVDF膜上,于50 g/L脱脂乳中常温封闭2 h,加入特异性一抗4 ℃孵育过夜。一抗分别为兔抗-ERα抗体(1∶1 000)、兔抗-ACSL4抗体(1∶1 000)、兔抗-GPX4抗体(1∶1 000)、兔抗-FTH1抗体(1∶1 000)及兔抗-GAPDH抗体(1∶1 000)。洗脱游离一抗后,将膜与HRP标记的二抗在常温下孵育2 h,利用ECL化学发光试剂盒曝光显影后,通过Image J软件分析蛋白条带的灰度值。
1.2.4大鼠胰腺组织生化分析 采用组织生化分析试剂盒检测大鼠胰腺组织中过氧化氢(H2O2)、丙二醛(MDA)、谷胱甘肽(GSH)的含量以及SOD、CAT、GSH-PX的活性水平;采用比色法检测胰腺组织中的铁含量。所有操作均严格按照试剂盒说明书进行。
1.2.5苏木精-伊红染色观察大鼠胰腺组织形态将胰腺组织采用体积分数为0.04的多聚甲醛固定24 h后,梯度乙醇脱水至透明,包埋于石蜡中并切成大小约1 cm3的小块,行5 μm厚切片,60 ℃烤片后,用苏木精和伊红染色,在生物光学显微镜下观察胰腺组织形态。
1.2.6透射电子显微镜观察胰岛细胞形态 将浸泡在体积分数为0.025的戊二醛固定液(4 ℃,pH为7.8)中的胰岛组织样本,4 ℃下用0.1 mol/L磷酸盐缓冲液(pH 7.4)充分清洗3次,每次15 min;然后用0.1 mol/L锇酸室温(20 ℃)固定2 h,4 ℃下用0.1 mol/L磷酸盐缓冲液(pH 7.4)再度清洗3次;接着用体积分数为0.3~1.0的乙醇梯度脱水,丙酮置换后,环氧树脂浸透包埋。包埋块行30 nm厚超薄切片,并载于200目铜网上,经醋酸铀和枸橼酸铅电子染色,采用FEI Tecnai G20 TWIN 型透射电镜(TEM)观察并拍照,加速电压为80 kV。
1.3 统计学分析
2 结 果
2.1 各组大鼠胰腺组织中ERα mRNA和蛋白表达水平比较
RT-qPCR和Western Blot检测结果显示,A~D组大鼠胰腺组织中ERα mRNA的表达水平分别为1.01±0.17、3.67±0.31、2.71±0.36、1.93±0.30,ERα蛋白表达水平分别为0.05±0.01、0.31±0.07、0.16±0.05、0.07±0.02,4组大鼠胰腺组织ERα mRNA和蛋白表达水平比较差异具有显著性(F=44.86、23.29,P<0.05),其中B组大鼠胰腺组织中ERα mRNA和蛋白表达水平与A组比较显著升高(t=13.14、6.81,P<0.05);C、D组的ERα mRNA和蛋白表达水平与B组比较显著降低(t=3.18~7.10,P<0.05)。
2.2 各组大鼠胰腺组织中氧化应激指标水平及铁含量比较
生化检测结果显示,4组大鼠胰腺组织中氧化应激指标水平及铁含量比较差异具有显著性(F=50.82~204.01,P<0.05),其中B组大鼠胰腺组织中CAT、SOD、GSH-PX等的活性以及GSH含量与A组比较显著降低(t=11.83~14.45,P<0.05),而H2O2、MDA及铁含量与A组比较显著升高(t=12.50~15.77,P<0.05);C、D组CAT、SOD、GSH-PX等的活性以及GSH含量与B组比较显著升高(t=4.36~20.29,P<0.05),而H2O2、MDA水平以及铁含量明显降低,差异均具有统计学意义(t=5.22~11.62,P<0.05)。见表2。
表2 各组大鼠胰腺组织中氧化应激指标水平及铁含量比较
2.3 大鼠胰腺组织中铁死亡通路相关基因和蛋白的表达水平比较
RT-qPCR和Western Blot检测结果显示,4组大鼠胰腺组织中铁死亡通路相关基因和蛋白表达水平比较差异具有显著意义(F=31.06~84.37,P<0.05),其中B组大鼠胰腺组织中GPX4、FTH1 mRNA以及蛋白表达水平与A组比较显著降低,而ACSL4 mRNA和蛋白表达水平与A组比较显著升高(t=7.30~13.55,P<0.05);C、D组与B组比较,GPX4、FTH1 mRNA和蛋白表达水平显著升高,而ACSL4 mRNA和蛋白表达水平则显著降低(t=2.13~8.58,P<0.05)。见表3。
表3 铁死亡通路相关基因和蛋白的表达水平比较
2.4 大鼠胰腺组织形态学变化情况
胰腺组织HE染色结果显示,与A组相比,B组大鼠的胰岛形态不规则,胰岛与外分泌腺界限模糊,胰岛细胞胞浆数量减少,部分胰岛细胞胞浆空泡变性;而C、D组大鼠与B组相比,胰岛形态趋于规则,少见胞浆空泡的胰岛细胞,胰岛与外分泌腺界限清晰,胰岛细胞胞浆数量与对照组没有明显差异,D组大鼠胰岛损伤的程度明显轻于C组(图1)。
2.5 大鼠胰岛细胞超微结构变化
透射电镜观察胰岛细胞超微结构结果显示,A组大鼠胰岛细胞胞浆内分布着大量电子致密的分泌颗粒,呈圆形,大小200~500 nm,外包界膜,界膜与芯之间的间隙较大,芯有不同程度的电子密度,细胞核大呈圆形,染色质均匀分布,线粒体可见明显的嵴结构(图2A);B组大鼠胰岛细胞受损变形,胞浆中分泌颗粒数量及电子沉积密度明显下降,部分分泌颗粒界膜消失,线粒体肿胀变形,嵴结构消失呈空泡化(图2B);C、D组大鼠胰岛细胞胞浆中分泌颗粒数量相对于B组大鼠明显增加,线粒体可见明显嵴结构(图2C、D)。
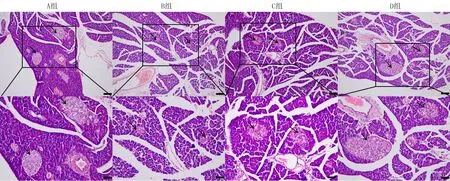
上排放大倍数100倍,右下角bar代表50 μm;下排为上排黑色框区域的局部放大(200倍),右下角bar值代表100 μm;黑色箭头所指为胰岛
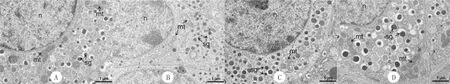
A~D分别代表A~D组,图中n为细胞核,mt为线粒体,sg为分泌颗粒
3 讨 论
GDM严重危害母婴健康,全球范围内约1/6新生儿受到孕期高血糖的影响[6],其临床过程复杂,发病机制至今尚不十分明确。研究发现胎盘组织中ERα基因表达水平与GDM的发生发展相关[12],然而其具体机制未知。研究证实,ERα可以调节葡萄糖转运蛋白4(GLUT4)的表达,ERα的异常表达会影响GLUT4的表达及功能,这可能影响胰岛素的信号传导和葡萄糖摄取,导致妊娠期胰岛素抵抗,进而发展为GDM[15]。
本研究通过对STZ诱导的高糖血症大鼠模型进行研究发现,B组大鼠胰腺组织中ERα mRNA和蛋白表达水平与A组相比显著升高。选择性ER调节剂TAM腹腔注射高糖血症大鼠,能够明显降低ERα mRNA和蛋白表达水平。TAM作为选择性ER调节剂,能够有效地阻断雌激素与ER的结合,使得雌激素不能发挥应有的作用。大量证据表明,机体内雌激素水平的变化同时也伴随着铁储量的变化[16-17]。过度的铁负荷会影响机体的氧化应激水平,与高血糖之间存在密切联系[18-20]。本研究中,B组大鼠胰腺组织中铁含量明显高于A组,但是在ERα表达抑制的C、D组中,铁含量明显低于B组。对细胞氧化应激指标分析显示,B组大鼠的胰腺组织中CAT、SOD、GSH-PX等抗氧化酶的活性以及GSH含量显著低于A组,而H2O2、MDA水平显著高于A组。这种抗氧化剂的减少和氧化应激产物的增加会导致ROS的过量产生,从而直接损害β细胞[21]。对胰腺组织的HE染色结果显示,B组大鼠胰腺组织出现明显的病理损伤,这可能是ROS的过量积累导致的。随着ERα水平降低,大鼠胰腺组织中抗氧化酶活性以及GSH含量明显升高,H2O2、MDA的水平明显降低,且高糖血症引起的胰腺组织病理损伤也得到明显缓解。以上这些结果表明,ERα表达水平的下降,降低了组织铁水平及氧化应激损伤,缓解了高糖血症引起的胰腺组织病理损伤。
铁离子的大量积累和脂质过氧化的爆发,提示细胞铁死亡。铁死亡是近年新发现的一种细胞死亡方式,细胞形态上表现为线粒体皱缩,线粒体嵴减少或消失。铁死亡被证实与多种疾病相关,已有研究表明,可以通过激活或抑制铁死亡来干预疾病的发展[22-23]。本研究通过透射电子显微镜观察胰岛细胞超微结构,结果显示,B组大鼠胰岛细胞中呈现明显的铁死亡特征,线粒体相比于A组明显皱缩,线粒体嵴消失。铁死亡通路中关键基因的mRNA和蛋白表达水平检测结果显示,B组大鼠胰腺组织中GPX4、FTH1 mRNA和蛋白表达水平相对于A组显著降低,而ACSL4 mRNA和蛋白表达水平相对于A组显著升高。GPX4活性被抑制,导致膜脂上活性氧自由基的积累,而FTH1的活性被抑制导致铁离子储存调控被破坏,使得细胞内的铁含量升高[24-25],ACSL4的活性升高,使得易被氧化的膜磷脂的合成增加,引发铁死亡。而通过抑制ERα的表达水平,C、D组大鼠胰岛细胞内可见正常线粒体,出现完整的线粒体嵴。同时基因GPX4和FTH1 mRNA和蛋白表达水平相对于B组大鼠明显升高,而ACSL4 mRNA和蛋白表达水平相对于B组大鼠明显降低,呈现出铁死亡抑制状态。这些结果表明,高糖血症大鼠出现明显铁死亡,而ERα mRNA和蛋白表达水平的抑制可以显著降低细胞铁死亡,推测ERα的表达水平影响雌激素的作用进而影响机体铁水平和氧化应激水平。
总之,本研究结果显示,选择性ER调节剂可能通过ER介导抑制胰腺组织氧化应激水平,降低细胞铁死亡,进而缓解高糖血症所致大鼠胰腺的病理损伤。后期还需要更多的临床试验和体外研究来分析ERα水平在高糖血症病程中所发挥的作用,并对其作为潜在药物靶点用以治疗妊娠期高糖血症的可行性进行分析。

