睡眠时间和糖尿病肾病尿蛋白进展风险的前瞻性队列研究
郭正勇 赵观进 张慧泽 江波 张宇 许洪涛
南京梅山医院肾内科(南京210039)
随着糖尿病的发病率增加,糖尿病肾病(diabetic kidney disease,DKD)患病率也逐渐上升,由DKD 导致的终末期肾病(end stage renal disease ESRD)已成为我国慢性肾衰竭的主要病因之一[1]。糖尿病患者合并肾脏损害后,病变不可逆转,因此对DKD 危险因素实施早期干预非常重要。目前公认血压、肥胖、蛋白尿、血糖、血脂、营养状况与DKD 进展有关[2],虽然采取了很多干预措施,但每年仍有很多DKD 患者进入肾脏替代治疗,因此,寻找影响DKD 进展的其他危险因素并加以干预显得尤为重要。
失眠是一种常见的睡眠障碍,长期失眠会给人的生理和心理带来严重的负面影响,有研究[3-4]显示每天睡眠时间短于6 h,高血压患病率增加20%,糖尿病患病率增加34%、心血管疾病患病率增加45%,并且增加死亡风险。睡眠不足是否会加重慢性肾脏病进展,尚不明确。本研究旨在探讨不同睡眠时间与早期DKD 尿蛋白进展风险的关联,为延缓DKD 进展寻找新的干预靶点。
1 对象与方法
1.1 研究对象收集2015年6月至2017年10月本院肾内科门诊就诊的早期DKD 患者作为研究对象。入选标准:(1)按照2014年ADA 糖尿病医学诊疗标准[5]确诊的2 型糖尿病患者;(2)有糖尿病视网膜病变;(3)3 个月内至少2 次随机晨尿微量白蛋白/肌酐比值(albumin/creatinine ratio,ACR)0~300 mg/g;(4)估算肾小球滤过率(eGFR)≥90 mL/(min·1.73 m2)。排除标准:(1)非糖尿病肾病患者;(2)急性肾损伤患者;(3)存在活动性感染或出血倾向者;(4)恶性肿瘤患者;(5)严重睡眠呼吸暂停综合征患者。共调查857 例DKD 患者,剔除不符合入选标准69 例和失访者23 例,共有765 例早期DKD 患者纳入本研究。
1.2 研究方法收集每例患者进入队列时的基线情况,采用统一的调查问卷,调查内容主要包括基线资料、体格检查、实验室检查指标,其中基线资料包括社会人口学信息、健康相关行为、既往病史等内容;体格检查主要包括身高、体质量、血压等,根据身高、体质量计算体质量指数(BMI);实验室检测指标有血肌酐、血糖、三酰甘油、胆固醇、糖化血红蛋白、尿蛋白、尿肌酐等指标。根据测定尿白蛋白、尿肌酐浓度计算尿ACR 比值。eGFR 计算应用简化MDRD 公式:eGFR[mL/(min·1.73 m2)]=186×(Scr/88.4)-1.154×(年龄)-0.203×(0.742 女性)[6]。每年对上述临床及实验室指标进行检测。本研究方案经医学伦理委员会批准,所有受试者均签署书面知情同意书。
1.3 指标定义及分组(1)早期DKD 定义:改善全球肾脏疾病预后(Kidney Disease:Improving Global Outcomes,KDIGO)指南[7]建议,根据白蛋白尿分期(A1 期:ACR <30 mg/g,A2 期:ACR 30~300 mg/g,A3 期:ACR >300 mg/g),将DKDA1、A2 期定义为早期DKD。(2)睡眠时间的测定及分组:采用运动手环(型号:华为荣耀智能5i)监测患者夜间睡眠时间,统计3 个月每天夜间睡眠时间,取平均值,根据不同睡眠时间将患者分为睡眠时间不足组(<6 h/d)、睡眠时间正常组(6~8 h/d)、睡眠时间过长组(>8 h/d)[8-9]。(3)吸烟:连续6 个月以上,每周至少抽1 支烟,或累计吸烟超过100支者。(4)饮酒:连续6 个月以上,平均每月饮酒1 次以上。(5)每日运动水平:运动手环监测每日运动步数,统计3 个月每天运动步数,取平均值,<6 000 步为低水平运动,≥6 000 步为高水平运动。
1.4 判断DKD 尿蛋白进展标准[10](1)A1 期进展为A2 期;(2)A2 期进展为A3 期;(3)A2 期患者尿ACR 值升高,虽未达到A3 期标准,但高于基线值2 倍以上。
1.5 统计学方法采用SPSS 19.0 软件包进行统计分析。符合正态分布的计量资料以()表示,组间差异比较采用方差分析;计数资料采用例数和百分比表示,组间差异比较采用χ2检验。随访时间从首次基线调查开始,退出时间为确定DKD进展、或失访或随访截至时间(2020年10月)。使用Cox 比例风险模型分析不同睡眠时间与早期DKD患者尿蛋白进展风险的风险比(HR)及95%CI,并对可能影响DKD 进展的因素进行逐步调整:模型1 未调整混杂因素;模型2 调整年龄、性别;模型3 在模型2 基础上调整BMI、吸烟、饮酒、每日运动水平、高血压、高血脂、冠心病、脑卒中病史。根据性别、年龄、BMI、运动水平、吸烟状态、饮酒状态进行分层分析,探索不同睡眠时间与DKD尿蛋白进展的关联。以P<0.05 为差异有统计学意义。
2 结果
2.1 研究对象基线资料765 例DKD 队列人群中,其中男314 例,女451 例,年龄(59.1 ± 6.2)岁。不同睡眠时间分组在性别、年龄、BMI、吸烟、饮酒、体力活动、血压和疾病史的差异均有统计学意义(P<0.05)。见表1。
表1 不同睡眠时间DKD 患者的基线资料比较Tab.1 Comparison of baseline characteristics of study population based on sleep duration ±s
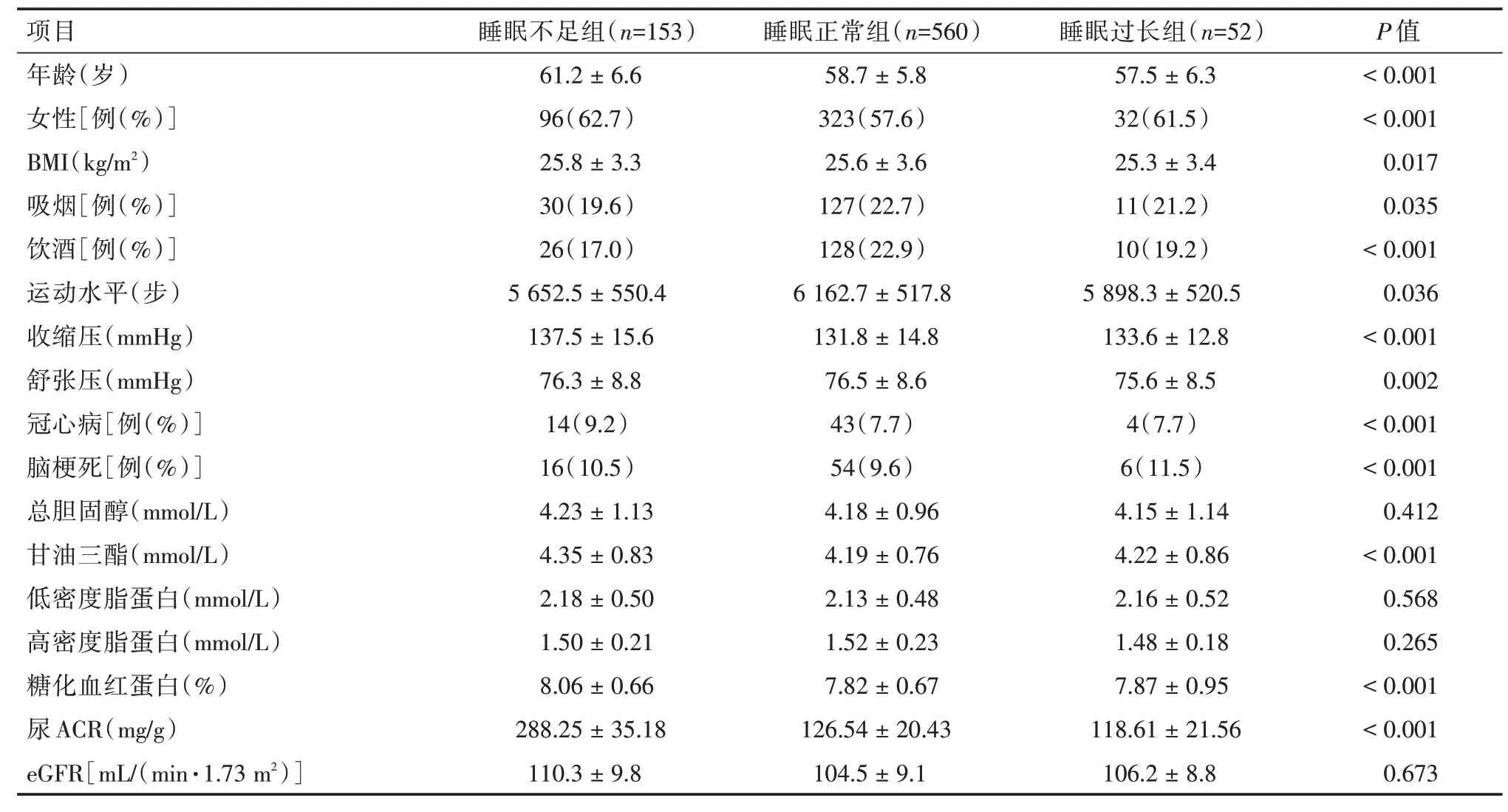
表1 不同睡眠时间DKD 患者的基线资料比较Tab.1 Comparison of baseline characteristics of study population based on sleep duration ±s
项目年龄(岁)女性[例(%)]BMI(kg/m2)吸烟[例(%)]饮酒[例(%)]运动水平(步)收缩压(mmHg)舒张压(mmHg)冠心病[例(%)]脑梗死[例(%)]总胆固醇(mmol/L)甘油三酯(mmol/L)低密度脂蛋白(mmol/L)高密度脂蛋白(mmol/L)糖化血红蛋白(%)尿ACR(mg/g)eGFR[mL/(min·1.73 m2)]睡眠不足组(n=153)61.2±6.6 96(62.7)25.8±3.3 30(19.6)26(17.0)5 652.5±550.4 137.5±15.6 76.3±8.8 14(9.2)16(10.5)4.23±1.13 4.35±0.83 2.18±0.50 1.50±0.21 8.06±0.66 288.25±35.18 110.3±9.8睡眠正常组(n=560)58.7±5.8 323(57.6)25.6±3.6 127(22.7)128(22.9)6 162.7±517.8 131.8±14.8 76.5±8.6 43(7.7)54(9.6)4.18±0.96 4.19±0.76 2.13±0.48 1.52±0.23 7.82±0.67 126.54±20.43 104.5±9.1睡眠过长组(n=52)57.5±6.3 32(61.5)25.3±3.4 11(21.2)10(19.2)5 898.3±520.5 133.6±12.8 75.6±8.5 4(7.7)6(11.5)4.15±1.14 4.22±0.86 2.16±0.52 1.48±0.18 7.87±0.95 118.61±21.56 106.2±8.8 P 值<0.001<0.001 0.017 0.035<0.001 0.036<0.001 0.002<0.001<0.001 0.412<0.001 0.568 0.265<0.001<0.001 0.673
2.2 不同睡眠时间与DKD 进展风险关联的Cox比例风险回归模型分析DKD 尿蛋白进展者共123 例,总进展发生率为16.1%。睡眠不足组、睡眠正常组、睡眠过长组进展发生率分别为29.4%(45/153)、12.5%(70/560)、15.4%(8/52)。未调整混杂因素情况下,Cox 回归分析结果显示(模型1),以睡眠时间正常组为参照,睡眠时间不足、睡眠时间过长组的DKD 尿蛋白进展风险HR(95%CI)分别为2.35(1.86~2.97)、1.23(0.93~1.63)。在调整相关影响因素后,Cox 回归分析结果显示(模型3),睡眠时间不足、睡眠时间过长的DKD 尿蛋白进展风险HR(95%CI)分别为1.82(1.14~2.91)、1.04(0.75~1.44)。见表2。
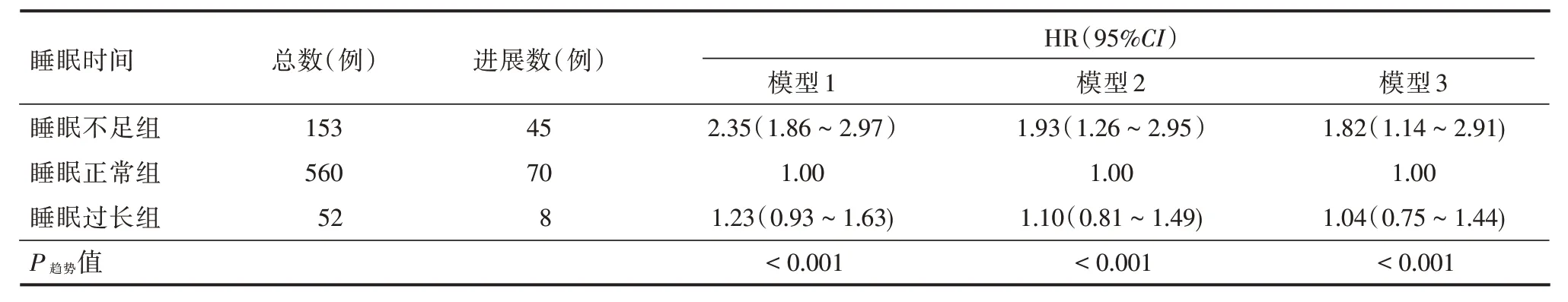
表2 不同睡眠时间与DKD 进展风险的Cox 比例风险回归分析Tab.2 Cox regression analysis for association between sleep duration and increased proteinuria
2.3 不同睡眠时间与DKD 进展风险关联的Cox比例风险回归模型分层分析分层分析显示,睡眠时间在不同性别、年龄(<65 和≥65 岁)、BMI(<24 和≥24 kg/m2)、体力活动(<6 000 和≥6 000步)、吸烟(是和否)、饮酒(是和否)状态中,与DKD进展关联差异无统计学意义(P>0.05)。在女性患者中,与睡眠时间正常相比,睡眠时间不足、睡眠时间过长患者DKD 进展风险分别增加54%(HR=1.54,95%CI:1.18~2.01)和22%(HR=1.22,95%CI:0.99~1.50);在老年患者中,与睡眠时间正常相比,睡眠时间不足、睡眠时间过长患者DKD进展风险分别增加64%(HR=1.64,95%CI:1.22~2.20)和16%(HR=1.16,95%CI:0.92~1.46)%;在体力活动<6 000 步、吸烟患者中,与睡眠时间正常相比,睡眠时间不足患者DKD 进展风险分别增加58%(HR=1.58,95%CI:1.26~1.98)、62%(HR=1.62,95%CI:1.18~2.22)。见表3。
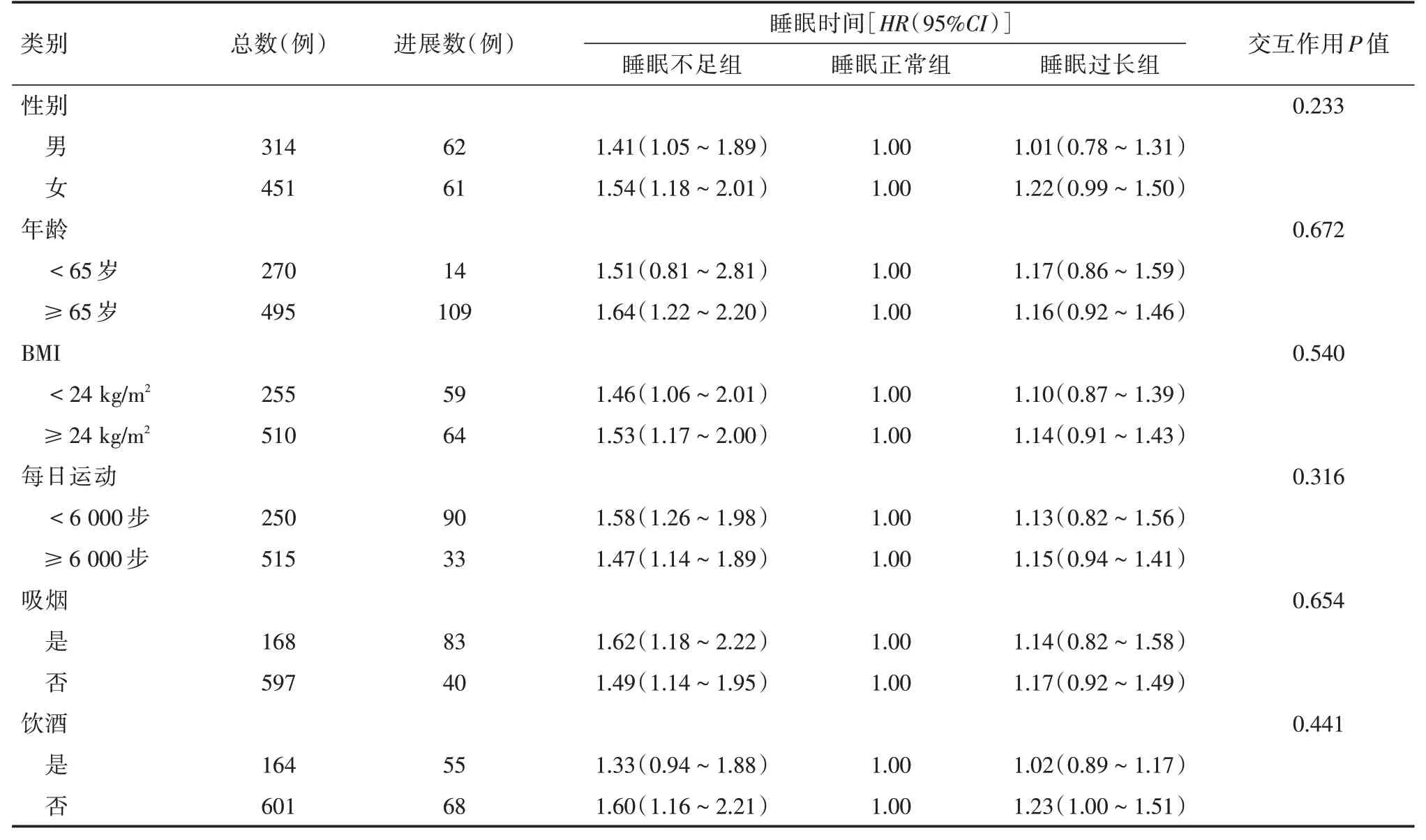
表3 不同睡眠时间与DKD 患者尿蛋白进展风险的Cox 回归分层分析Tab.3 Stratified analysis for association between sleep duration and increased proteinuria
2.4 危险因素分析将不同睡眠时间分组作为等级变量建立模型3,结果显示,睡眠不足组无尿蛋白进展生存率明显低于睡眠正常组,差异有统计学意义(P<0.05)。而睡眠时间过长与睡眠正常患者尿蛋白进展差异无统计学意义(P>0.05),Kaplan-Meier 曲线见图1。
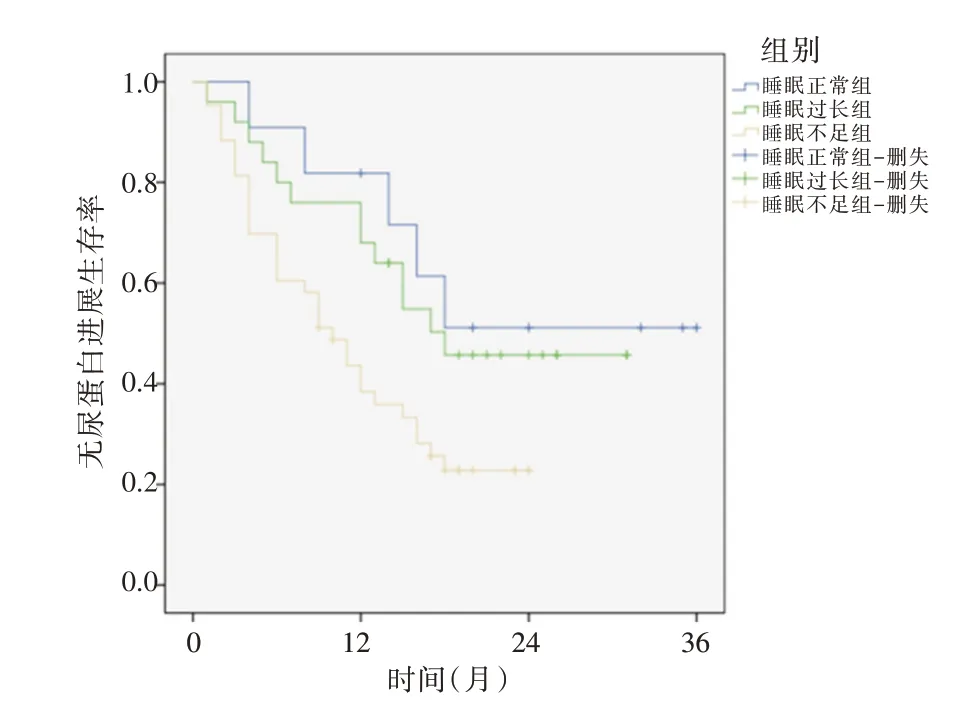
图1 不同睡眠时间水平DKD 患者Kaplan-Meier 曲线Fig.1 Kaplan-Meier survival curves of DKD patients with different sleep duration
3 讨论
睡眠是人体最基本的生理功能之一,睡眠时间不足现象较普遍,研究显示,睡眠不足增加心脑血管疾病、2 型糖尿病、肥胖、骨质疏松症等慢性病疾病的发病风险[11],睡眠时间长短对CKD 发病率和进展风险是否存在影响,国内外研究结果尚不一致,CHEUNGPASITPORN 等[12]荟萃分析发现,睡眠时间不足CKD 患者发病风险增加51%,校正混杂因素后其发病风险增加47%。MCMULLAN 等[13]研究显示,睡眠不足5 h CKD进展OR=1.79(95%CI:1.06~3.03)。而KIM 等[14]横断面研究显示睡眠时间短与CKD 无相关性。LI 等[15]东风-同济队列研究显示,在中国中老年人群中,睡眠时间过长增加肾功能下降的风险,是肾功能下降的独立危险因素。本研究结果显示,睡眠不足DKD 患者尿蛋白进展发生率为29.4%(45/153),在调整相关影响因素后,进展风险HR= 1.82(95%CI:1.14~2.91),高于睡眠时间正常人群,与MCMULLAN 等[13]研究结果基本一致,而睡眠时间过长与尿蛋白进展风险无关联。
DKD 的发病风险与进展风险的危险因素不尽一致,DKD 的发生与遗传因素、代谢紊乱、血流动力学改变、炎症反应、氧化应激等诸多因素有关[16]。而作为评价肾脏病进展的两项指标GFR与ACR,其危险因素也不尽一致,RETNAKARAN 等[17]研究显示,女性、高龄、胰岛素敏感性增加、存在感觉神经病变是DKD 患者GFR 降低的独立危险因素;而ACR 增加的独立危险因素是:男性、高脂血症、高糖化血红蛋白水平、吸烟史、存在视网膜病变。本研究分层分析显示睡眠时间不足在女性、年龄≥65 岁、少运动量、吸烟患者中与DKD 尿蛋白进展风险关联强度更大,与既往研究结果[18]一致。
睡眠不足导致DKD尿蛋白进展机制尚不明确,但研究发现睡眠时间不足增加了高血压发病风险,其对高血压的影响可能与交感神经和肾素-血管紧张素-醛固酮系统(RAAS)过度活动有关[19],而RAAS 过度兴奋是DKD 特征性表现,是蛋白尿进展的重要机制之一。还有研究[20]显示,睡眠时间不足导致肥胖发生风险增加,增加胰岛素抵抗,肥胖和胰岛素抵抗通过诱发和加重氧化应激-炎症反应状态,从而加重DKD 尿蛋白进展[21-22]。上述是睡眠不足导致DKD 尿蛋白进展的可能间接因素,其直接原因尚不明确,有待进一步深入研究。
本研究以DKD 患者为研究对象,避免了原发病不同所致的结果偏倚,另外患者使用运动手环记录睡眠时间,准确性较高。同时也存在一定局限性,睡眠时间是夜间时间,未考虑到午休时间及睡眠质量对其风险影响;其次,随访时间较短,随访人数较少,可能存在一定偏倚。
综上所述,睡眠不足可能是早期DKD 尿蛋白进展的危险因素,可将改善睡眠作为延缓DKD 进展的新靶点。

