乳腺癌CYP2D6、SULT1A1基因多态性与他莫昔芬疗效的关系
王帅兵 豆妮娜 王彤 肖芳芳 王前进 郭茜
1河北中石油中心医院,河北医科大学石油临床学院(河北廊坊065000);2天津医科大学肿瘤医院,国家肿瘤临床医学研究中心(天津300060)
他莫昔芬(tamoxifen,TAM)是治疗乳腺癌主要的内分泌药物。CYP2D6 是TAM 重要的代谢酶,由于基因型的差异,导致TAM体内代谢存在不同。约30%~50%的患者TAM 疗效不佳[1]。美国食品药品监督管理局认可基因检测指导TAM 治疗。但也有研究发现TAM 代谢差异并不影响其疗效[2],临床指南也并不推荐TAM 治疗前的基因检测。硫酸基转移酶1A1(SULT1A1)是TAM 第二阶段代谢的关键酶,它决定TAM 活性代谢物在体内的作用时间[3-4],可能影响TAM 疗效。本研究旨在对接受TAM 治疗的乳腺癌患者进行前瞻性对照研究,评估CYP2D6、SULT1A1 不同基因型的TAM 疗效。
1 资料与方法
1.1 一般资料2018年1月-2019年1月入院乳腺癌患者为研究对象,所有入组患者均需签署知情同意书。纳入标准:(1)女性;(2)术后病理确诊为原发性乳腺癌;(3)免疫组化染色显示为ER/PR 阳性;(4)按照临床指南应给予TAM 治疗,同意入组并签署知情同意书。排除标准:(1)服用过选择性5-羟色胺再摄取抑制剂(SSRI)以及5-羟色胺、去甲肾上腺素再摄取抑制剂(SNRIs)等影响TAM 代谢药物;②合并严重脏器疾病,不适合抗肿瘤治疗;③合并其他恶性肿瘤。入组患者203 例,26 ~52 岁,≤35 岁75 例、>35 岁128 例,肿瘤直径≤2 cm 108 例、>2 cm 95 例,均为导管癌,TNM 分期Ⅰ期67 例、Ⅱ期84、Ⅲ期52 例。
1.2 研究方法
1.2.1 样本采集辅助治疗开始前,采集空腹静脉血3 mL(EDTA 抗凝),于0 ~8 ℃冷藏,保存时间≤48 h。
1.2.2 检测试剂核酸纯化试剂、地高辛染色液、10×NH4Cl 预处理液、1×NH4Cl 预处理液、灭菌注射用水、移液枪、2 mL 灭菌离心管。
1.2.3 检测仪器微量荧光检测仪(西安天隆科技有限公司、陕械注准20162400092 号)
1.2.4 检验步骤(1)血液样本编号。(2)离心管加入1.0 mL 1×NH4Cl 预处理液。(3)取200 μL 混匀的血液样本加入预处理液离心管。(4)上下颠倒10次,室温静置5 min。(5)室温3 200 r/min 离心5 min,留管底沉淀的白细胞。(6)加入1 mL 1×NH4Cl 或生理盐水重悬白细胞,室温3 200 r/min 离心5 min,吸走上层液。(7)加入30 μL 核酸纯化试剂,反复吹打。(8)室温静置30 min,待测。(9)使用微量荧光检测仪,上样检测CYP2D6、SULT1A1 基因型。
1.3 观察指标测定CYP2D6(100C >T)、SULT1A1 638(G >A)位点基因型。比较不同基因型患者年龄、肿瘤大小、TNM 分期、HER-2 状态、脉管瘤栓等。电话或门诊复查随访患者无病生存期(DFS)及总生存期(OS)(随访截止日期为2021年1月1日),评估不同基因型患者接受TAM 治疗后生存差异。
1.4 统计学方法采用SPSS 20. 0 统计软件处理数据,计量资料采用均数±标准差()表示;计数资料采用百分率(%)表示,组间比较采用χ2检验;采用Kaplan-meier 法进行生存分析,应用Logrank 检验比较组间生存差异。P<0.05 为差异有统计学意义。
2 结果
2.1 CYP2D6、SULT1A1 基因型203例患者CYP2D6(100C >T)基因型CC、CT、TT 分别为44 例(21.67%)、117 例(57.64%)、42 例(20.69%)。SULT1A1 638(G >A)均为GG 型,未发现GA 或AA 型。
2.2 CYP2D6 基因型与临床病理参数CYP2D6(100C >T)基因型与年龄、肿瘤直径、TNM 分期、HER-2 状态、脉管内瘤栓等无关(P>0.05)(表1)。
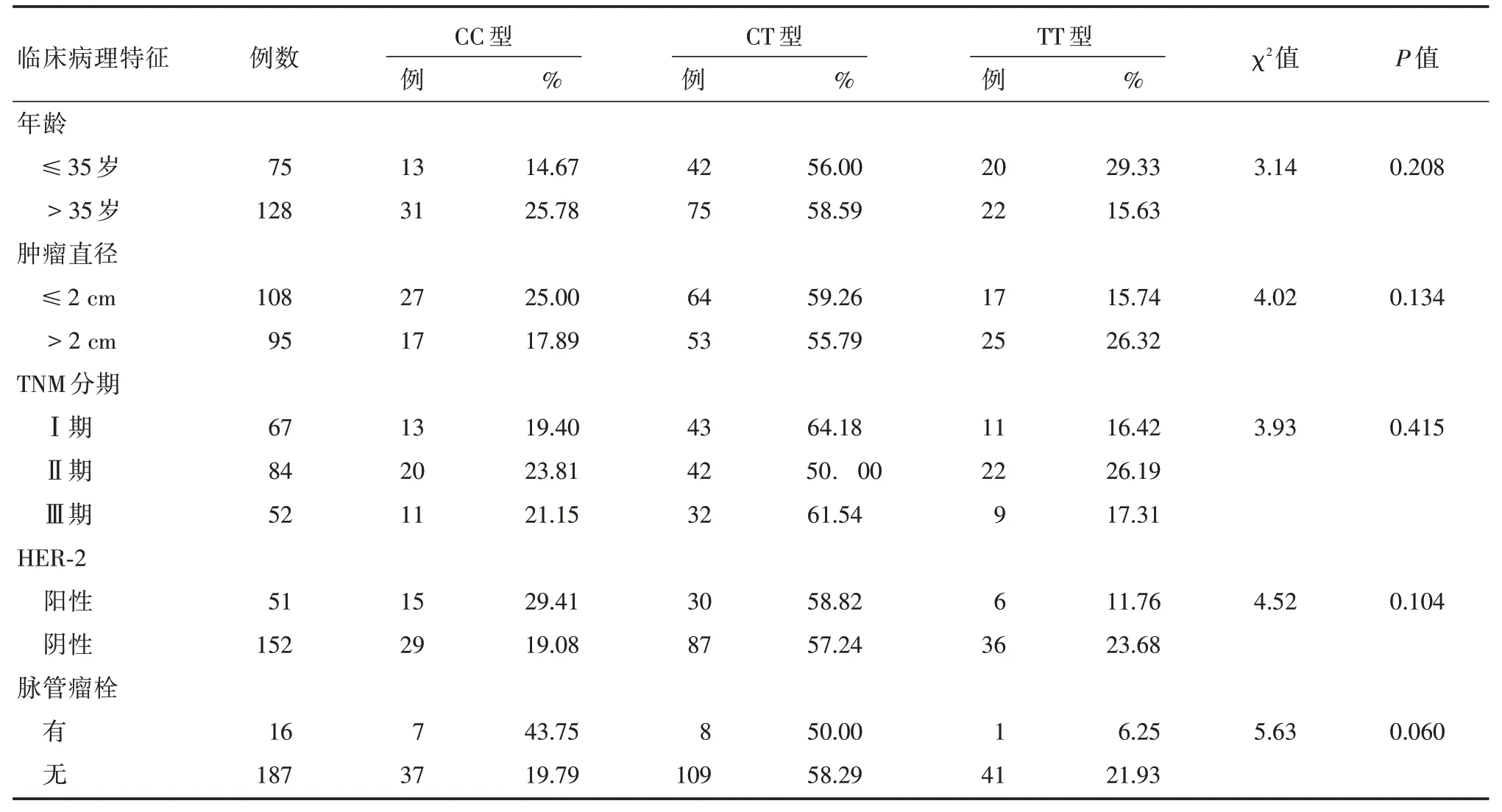
表1 不同CYP2D6(100C >T)基因型的临床病理参数(n=203)Tab.1 Clinical and pathological parameters of different CYP2D6(100C >T)genotypes(n=203)
2.3 CYP2D6 基因型与DFS、OS所有患者随访均满2年,评价不同基因型患者2年无病生存(disease free survival,DFS),以及2年总生存(overall survival,OS)差异。发现CC及CT型患者DFS与TT型相比,差异无统计学意义(P>0.05);CC 型及CT型2年OS 优于TT 型患者(P<0.05),见表2。
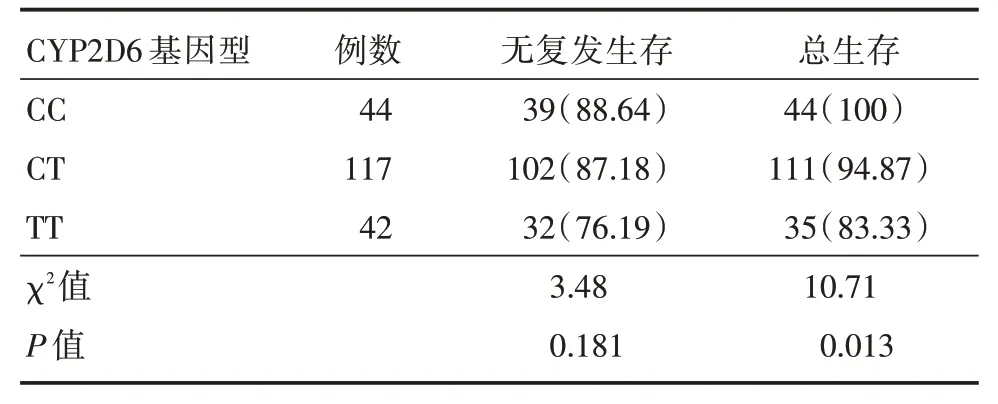
表2 不同CYP2D6 基因型的2年DFS、OS(n=203)Tab.2 DFS and OS of different CYP2D6 genotypes for 2 years(n=203) 例(%)
2.4 不同CYP2D6 基因型的生存差异所有患者均完成随访,截止至随访日期,DFS 6 ~36 个月(28.38±0.41),OS 13 ~36 个月(28.89±0.36)。经Log-rank 检 验,CC 型及CT型DFS与TT 型无差异(P= 0.352,图1)。CC 型及CT 型OS 优于TT 型(P=0.001,图2)。
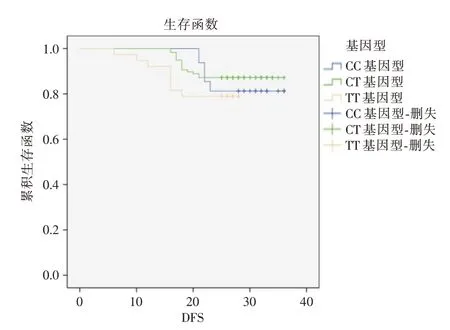
图1 不同CYP2D6 基因型DFSFig.1 DFS of different CYP2D6 genotypes
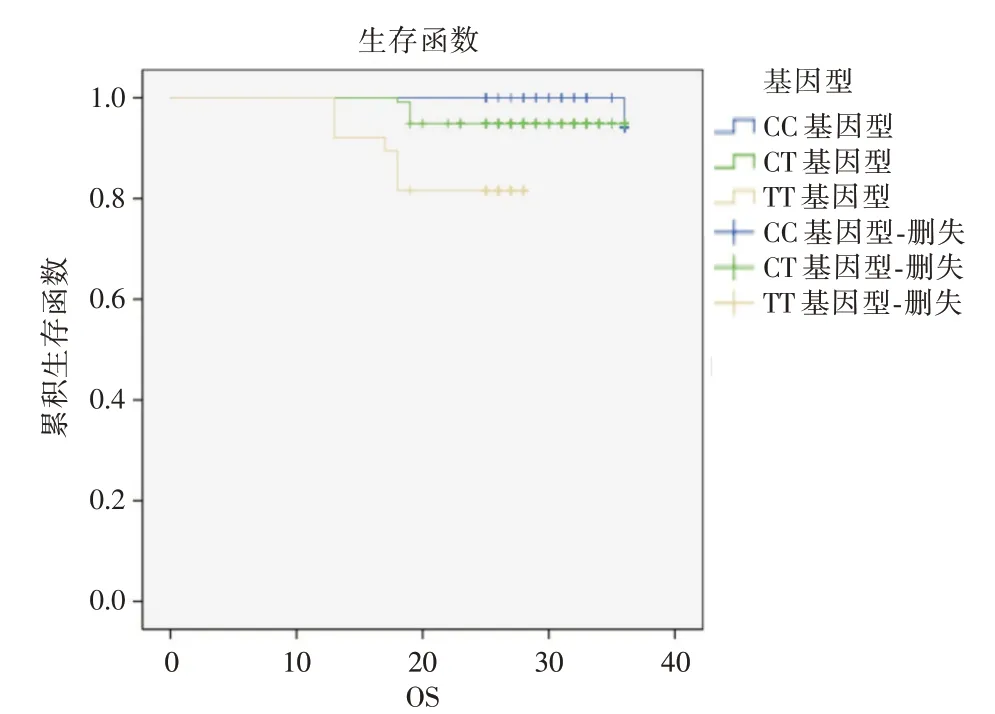
图2 不同CYP2D6 基因型OSFig.2 OS of different CYP2D6 genotypes
3 讨论
TAM 为人工合成的抗雌激素药物,通过与雌激素竞争雌激素受体,减少雌激素与受体结合,达到抗肿瘤作用。然而,约有30%~50%接受TAM治疗的患者出现耐药情况[1]。药物代谢酶影响药物的体内代谢,其基因多态性与药效存在一定关系[5],CYP2D6 是TAM 代谢关键酶,该基因的多态性可能是影响TAM 疗效的重要因素。
CYP2D6 位于第22 号染色体(22q13.1),基因多态性高达100 多种[6],包括单个碱基缺失、插入,碱基替换、大片段基因丢失等,这些突变会导致酶活性的改变,影响TAM 代谢进而可能影响到药物疗效。CYP2D6 的基因多态性具有地域和种族差异。研究表明CYP2D6*10(100C >T)是亚洲人群最常见的CYP2D6 等位基因(58.7%)[7],中国患者该等位基因占到71.4%[8]。根据突变形式,将基因型分为:纯合突变*10/*10(TT),两个等位基因均为无功能型,对TAM 代谢明显降低;杂合突变Wt/*10(CT),一个等位基因无功能或两个等位基因均功能减弱,对TAM 代谢能力轻度降低;正常表型Wt/Wt(CC),两个等位基因均功能正常,可以将TAM 迅速代谢成活性成分吲哚昔芬[9]。
本研究显示,入组患者CYP2D6*10(100C >T)突变率为78.33%,其中突变杂合子为57.64% 、突变纯合子为20.69%。LAN 等[10]对于CYP2D6 的基因分型与本研究一致,他们将CYP2D6*10 的基因型分为三类:野生型(CC:正常代谢表型)、杂合突变型(CT:中间代谢表型)、纯合突变型(TT:代谢不良表型)。其中CT 及CC 型78.3%,TT 型21.7%,与本研究结果接近。而一项针对湖北137 例患者的研究显示[11],CC、CT 及TT 型频率分别为25.5%,38.0%和36.5%。另一项针对778 例北京患者的研究[12],显示CC、CT及TT型频率分别为30.1%,48.5%和21.5%。
一项研究[13]回顾既往TAM 治疗的乳腺癌患者的基因型,认为CYP2D6是他莫昔芬代谢的关键酶,该基因的多态性是TAM 代谢的决定因素之一,可能对疗效产生影响。临床研究也证实了CYP2D6基因多态性会影响TAM 疗效。一项荟萃分析纳入7 项研究显示[14],接受TAM 治疗的患者,CYP2D6代谢不良型患者疾病复发风险更高。本研究对比不同基因型患者的临床病理资料,未发现基因型与临床病理特征存在关联。CC 型及CT 型患者2年无病生存率高于TT 型患者,但差异无统计学意义。CC 型及CT 型患者2年总生存率高于TT 型,差异有统计学意义,此结论与胡芳等[15]的研究一致,他们观察到CYP2D6*10 Wt/Wt 型及Wt/*10 型复发率及死亡率明显低于*10/*10 型,3年及5年无病生存率明显高于*10/*10 型。2018年的一项研究[10],研究避免CYP2D6*10 TT 型患者内分泌疗效下降,应用托瑞米芬(TOR)代替TAM 进行治疗。结果发现CYP2D6*10 TT 型患者,接受TOR 治疗的5年无病生存率显著高于TAM 治疗(90.9%vs.67.9%,P=0.031)。
2019年发布的“CYP2D6 作为雌激素受体阳性非转移性乳腺癌患者治疗决策的辅助工具的系统回顾及临床观察实践指南”,建议乳腺癌患者在TAM 治疗前,进行CYP2D6 基因检测[1]。临床药物基因组学实施联盟(clinical pharmacogenetics implementation consortium,CPIC)分析既往研究[16],也建议根据CYP2D6 基因型给予患者不同剂量TAM 以保证疗效。
SULT1A1 是TAM 活性代谢产物4-OH-TAM 和4-OH-N-去甲TAM 的关键代谢酶。该酶的基因多态性可能影响TAM 活性代谢物在体内作用时间而影响疗效。既往研究[17]观察到SULT1A1 与TAM 疗效间存在关联。本研究检测SULT1A1 638(G >A)位点,所有患者均为野生型,未发现等位基因突变,提示该位点在中国人群突变率低,可能不是影响我国乳癌患者TAM 疗效的相关因素。
本研究初步显示CYP2D6 基因多态性与TAM疗效相关。但由于入组患者较少,随访时间仍短,需要进一步扩大样本量,以及延长随访时间进一步观察两者之间的关联程度。同时不光疗效因素需要考虑,已有研究开始着眼于基因多态性与TAM 治疗的副反应[18],以及基因检测指导TAM 治疗的经济性[19]。随着研究的深入,期待TAM 药物代谢酶的基因检测获得更加一致和系统的结论,在不远的将来写入临床指南,使不同患者获得更好的个体化治疗。

