先天性X连锁肾性尿崩症继发早发痛风的1个家系报道
朱虹 徐燕琳 杜田 陈振东 黄莉 牟利军
先天性肾性尿崩症(congenital nephrogenic diabetes insipidus,CNDI)是由于患者的抗利尿激素受体2(arginine vasopressin receptor 2,AVPR2)基因突变,导致抗利尿激素(arginine vasopressin,AVP)受体合成或功能发生障碍,从而引起肾性尿崩症[1-2]。CNDI临床罕见,早发痛风往往由单基因突变所致,但需首先排除继发因素。目前国内CNDI继发早发痛风病例的相关报道鲜见。本文报道一个AVPR2基因突变导致X连锁CNDI继发早发痛风的家系,探讨CNDI继发早发痛风的可能机制及其治疗策略。
1 临床资料
患者男,24岁,因“烦渴、多饮、多尿24年,反复多关节红、肿、痛6年”于2019年3月入住建德市第一人民医院。患者在婴幼儿时期就有明显的恶心、呕吐,伴烦渴、多饮、多尿,易激惹,饮水量及尿量呈进行性增多;少年时饮水量可达10 L/d以上,夜尿达6次。6年前患者开始出现四肢多关节红、肿、热、痛,并反复发作。父母非近亲结婚,否认家族性遗传史及类似病史。入院查体:血压148/98 mmHg,BMI 34.55,左足踝关节红肿,皮温高,触痛明显,右中指掌指关节见直径约1 cm痛风石。血生化:钠145.2 mmol/L(正常范围:135~145 mmol/L),尿酸 552.0 μmol/L(正常范围:202.3~416.5 μmol/L),肌酐 92.9 μmol/L(正常范围:59~104 μmol/L),FPG 6.2 mmol/L,TG 3.04 mmol/L(正常范围:0.56~1.70 mmol/L)。血渗透压:303 mOsm/kgH2O,尿渗透压:54 mOsm/kgH2O;尿比重:1.001;尿量 11 850 ml/d,尿酸清除率为4.93 ml/min。泌尿系统B超检查未见异常。垂体增强MRI:垂体柄异常信号结节,考虑囊肿。右侧垂体不均质低强化。双足双能量CT:左足第3、4跖骨近端骨间,右跟骨前内侧可见小片状尿酸结晶沉着,形成痛风结节。禁水加压素试验在进行2 h后因患者不能耐受提前终止。治疗:首先考虑遗传性中枢性尿崩症,予醋酸去氨加压素0.6 mg/d,治疗7个月患者尿量无变化。故考虑患者为肾性尿崩症,予全外显因子基因检测,发现患者AVPR2半合子突变(c:316C>T,p.Arg106Cys),来源为母亲,父亲无突变(图1),父母均无症状,家系分析符合X连锁遗传方式(图2)。CNDI诊断明确,治疗上改氢氯噻嗪100 mg/d,同时予苯溴马隆50 mg/d联合非布司他40 mg/d降尿酸治疗,2个月后患者夜尿由6次减少至1~2次,尿量减少至5 000~7 000 ml/d。随访中发现肾结石,故停用苯溴马隆,血尿酸反弹至782 μmol/L,痛风未发作。
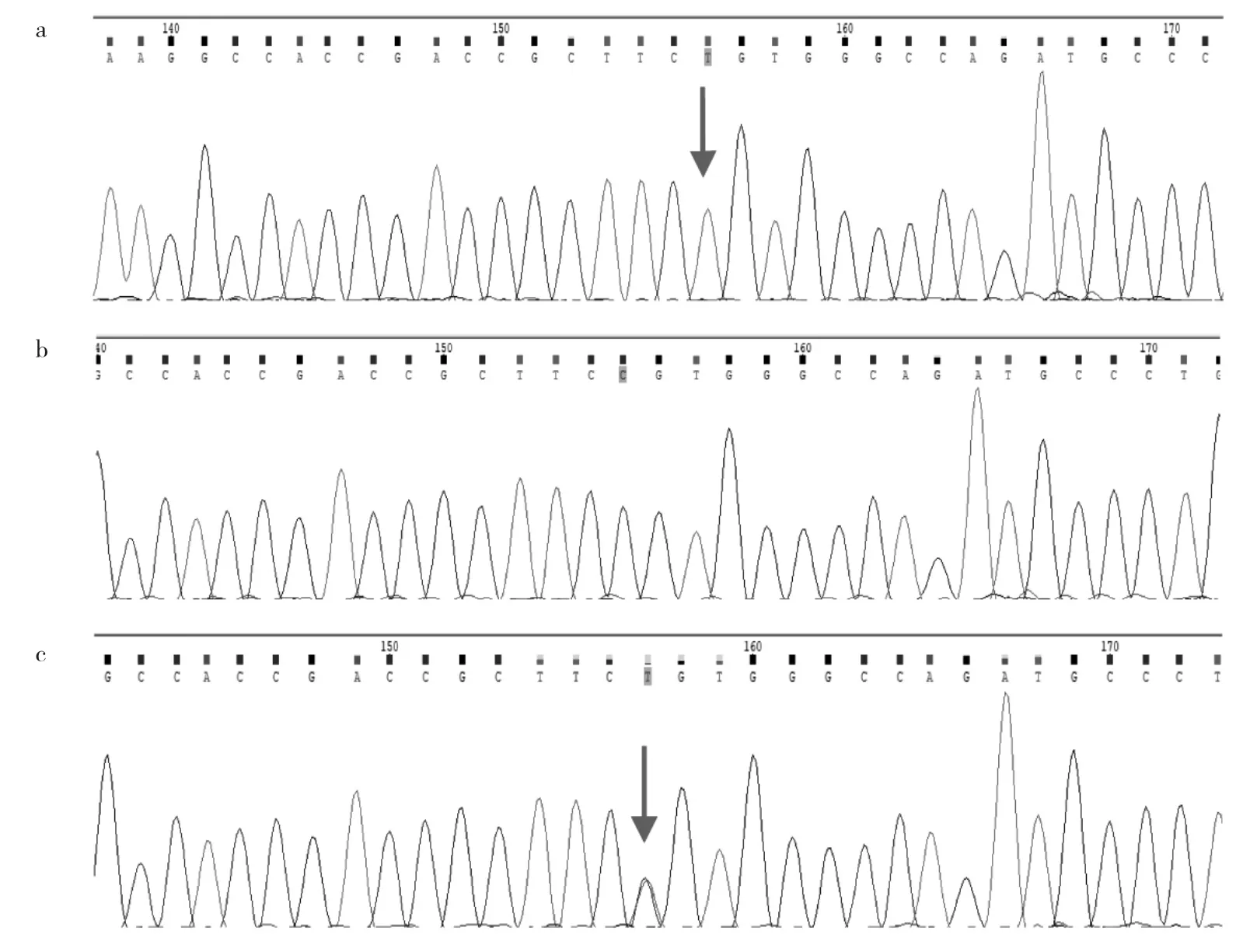
图1 家系基因分析结果[a:患者AVPR2基因携带一个c.316C>T(p.Arg106Cys)半合突变(箭头所示);b:患者父亲AVPR2基因无突变;c:患者母亲AVPR2基因携带一个c.316C>T(p.Arg106Cys)杂合突变(箭头所示)]

图2 本例患者家系图(↗:先证者:正常;■:患病者;:杂合子)
2 讨论
该患者自幼发病,烦渴、多饮、多尿,易激惹,青少年期出现痛风;入院后发现大量低渗尿,垂体增强MRI发现垂体柄有信号异常,禁水加压素试验因患者不耐受提前终止,首先考虑遗传性中枢性尿崩症,予醋酸去氨加压素治疗,疗效不佳。行基因检测发现患者AVPR2半合子突变,来源为无临床表型的母亲。人类基因突变数据库显示此突变与肾性尿崩症相关[3],故诊断为CNDI,治疗方案调整为氢氯噻嗪后疗效明显。但未找到早发痛风的单基因突变,因此考虑早发痛风继发于CNDI。但氢氯噻嗪治疗尿崩过程中高尿酸血症加重。
CNDI是一组较为少见的遗传异质性疾病,仅占所有尿崩症患者的10%,目前研究认为,该病的发生机制主要是AVPR2基因或水通道蛋白2基因突变所致。其中由AVPR2基因突变引起的X连锁CNDI是其主要类型,占90%,可以家族遗传性发病,也可以散发[4]。主要致病机制是大多数AVPR2突变导致的AVP受体滞留于细胞内,部分突变的AVP受体虽然能到达细胞表面,但不能与AVP结合,或不能刺激细胞内cAMP升高[5]。从1992年首次报道人AVPR2基因突变致X连锁CNDI以来,目前全世界已报道约250种AVPR2致病基因突变[6]。国内一项较大样本CNDI临床研究发现,国内患者误诊、漏诊率高,确诊年龄(平均8岁)明显晚于国外报道(平均9个月)[7]。此患者成年后才确诊,亦符合这一研究结果。故临床需提高对CNDI的认识,早期诊断CNDI。该病一般采用氢氯噻嗪治疗,疗效可。近年来CNDI的药物治疗有一些新进展,比如可恢复突变受体功能活性的AVPR2拮抗剂或激动剂,用于不同突变的CNDI治疗。但由于其药效受多种因素影响以及安全性等问题,目前尚未应用于临床[8]。
目前我国痛风的患病率在1%~3%,并呈逐年上升、年轻化趋势。<25岁伴有家族史的早发痛风多为单基因突变所致[9]。本例患者基因检测排除了单基因遗传相关的早发痛风,患者存在男性、高嘌呤饮食、代谢综合征等多个痛风高危因素,既往有文献报道4例成人CNDI合并痛风,痛风发病年龄>30岁,2例儿童CNDI均无高尿酸血症。该文认为成人CNDI可继发痛风,与尿酸排泄减少有关,而尿酸排泄减少与CNDI慢性升高的内源性血精氨酸加压素导致肾血流量下降有关[10-11]。该患者在随访过程中多次检测尿酸清除率均低于6.2 ml/min,与该文献报道符合。故笔者推测上述多种机制导致患者早发痛风。氢氯噻嗪是治疗CNDI的一线药物,但氢氯噻嗪在治疗CNDI时,可通过抑制远端小管钠离子的重吸收,使血容量下降,影响肾灌注,肾小球滤过率下降,影响尿酸排泄;也可直接干扰肾小管排泄尿酸,导致高尿酸血症[12]。该患者在使用氢氯噻嗪后尿崩症得到有效控制,但血尿酸升高,且难以纠正,治疗棘手。根据患者情况,笔者将采取调整饮食结构,降低体重,非洛贝特降血脂降尿酸,非布司他加量至80 mg/d等方案,期望有效降低高尿酸血症,避免出现因痛风反复发作带来的严重并发症。
总之,CNDI诊断容易延误,基因检测将为诊治CNDI和预估病情提供重要的依据。CNDI继发早发痛风非常罕见,主要机制为患者尿酸排泄减少,因氢氯噻嗪加重高尿酸血症,造成CNDI继发痛风治疗非常棘手。

