miR205-3p靶向MDM2调控乳腺癌血管内皮细胞增殖的研究
周少丞 季晓春 滕伟峰 张佳男 毛琦淇
乳腺癌是女性最常见的恶性肿瘤之一。在全世界范围内,乳腺癌约占女性恶性肿瘤总发病率的25%,女性肿瘤相关死亡率的15%[1]。肿瘤的生长、侵袭及转移与血管生成密不可分。由于在肿瘤微环境的影响下,肿瘤血管在形态、功能、基因表达上与正常的血管存在着较大的差异[2]。因此,如何有效地控制肿瘤血管的生长对治疗乳腺癌具有重要意义。miRNA作为广泛存在于真核生物中的一类长度为18~26个核苷酸的内源性非编码小分子RNA,通过与靶mRNA的3'UTRs互补结合,在转录水平降解mRNA或者在翻译水平抑制蛋白质的合成,从而达到调控基因表达的作用。miR205最初是在研究鼠和红鳍东方豚的同源序列时通过在线预测网站MiRscan预测发现的,之后证实在人体中也有表达。miR205与多种肿瘤的发生、发展相关,在不同的肿瘤中其表达水平不同,如在前列腺癌[3]中低表达,在非小细胞肺癌[4]、黑色素瘤[5]及头颈部鳞癌[6]等肿瘤中高表达。鼠双微体2基因(mouse double minute 2,MDM2)作为一种进化相对保守的基因,通过调节p53的功能影响细胞周期起到重要作用。miR205-3p在BC-ECs中的表达情况鲜有报道,且miR205-3p能否通过调控MDM2的表达参与对乳腺癌血管内皮细胞(breast cancer-endothelial cells,BC-ECs)增殖的影响尚不明确。基于此,本研究旨在分析miR205-3p调控BC-ECs增殖的作用机制,探讨乳腺癌临床治疗可行的分子靶点,现报道如下。
1 材料和方法
1.1 材料 3种乳腺癌细胞株(MCF7、MDA-MB-453、MDA-MB-231)和人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)购自中国科学院上海生命科学研究院细胞资源中心。NOD SCID小鼠购自北京维通利华实验动物技术有限公司。
1.2 主要试剂和仪器 RPMI 1640培养基、DMEM培养基均购自美国Gibco公司。EGM血管内皮细胞专用培养基购自瑞士Lonza公司。FBS购自美国Gibco公司。Lipofectamine 3000转染试剂购自美国Invitrogen公司。Matrigel基质胶购自美国BD公司。无菌超净工作台购自中国苏州金净有限公司。细胞CO2恒温培养箱购自美国Thermo Fisher公司。小型台式离心机购自德国Eppendorf公司。细胞T25培养瓶购自美国Corning公司。超低吸附六孔板购自美国Corning公司。六孔板购自美国Costar公司。μ-Slide血管生成培养板购自德国ibidi公司。2.5 μl、10 μl、20 μl、100 μl、1 ml移液枪均购自美国Eppendorf公司。
1.3 方法
1.3.1 细胞培养 3种乳腺癌细胞株和HUVEC使用含10%FBS、100 μg/ml链霉素和 100 U/ml青霉素的 RPMI 1640或DMEM完全培养基,置于5%CO2的37°C恒温培养箱内培养。待细胞贴壁生长超过80%后,利用胰淀粉酶进行消化后传代或冻存。
1.3.2 建模与BC-ECs提纯 3种乳腺癌细胞种植于小鼠背部皮下,成瘤后的乳腺癌组织分别剪成0.1 cm×0.1 cm×0.1 cm的小块,加入含0.1%胶原酶Ⅰ的无血清RPMI 1640培养基震荡消化,经过滤、洗涤后加入抗CD105抗体交联免疫磁珠。细胞悬液加入分选柱进行分选,收集被磁珠标记的阳性细胞再进行培养,最终得到BC-ECs。
1.3.3 免疫组织荧光检测CD105及CD31蛋白表达成瘤后的乳腺癌组织甲醛固定后,制作石蜡切片,脱蜡、修复后分别用抗CD105抗体和抗CD31抗体4°C孵育过夜,第2天冲洗后,分别用FITC标记的二抗和罗丹明标记的二抗避光孵育,再次冲洗后进行细胞核DAPI染色,荧光镜下观察。
1.3.4 血管内皮细胞成管实验 实验前1 d将Matrigel基质胶于4°C融化。实验时在μ-Slide血管生成培养板的每个孔中加入10 μl Matrigel。然后将μ-Slide板放入培养皿中,加入吸满水的吸水纸以防止μ-Slide板中水分蒸发。培养皿在培养箱中放置30 min使胶凝固;同时开始准备细胞悬液,即BC-ECs和HUVEC,细胞消化后将细胞悬液浓度调整为2×105个/ml;取出μ-Slide板,每孔加入50 μl细胞悬液,然后放入培养箱继续培养,每隔4~6 h用光学显微镜拍摄实验结果。
1.3.5 血管内皮细胞吞噬实验 将BC-ECs和HUVEC分别接种于24孔板中,培养48 h;吸去培养基,用无血清的EGM血管内皮细胞培养基培养3 h;加入无血清的EGM培养基配制的DiI标记的乙酰化低密度脂蛋白(DiI-ac-LDL)(10 μg/ml),37 °C 孵育 4 h;吸去培养基,PBS漂洗3次,去除未结合的DiI-ac-LDL;加入完全培养基,荧光显微镜观察。
1.3.6 实时荧光定量PCR检测miR205-3p表达 提取3种细胞成瘤组织中的BC-ECs及HUVEC的总RNA,反转录成cDNA,反应体系20 μl,反应条件16℃30 min,45℃ 30 min,85℃ 5 min。运用 SYBR Green法检测miR205-3p的表达情况,运用反应条件94℃15 min,94 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共循环40 次;最后 72 ℃延伸6 min。每组样品重复3次,试验重复3次,统计分析标本中miR205-3p的表达情况。
1.3.7 荧光素酶报告基因检测 利用靶基因预测数据库 Target Scan网站(http://www.targetscan.org)预测miR205-3p的靶基因。发现miR205-3p的5'端可与MDM2 mRNA的3'UTR区特异性结合,推测MDM2是miR205-3p的靶基因。为验证这一预测,构建突变型MT-MDM2和野生型WT-MDM2的MDM2的3'-UTR荧光素酶报告基因载体,利用Lipofectamine 3000将miR205-3p和miR-NC(阴性对照)分别与MT-MDM2和WT-MDM2共转染MDA-MB-231细胞中,然后将各组MDA-MB-231细胞培养48 h,收集各组细胞,通过双荧光素酶报告检测试剂盒(美国Promega公司)检测各组细胞的荧光素酶活性。
1.3.8 Western blot检测MDM2蛋白的表达 提取组织总蛋白,SDS-PAGE分离蛋白,电转移至硝酸纤维素膜上。5%脱脂牛奶封闭后,加入一抗(MDM2 1∶200)4 °C孵育过夜。TBST洗膜3次,接着加入辣根过氧化物酶标记二抗室温孵育1 h后,再用TBST洗膜。最后进行显影拍照。
1.3.9 MTT实验检测细胞增殖能力 将BC-ECs分成3组,空白对照组(Mock组)、阴性对照组(miR-NC组)和实验组(miR205-3p组),接种于96孔板中,培养24、48、72 h,每个时点每孔加入20 μl MTT试剂后继续培养4 h吸出培养基,再加入150 μl DMSO试剂,检测各孔570 nm处的吸光值。
1.3.10 乳腺癌小鼠移植瘤模型建立 将小鼠20只随机分成Blank组(空白对照组)和miRNA激动剂miR205-3p agomir组(实验组),每组10只。将MDA-MB-231制备成1×107/ml的细胞悬液,接种于每只小鼠背部皮下。同时,尾静脉分别注射0.9%氯化钠注射液或miR-205-3p agomir 2 nmol,注射1次/4 d,观察成瘤时间,每周测量小鼠瘤体大小,计算肿瘤体积,绘制生长曲线,28 d后处死小鼠,获得肿瘤组织。肿瘤体积=长径×短径2×0.5(cm3)。
1.4 观察指标 (1)验证分选所得的BC-ECs的纯度及其内皮细胞生物学功能。(2)验证生物信息学预测得到miR205-3p的靶基因MDM2,并通过改变miR205-3p的表达水平,是否可以改变BC-ECs的生物学功能。
1.5 统计学处理 采用SPSS 17.0统计软件。计量资料以表示,多组比较采用单因素方差分析,两两比较采用LSD-t检验,两组比较采用两独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 乳腺癌移植瘤中人源性血管内皮细胞表面标记物的表达、BC-ECs的提纯及其内皮细胞生物学功能检测结果 将乳腺癌细胞株(MDA-MB-231)细胞悬液种植于NOD SCID小鼠背部皮下后形成移植瘤,通过免疫荧光实验,可见人源性内皮细胞表面标志物CD105和CD31的表达(图1,见插页)。
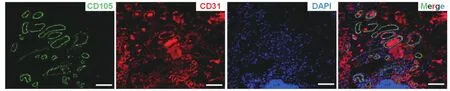
图1 免疫荧光检测MDA-MB-231成瘤组织中人源性血管内皮表面标记物CD105和CD31的表达(×100)
通过抗CD105磁珠分选,从MDA-MB-231移植瘤组织中纯化得到BC-ECs,镜下可见其与HUVEC均呈鹅卵石样形态(图2a,见插页)。运用内皮细胞成管实验和内皮细胞吞噬实验对BC-ECs和HUVEC进行内皮细胞功能鉴定。结果发现BC-ECs和HUVEC能在Matrigel胶上形成管腔样结构(图2b,见插页),并能够吞噬ac-LDL后发出红色荧光(图2c,见插页)。
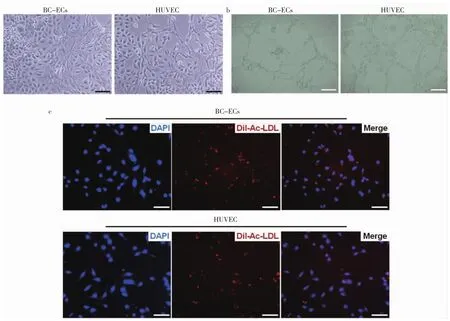
图2 乳腺癌血管内皮细胞(BC-ECs)和人脐静脉内皮细胞(HUVEC)细胞形态及内皮细胞生物学功能检测[a:光镜下所见(×400);b:内皮细胞成管实验光镜下所见(×200);c:内皮细胞吞噬实验光镜下所见(×400)]
2.2 BC-ECs miR205-3p表达水平检测结果及靶基因的预测、鉴定结果 实时荧光定量PCR检测3种乳腺癌细胞(MDA-MB-231、MDA-MB-453及 MCF-7)成瘤组织中的BC-ECs及HUVEC miR-205-3p的表达情况,结果发现BC-ECs中miR205-3p的表达水平相比HUEVC 明显降低(P<0.05,图 3)。

图3 在乳腺癌血管内皮细胞(BC-ECs)与人脐静脉内皮细胞内皮细胞(HUVEC)的miR205-3p表达水平比较(*P<0.05)
根据Target Scan生物软件分析,发现miR205-3p与MDM2的3'UTR区有一处高度匹配,位于62~68位置(图4a)。野生型MDM2基因荧光素酶表达载体WTMDM2与miR205-3p共转染MDA-MB-231细胞后,miR205-3p组MDA-MB-231细胞荧光素酶活性较miR-NC组显著降低(P<0.05),而突变型MDM2基因荧光素酶表达载体MT-MDM2和miR-205-3p共转染MDA-MB-231细胞后,miR-205-3p组MDA-MB-231细胞荧光素酶活性较miR-NC组差异无统计学意义(P>0.05)(图4b),证实MDM2为miR205-3p的潜在靶点,miR205-3p可负性调控MDM2的表达。

图4 miR205-3p与鼠双微体2基因(MDM2)3'UTR区结合(a:生物信息学分析miR205-3p与MDM2的3'UTR区结合位点;b:荧光素酶报告基因实验证实miR205-3p与靶基因MDM2的3'UTR 区结合,*P<0.05)
2.3 BC-ECs过表达miR205-3p后MDM2蛋白表达及增殖能力变化 Western blot检测结果显示过表达miR205-3p后,MDM2在BC-ECs中表达降低(图5a)。同时,转染miR205-3p后,BC-ECs的增殖能力在同时间段检测时的OD值明显低于阴性对照组及空白对照组,差异具有统计学意义(图5b)。

图5 miR205-3p靶向鼠双微体2基因(MDM2)影响BC-ECs的增殖能力(a:BC-ECs中MDM2蛋白表达电泳图;b:3组BC-ECs增殖能力比较,*P<0.05)
2.4 注射miR205-3p agomir对体内移植瘤生长的影响接种28 d后测量移植瘤体积空白对照组和miR205-3p agomir组分别为(1.19±0.14)cm3和(0.54±0.09)cm3。miR205-3p agomir组移植瘤体积明显小于空白对照组(P<0.05,图 6)。

图6 注射miR205-3p激动剂对体内移植瘤生长的影响(a:移植瘤体积生长曲线图;b:实验组和对照组的移植瘤组织照片)
3 讨论
乳腺癌是我国女性发病率第一位的恶性肿瘤[7]。乳腺癌的发生、发展过程中伴随着大量功能基因表达的变化、表观遗传学的变化及多种分子交互作用的变化。因此,探讨乳腺癌发生与发展过程中的分子作用机制对其提高治疗效果、改善预后起到十分重要的作用。
miRNA是一类长度为22个核苷酸,可以在转录水平调控基因标的的非编码RNA[8]。近年来,大量的研究发现miRNA作为癌基因或抑癌基因调节肿瘤细胞的增殖、分化、侵袭及凋亡,参与到肿瘤的发生、发展和转移的过程中,在癌症的发病机制、早期诊断、治疗及预后中起到了重要的生物学功能调控作用。miR-205位于人染色体(1q32.2)LOC642587基因座中的第2个内含子中,在脑胶质瘤的研究中发现,过表达miR205可通过靶向调控TBX18,抑制其侵袭能力,起到抑癌的作用[9]。在前列腺癌中,提高miR205的表达可靶向ZEB1基因来抑制前列腺癌细胞的侵袭和转移[10]。也有研究发现,过表达miR205可抑制E-钙黏蛋白的表达,同时激活AKT和下调GSK-3β促进Snail蛋白的表达,达到抑制子宫内膜癌的侵袭和转移[11]。在乳腺癌的相关研究中,miR205的表达通常都是降低的。有研究显示,高转移性乳腺癌中miR205的表达水平相对于低转移乳腺癌细胞更低[12]。在三阴性乳腺癌的研究中发现,miR205在三阴性乳腺癌细胞中表达极低,当过表达miR-205后,三阴性乳腺癌细胞的侵袭及迁移能力均下降,其机制在于miR205负向调控整合素α5,抑制Src/Vav2/Rac1途径,降低癌细胞的恶性生物学功能[13]。综上研究可以发现,miR205在乳腺癌细胞的发生、发展中具有密切的相关性。
但是,miRNA在肿瘤血管中的研究却鲜有报道。1971年,Folkman等[14]首次提出了肿瘤生长的血管依赖性,血管生成是肿瘤生长的必要条件,肿瘤发生后进一步生长必须依赖血管的生成。Endoglin(CD105)是一种表达于增殖活跃的内皮细胞的同型二聚体跨膜糖蛋白[15]。众多研究表明,CD105涉及血管的生成,认为是一种肿瘤血管内皮细胞表面非常特异性的标志物[16-17]。通过免疫组化染色结果表明:在乳腺癌、非小细胞肺癌、宫颈癌等恶性肿瘤组织中,采用Endoglin标记微血管密度明显优于CD31、CD34等相关抗原标记的结果,可作为独立的预后指标[18-19]。因此,本研究选用CD105作为肿瘤来源的血管内皮细胞的特异性表面标志物,从乳腺癌皮下成瘤组织中提纯得到的CD105+细胞(即BC-ECs),通过镜下观察、成管实验和内皮细胞吞噬实验证实其具有内皮细胞功能;接着通过实时荧光定量PCR检测发现,BC-ECs中的miR205-3p表达水平相比HUCVE降低。这提示miR205-3p可能作为一个抑癌基因在BC-ECs的生物学功能中起重要的调控作用。
人MDM2基因位于12号染色体长臂12q[20]。其转录产物表达于人体的多种器官,其中骨骼肌含量最高,与细胞基本生理活动有关[21-22]。MDM2最重要的作用是抑制p53基因的激活转录功能和抗肿瘤活性,其编码蛋白产物p90与p53蛋白结合,促进p53蛋白的降解,从而抑制肿瘤的增殖能力[23]。本研究通过生物信息学分析发现,miR205-3p可能与MDM2基因的mRNA 3'UTR区特异性结合。笔者通过荧光素酶报告基因实验证实了miR205-3p与MDM2 mRNA 3'UTR具有互补结合位点,并结合Western blot实验表明当提高miR205-3p的表达水平后,MDM2蛋白的表达受到抑制。为了进一步验证miR205-3p通过靶向调控MDM2参与肿瘤血管内皮细胞增殖的调控,在体外实验中,把miR205-3p mimics转染BC-ECs后,其增殖受到抑制。体内实验中,把miR205-3p agomir通过尾静脉注射到小鼠体内后,乳腺癌皮下瘤组织生长速度降低。以上结果提示,miR205-3p通过调控MDM2表达来抑制BC-ECs的增殖,间接抑制乳腺癌组织的生长。
综上所述,miR205-3p在BC-ECs中呈低表达,上调miR205-3p靶向MDM2蛋白表达降低,可抑制BCECs的增殖。因此,miR205-3p有望成为抗乳腺癌血管治疗的潜在靶点。

