IL-36s在掌跖脓疱病中的作用的研究
李 娜,李东霞,王媚媚,吕新翔
(内蒙古医科大学附属医院皮肤性病科,内蒙古 呼和浩特 010050)
掌跖脓疱病(palmoplantar pustulosis,PPP)是属于皮肤炎症性疾病中较为多见的一种,疾病特点病程时间长,易反复发作,难完全治愈。PPP的病变特征主要存在于掌跖部位,红斑泛发,伴随无间断发作的水疱和脓疱,角化及苔藓样变、及伴随大量脱屑[1]。大量国内外报道称PPP的发病机制与扁桃体炎、牙周炎或金属过敏的发病有关联[2],但具体的治病机理仍未发现明确的定论。Barber首次提出PPP可以作为银屑病的一个分型并且Brunasso等[3]从流行病学和临床表现等方面比较发现,两者存在多个相同点。本实验通过对20例PPP患者的临床资料综合分析后,采用三种不同检测方法对掌跖脓疱病患者外周血白细胞介素(interleukin,IL)-36s(IL36s)包括IL-36α、IL-36β和IL-36γ 3种细胞因子的表达水平,以及皮损处表皮组织细胞IL-36s变化程度,探讨IL-36s在掌跖脓疱病的表达情况。
1 材料和方法
1.1 材料
皮损组织均来自2015-01~2015-12医院皮肤科门诊病房,采集了20例掌跖脓疱病患者,所有病例的确诊均符合掌跖脓疱病的诊断标准[4]。同期收集对照组正常者20例,所有受试者在受试前均需签署知情同意书,上述实验均通过医院医学伦理委员会的许可。
1.2 方法
1.2.1临床资料和血清及标本收集 所有入组受试者均进行了一系列的相关确诊实验,并详细记录。受试者晨起空腹的外周静脉血5~7mL,室温下静置15~20min,离心4℃、3500r/min、8min,血清分装保存,于-70℃冰箱备用。掌跖脓疱病患者实验组与健康对照组组织活检标本取自内蒙古医科大学附属医院皮肤科,经HE染色病理确诊为掌跖脓疱病,标本取出后迅速置于液氮速冻待用。
1.2.2细胞因子测定采用固相夹心ELISA方法检测受试病人血液中的IL-36α,IL-36β,IL-36γ的浓度以人IL-36s的ELISA试剂盒购买自武汉云克隆科技股份有限公司(SCL621Hu)说明书参照进行试验。提前取出ELISA试剂盒,于室温下放置20min,然后制备洗涤剂。首先,将100μL标准品和样品添加到反应板中以获取标准曲线,并在室温下孵育2h,然后洗涤并补充100μL在室温下孵育的检测抗体。2h后,洗涤并补充100μL的链霉亲和素-HRP工作稀释液,在室温下孵育20min。将板洗涤3次,补充100μL底物,在避光的情况下在室温下温育20min,并立即补充终止溶液以终止反应。最终通过多模式酶标仪(美国BioTek Instruments)在450nm处测量。
1.2.3免疫组化实验 免疫组化实验法,具体步骤如下:(1)4μm的石蜡片采用连续的切片,均匀的平铺于APES玻片,置于80℃的烘片机上,烘30min;(2)石蜡片浸入Ⅰ和Ⅱ均为二甲苯的液体,脱蜡分别为10min左右完成;(3)侵入连续梯度浓度的乙醇:I号:100%-II号:100%-III号:95%-IV号:80%-V号:70%,每个浓度梯度浸泡5min,然后去离子水冲洗2次,每次2min,PBS(pH7.4)冲洗2次,每次2min,进行脱蜡水化;(4)切片侵入柠檬酸缓冲液,进行微波修复,大火4min转中火10min,冷却至室温后,选用pH7.4的PBS洗3遍,总共9min,冲洗时勿破坏皮损组织;(5)将配置好的3%的双氧水(去离子水稀释30%双氧水),置37℃、10~15min。PBS需要冲洗5min;(6)每张切片滴加一滴山羊血清,37℃下孵育15min,PBS(pH7.4)冲洗3次,每次3min;(7)去掉血清,吸干,加入一抗,37℃至30min。PBS洗9min;(8)吸干切片,加入辣根过氧化物酶标记二抗,37℃至30min。PBS洗12min;(9)切片滴加显色液DAB(新配置);(10)Harris复染,约1min后水洗,1%浓度盐酸乙醇分化,洗至蓝色;(11)自来水冲洗,切片放入乙醇:70%-80%-95%-100% I-100%II-二甲苯I-II脱水,每个浸入低于2min;(12)收集皮损组织旁加入中性树脂,盖玻片盖好晾干;(13)显微镜观察切片,采集图像后取阳性对照为质控标准;正常皮肤组织为正常对照。
1.2.4IL-36s免疫组化法判定的结果IL-36s于表皮各层细胞表达强度评定标准:(1)低倍镜选择石蜡切片阳性细胞密集、清晰的15个视野,观察计算阳性细胞/100个细胞高倍镜下的比例。计算上述比例的平均值,即可得出IL-36s所在细胞的阳性数量的比例;(2)阳性细胞占比和染色强度评分:①着色细胞占比百分率分为5种5个分值:<5%:0分,5~25%:1分,26~50%:2分,51~75%:3分,>75%:4分;②按照呈色细胞颜色:0分:无色、1分:淡黄色、2分:棕黄色、3分:棕褐色;③上述两步相乘分出阳性等级;0分:阴性(—),1~4分:(+),5~8分:(++),9~12分:(+++)。
1.2.5RNA的逆转录和实时定量PCR反应 采用RNAiso Plus(Taraka)方法提取人皮肤组织样本中总RNA,实时定量PCR,(GoTaq qPCR Master Mix Promega、RevertAid First Strand cDNA Synthesis Kit Thermo)合成cDNA。检测目的基因,在各样本中的表达。PCR条件如下:预变形95℃3min,变形95℃10s,退火60℃20s,延伸72℃20s,循环45次,每个重复3次。内参GAPDH,2(-ΔCt)计算方法,得出目的基因具体的表达量,PCR引物(见表1)。
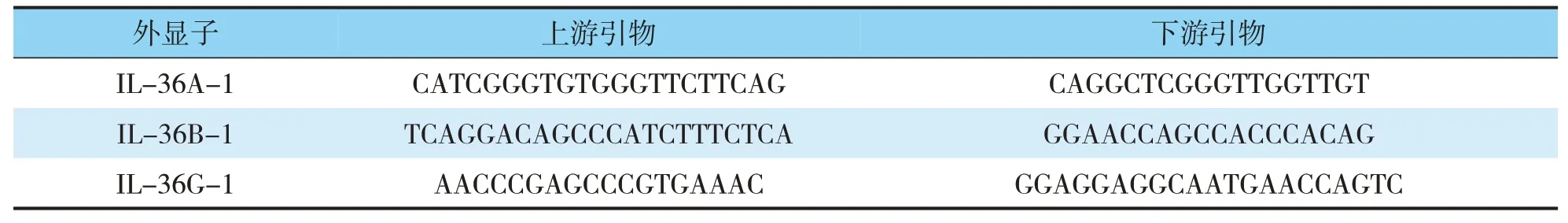
表1 IL36s基因的引物序列
1.2 统计学方法
GraphPad Prism8进行F test to compare variances及Ordinary one-way ANOVA分析,检验水准为α=0.05,P<0.05认为有统计学意义。t检验用于独立样本组间比较,检验水准为α=0.05,P<0.05认为有统计学意义。免疫组化阳性细胞百分比利用卡方检验比较,检验水准为α=0.05,P<0.05认为有统计学意义。
2 结果
2.1 IL-36s在掌跖脓疱病血清中的表达
ELISA结果表明,对纳入本研究的20例掌跖脓疱病和20例正常者的临床资料进行比较统计,患者血清中IL-36α浓度显著的上升[normal:(26.97±25.60)pg/mL VS patient:(595.2±1041.65)pg/mL],差异有统计学意义(P<0.01)(见图1),细胞因子IL-36β和IL-36γ,在健康者和PPP患者血清中浓度无统计学差异[IL-36β normal:(8.02±477.88)pg/mL VS patient:(149.86±512.34)pg/mL](P>0.05)(见图2),IL-36γ[normal:(34.02±60.23)pg/mL VS patient:(27.48±83.97)pg/mL](P>0.05)(见图3)。
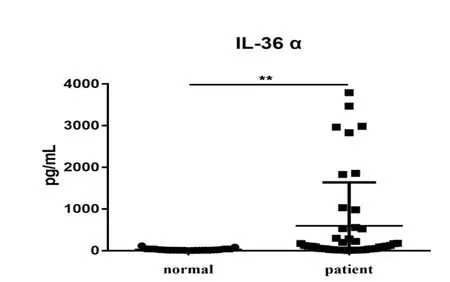
图1 健康人与PPP患者血清中IL-36α含量比较(pg/mL,mean±SD)
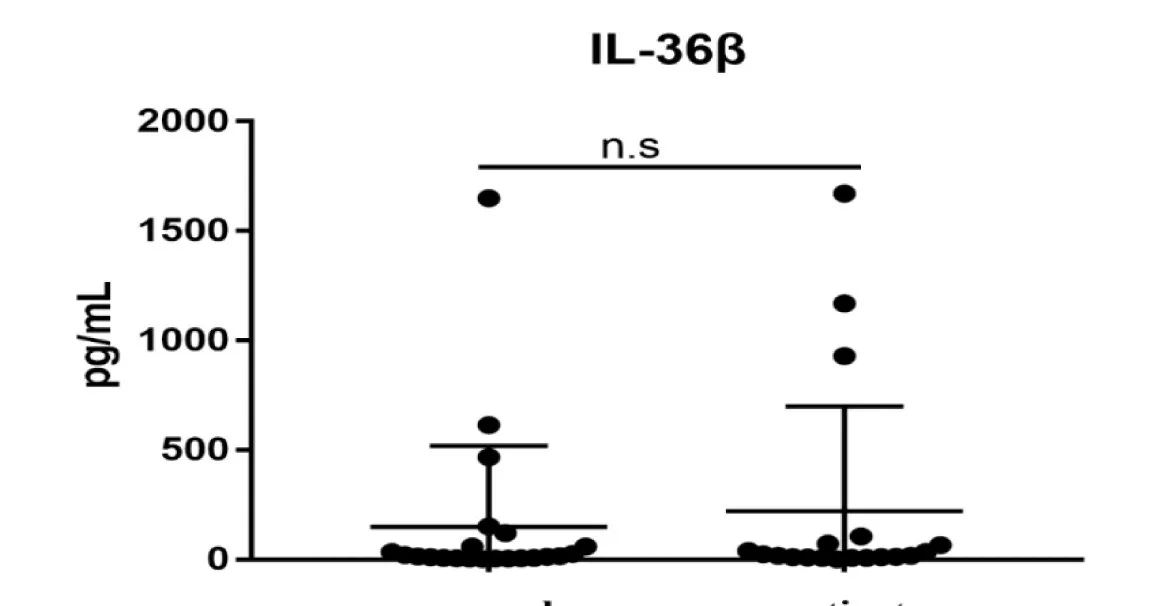
图2 健康人与PPP患者血清中IL-36β含量比较(pg/mL,mean±SD)
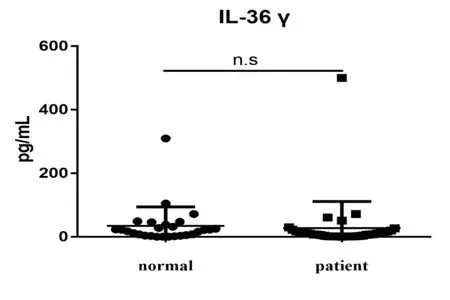
图3 健康人与PPP患者血清中IL-36γ含量比较(pg/mL,mean±SD)
2.2 PPP患者与健康组表皮组织中IL-36s mRNA的比较
PPP患者表皮组织中IL-36α的表达水平明显高于正常组,差异存在明显的统计学意义[(0.0016±0.004)VS 0](P<0.01)(见图4)。IL-36β以及IL-36γ其表达水平在PPP患者和健康组之间无显著差异(P>0.05)(见图5、6)。

图4 健康人与PPP患者组织中IL-36AmRNA比较
图5 健康人与PPP患者组织中IL-36B mRNA比较
图6 健康人与PPP患者组织中IL-36G mRNA比较
2.3 免疫组化实验
2.3.1IL-36s体内表达部位 检测IL-36α的在表皮各层组织中的表达,通过对样本的免疫组化染色,我们发现PPP患者相对于健康对照组,IL-36α在表皮全层组织中阳性细胞明显增多,而两组中IL-36β和IL-36γ两个炎症因子的表达在表皮各层中的阳性细胞分布基本相同,且未见明显增多(见图8)。
2.3.2表皮中IL-36α表达数量 患者组和正常组表皮各层细胞中IL-36α表达,阳性率分别为85%(17/20)和10%(2/20),有显著性差异(P<0.05)。而IL-36β和IL-36γ的表达阳性率在两组间无显著差异(P>0.05)(见图7、图8A、B、C)。
图7 健康人与PPP患者表皮细胞中IL-36α染色结果比较(X40)
2.3.3IL-36s在表皮中阳性比率及表达强度的比较
患者组表皮各层细胞中IL-36α的表达强度(65.2%)高于健康对照组(5.5%)存在显著差异(P<0.05)(见图8A)。而IL-36β、IL-36γ在PPP患者组及对照组的表达未见明显差异(P>0.05)(见图8B、C)。IL-36α,IL-36β,IL-36γ在同一PPP患者表皮组织中阳性表达的强度存在差异,IL-36α的表达明显高于后两者(见图8D)。
图8 健康人与PPP患者表皮细胞中IL-36α、IL-36β、IL-36γ含量比较(A,B,C分别表示IL-36α,IL-36β,IL-36γ在PPP患者及健康对照组表皮中阳性细胞比率的差异,D表示IL-36α,IL-36β,IL-36γ在PPP患者表皮组织中阳性表达的强度差异)
3 讨论
掌跖脓疱病PPP是较为多发于掌跖部位,其属于慢性复发性皮肤病,目前国内外关于诱发PPP病的病因尚未清楚。PPP发病与其体内多个系统包括免疫系统、精神状态以及全身的内分泌系统,多功能失调存有着密切关联。Camp对“脓疱型银屑病”给出分类,掌跖脓疱病划分为局限性脓疱型银屑病。主要发病年龄在30~60岁,女性居多。其发病的主要表征为红斑基础上,反复出现无菌性脓疱,并伴有一定量的角化、脱屑以及中度或严重瘙痒[6]。
IL-36s:IL-36α、IL-36β和IL-36γ[5],3个功能相似的生物学分子均属于IL-1中的一种,人体血液中的IL-36s需要通过与IL-36R这种特异性受体相结合,才能发挥促炎作用,IL-36Ra是主要的受体拮抗剂。IL-36s、IL-36R和IL-36Ra三个相关炎症因子在皮肤、气管和食道等上皮组织细胞含量高的部位大量表达[7]。而角质的形成是基于免疫细胞中的单核细胞和B细胞等受到应激后,活化产生的IL-36s。IL-36s、IL-36R与IL-36Ra三个蛋白组成IL-1家族的一条新的信号传导通路,在其作用下启动IL-36s相关基因的表达,从而发挥促炎作用,IL-36R和IL-36Ra相结合的复合物不能再结合IL-1 RAcP,信号转导通路激活收到抑制,从而起到抗炎作用[8~12]。IL-36s、IL-36R与PPP的发病紧密相关,病理组织的特点:棘层肥厚和真皮内炎细胞浸润,其特点与银屑病皮损较为一致,且皮损组织处IL-17、IL-22、IL-23和抗菌肽等的基因表达呈明显增多。银屑病与掌跖脓疱病在种属上可以归为一类,通过相关报道可知,IL-36β和IL-36γ表达水平在银屑病发作期显著升高,且随着病情的发展,IL-36β和IL-36γ表达水平在重度的银屑病患者体内显著升高,其表达水平的升高是银屑病发病机制的重要组成部分[13],而IL-36α和IL-36Ra血清表达水平没有变化,根据上述的推断我们设计并进行了本次实验,对PPP的疾病过程中IL-36s相关因子的变化做出了验证。
我们采用三种方法验证:(1)ELISA主要检测PPP的发病组及正常对照组血清中IL-36α、β和γ三个指标的浓度,结果显示:患组和对照组的IL-36β和IL-36γ表达无差异,IL-36α因子表达水平在PPP脓疱发作期显著升高,与银屑病的炎症因子IL-36表达有所不同;(2)荧光定量PCR法验证IL-36α表达水平在PPP患者与健康对照组血清中呈高度正相关;(3)免疫组化方法,在皮损组织处炎症细胞明显增多,其中表皮炎症细胞IL-36α表达显著增高,以上研究结果提示,IL-36α、IL-36β和IL-36γ在患者血清中可能有相似的生物学活性,但是对于不同的脓疱性疾病,表达情况会有明显差异。之前推测的IL-36R在PPP患者中可能参与发病,鉴于ELISA法和荧光定量PCR法均没有看出差异,关于IL-36R在PPP发病中的影响需要进一步进行详细的基因检测和一些体外试验。
综上所述,根据本研究结果提示IL-36α在PPP血清及组织中均存在高表达,在PPP的发病过程中可能起到重要作用。但IL-36α在PPP患者血清和皮肤组织中高表达对疾病发生、发展有何具体影响,包括IL-36相关的其它细胞因子在掌跖脓胞病中的作用,尚需扩大样本量,同时需要丰富检测方法从而进行更全面更进一步的证实。

