基于混菌耦合发酵策略合成3′-唾液酸乳糖
游星,郭进,张洪涛*,闫竞宇,CHAI Wengang ,周文,刘栗彤,黎玉, 吴剑荣,詹晓北*
1(糖化学与生物技术教育部重点实验室,江南大学 生物工程学院,江苏 无锡,214122) 2(中国科学院大连物理化学研究所,辽宁 大连,116021) 3(Glycoscience Laboratory,Imperial College London,South Kensington Campus,UK London,SW7 2AZ)
母乳寡糖作为在人乳中含量仅次于乳糖和脂类的第三大固体成分[1],对婴幼儿的健康发育具有重要作用。其主要由2种结构组成:一种由中性寡糖组成,其中许多是岩藻糖基化的;另一种则含有酸性寡糖,其中大多数是唾液酸化的[2]。唾液酸化寡糖中最丰富的结构是唾液酸与乳糖结合产生的唾液酸乳糖[3],根据结合位置不同分为3′-唾液酸乳糖(3′-sialyllactose,3′-SL)和6′-唾液酸乳糖[4]。3′-SL具有抗菌和抗炎活性,可以使婴儿肠道免受感染,有助于婴儿免疫系统的发育和成熟,促进婴儿大脑成熟,改善学习能力等作用[5-8],近年来受到人们越来越多的关注。
合成唾液酸乳糖的方法主要有化学合成法和生物合成法,由于化学合成法涉及到繁琐的保护和去保护步骤,不适合大规模生产,所以利用生物技术合成唾液酸乳糖成为最佳方案[9]。唾液酸乳糖的合成需要将唾液酸活化为胞苷单磷酸-N-乙酰神经氨酸(cytidine 5′-monophosphateN-acetylneuraminic acid,CMP-Neu5Ac)[10],该过程是一个需要消耗大量三磷酸胞苷(cytidine triphosphate,CTP)的过程。由于CTP价格昂贵(8 000元/kg),造成作为唾液酸乳糖前体物质的CMP-Neu5Ac不仅价格昂贵,并且不容易大量获得,限制了唾液酸乳糖的产量。针对以上缺陷,ENDO等[11]建立了以3株重组大肠杆菌和产氨棒杆菌耦合合成唾液酸乳糖的系统。该策略通过产氨棒杆菌实现CMP到CTP的再生,降低了CTP的使用。但是由于其需要尿苷三磷酸(uridine triphosphate,UTP)来实现CTP的再生,在发酵体系中不得不引入专门合成UTP的菌株,使得该体系不仅发酵控制复杂,而且生产成本高的问题依然存在[12-13]。因此,如何简化发酵催化体系组成与工艺成为亟需解决的问题。
研究发现酵母利用自身的酶系能有效地将CMP催化合成CTP[14]。啤酒酵母具有来源广、培养方便、价格低廉等特点,还有不能利用乳糖发酵的特征,这样以乳糖作为底物时就不会被酵母细胞所代谢消耗。因此,研究团队提出了3菌耦合发酵合成3′-SL的方案(见图1):

图1 设计的全细胞催化合成唾液酸乳糖路线Fig.1 Designed strategy for sialyllactose synthesis
(1)利用废啤酒酵母实现CTP的循环再生。
(2)用含有CMP-Neu5Ac合成酶基因(neuA)的工程菌JM109(DE3)/pET28a-neuA实现以CTP和N-乙酰神经氨酸(N-acetylneuraminic acid,Neu5Ac,也叫唾液酸)为底物合成CMP-Neu5Ac。
(3)用含有唾液酸转移酶基因(nst)的工程菌JM109(DE3)/pET28a-nst来实现唾液酸转移酶的表达。
(4)通过基因工程菌株JM109(DE3)/pET28a-neuA、JM109(DE3)/pET28a-nst和啤酒酵母混菌培养耦合发酵,实现3′-SL的合成。
1 材料与方法
1.1 实验材料
1.1.1 菌株与质粒
废啤酒酵母由江南大学生物工程学院啤酒吧平台馈赠;实验所需基因来源于脑膜炎奈瑟氏菌(Neisseriameningitidis);EscherichiacoliJM109(DE3),天根生化科技(北京)有限公司;表达载体pET28a为本实验室保存。
1.1.2 试剂与仪器
质粒提取试剂盒、细菌基因组DNA提取试剂盒、琼脂糖凝胶回收试剂盒,生工生物工程(上海)股份有限公司;限制性内切酶、Taq酶、T4DNA连接酶,宝生物工程(大连)有限公司;CMP、CTP(800元/100 g),杭州铠朋生物技术有限公司;Neu5Ac,本实验室合成;CMP-Neu5Ac,西安齐岳生物科技有限公司;3′-SL,大连化物所闫竞宇博士提供;其他为国产分析纯试剂。
PCR仪、蛋白电泳仪,Bio-Rad公司;高效液相色谱仪,岛津公司;高速冷冻离心机,Sigma公司。
1.1.3 培养基及培养条件
LB培养基(g/L):胰蛋白胨10,NaCl 10,酵母提取物5,pH 7.0,121 ℃灭菌20 min。
巧克力色琼脂平板(g/L):蛋白胨10,牛肉浸膏3,NaCl 5,琼脂20,脱纤维羊血50 mL,pH 7.2。
培养条件:将脑膜炎菌株接种到巧克力琼脂平板上,37 ℃、5%CO2环境培养24 h。
1.2 实验方法
1.2.1 工程菌JM109(DE3)/pET28a-neuA的构建
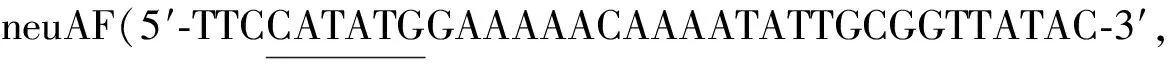
1.2.2 工程菌JM109(DE3)/pET28a-nst的构建

1.2.3 重组蛋白的表达与鉴定
将工程菌株接种至含20 μg/mL Kan的10 mL LB液体培养基中,37 ℃、200 r/min摇瓶培养12 h,再按2%(体积分数)的接种量转接到含20 μg/mL Kan的100 mL LB液体培养基中,37 ℃、200 r/min摇瓶培养至OD600约为0.6后,加入终浓度为0.1 mmol/L的IPTG进行诱导,200 r/min摇瓶培养20 h。4 ℃、8 000×g离心10 min收集菌体。将诱导前及诱导20 h的菌液与SDS-PAGE Loading缓冲液混匀,100 ℃加热10 min,得到诱导前、后样品,SDS-PAGE检测蛋白表达。
1.2.4 唾液酸乳糖及其中间产物的合成
1.2.4.1 CMP-Neu5Ac的生成
工程菌株合成CMP-Neu5Ac的转化条件:10 mL体系中包含60 mmol/L CTP、20 mmol/L MgCl2、60 mmol/L Neu5Ac、1 mmol/L DTT、150 mmol/L Tris、50 g/L JM109(DE3)/pET28a-neuA,在30 ℃、200 r/min的条件下反应4 h[15]。
双菌耦合催化合成CMP-Neu5Ac的转化条件:以70 mmol/L CMP、60 mmol/L Neu5Ac为底物,在300 mmol/L葡萄糖、20 mmol/L MgCl2、248.3 mmol/L KH2PO4、1 mmol/L DTT、150 mmol/L Tris、10 mL/L甘油、6 mL/L乙醛、100 g/L啤酒酵母、50 g/L JM109(DE3)/pET28a-neuA的溶液中,反应4 h(30 ℃,200 r/min)。
1.2.4.2 唾液酸乳糖的生成
单细胞合成3′-SL的转化条件:2 mL体系中包含1 mL按照1.2.4.1中方法合成的CMP-Neu5Ac溶液和1 mL 80 mmol/L乳糖、20 mL/L甘油、10 mL/L二甲苯、248.3 mmol/L KH2PO4、5 g/L MgCl2、4 g/L Nymeen S-215、50 g/L JM109(DE3)/pET28a-nst组成的溶液,30 ℃、200 r/min反应30 h[11]。
双菌耦合合成3′-SL的转化条件:以60 mmol/L CTP、60 mmol/L Neu5Ac、80 mmol/L乳糖为底物,在20 mmol/L MgCl2、1 mmol/L DTT、150 mmol/L Tris、20 mL/L甘油、10 mL/L二甲苯、4 g/L Nymeen S-215、248.3 mmol/L KH2PO4、50 g/L JM109(DE3)/pET28a-neuA、50 g/L JM109(DE3)/pET28a-nst溶液中,30 ℃、200 r/min的条件下反应30 h。
3菌耦合合成3′-SL的转化条件:以70 mmol/L CMP、60 mmol/L Neu5Ac、80 mmol/L乳糖为底物,在含300 mmol/L葡萄糖、20 mmol/L MgCl2、248.3 mmol/L KH2PO4、1 mmol/L DTT、150 mmol/L Tris、20 mL/L甘油、6 mL/L乙醛,10 mL/L二甲苯、4 g/L Nymeen S-215、100 g/L啤酒酵母、50 g/L JM109(DE3)/pET28a-neuA、50 g/L JM109(DE3)/pET28a-nst溶液中,30 ℃、200 r/min的条件下反应30 h。
1.2.5 唾液酸乳糖与CMP-Neu5Ac的分析检测
1.2.5.1 CMP-Neu5Ac的分析检测
TLC检测:参考HIGA等[16]方法略有改动。展开剂∶V(乙醇)∶V(1 mol/L pH 6.5乙酸铵)=6∶4,通过紫外线照射显色。
HPLC检测:色谱条件为依立特C185 μm(4.6 mm×250 mm);流动相A为0.1 mol/L磷酸钾缓冲液和8 mmol/L四丁基硫酸氢铵(pH 5.3),流动相B为70%流动相A与30%(体积分数)甲醇;梯度洗脱程序(A变化):0~2.5 min 100%,2.5~10 min 100%~60%,10~11 min 60%~0%,11~15 min保持0%,15~16 min 0%~100%,16~30 min保持100%;0.6 mL/min;进样量为10 μL;紫外检测波长270 nm;柱温30 ℃[17]。
1.2.5.2 唾液酸乳糖的TLC检测及分离纯化
TLC检测:展开剂:V(正丙醇)∶V(水)∶V(25%氨水)=7.5∶3∶2[18];显色剂:苯胺-二苯胺-磷酸显色剂,4 g二苯胺、4 mL苯胺与20 mL 85%(体积分数)磷酸共溶于200 mL丙酮中[19];105 ℃加热5 min显色。
分离纯化方法:HyperSep Hypercarb固相萃取小柱(SPE小柱),先用3 mL甲醇活化,再用3 mL水平衡,上样500 μL,流出的液体记为“流穿”,接着用3 mL水洗,得到的溶液记为“水洗”,最后用3 mL 80%(体积分数)乙腈洗脱,得到的溶液记为“纯化后”。
2 结果与分析
2.1 工程菌JM109(DE3)/pET28a-neuA的构建及NeuA诱导表达
以N.meningitidis基因组为模板,通过PCR获得大小为687 bp的neuA基因,然后将该基因引入pET28a载体,获得质粒pET28a-neuA。重组质粒pET28a-neuA经过NdeI和SalI双酶切后,结果如图2-a所示,得到两条片段分别大约为5 300 bp和700 bp。经测序验证正确后,得到重组质粒pET28a-neuA。
将重组质粒pET28a-neuA转入JM109(DE3)得到工程菌JM109(DE3)/pET28a-neuA,用IPTG诱导目的蛋白表达,SDS-PAGE电泳结果如图2-b所示,从图中可以看出,诱导20 h的全细胞在25~35 kDa有明显的表达条带,其分子质量与KARWASKI等[15]报道的CMP-Neu5Ac合成酶(NeuA)一致,说明NeuA在工程菌JM109(DE3)/pET28a-neuA中成功表达。

a-重组质粒pET28a-neuA双酶切图; b-重组质粒pET28a-neuA SDS-PAGE图a:M-10 000 DNA Marker;1-Nde I/Sal I双酶切 b:M-Protein Marker;1-诱导前全细胞;2-诱导20 h的全细胞图2 重组质粒pET28a-neuA电泳图Fig.2 Electrophoresis of recombinant plasmid pET28a-neuA
2.2 工程菌JM109(DE3)/pET28a-nst的构建及Nst的诱导表达
以N.meningitidis基因组为模板,通过PCR获得大小为1 137 bp的nst基因,然后将该基因引入pET-28a载体,获得重组质粒pET28a-nst。对重组质粒pET28a-nst进行了NcoI和BamH I双酶切验证,电泳结果如图3-a所示,得到2条片段分别大约为5 300和1 100 bp。经测序验证正确后,得到重组质粒pET28a-nst。
然后将重组质粒pET28a-nst转入JM109(DE3)得到工程菌JM109(DE3)/pET28a-nst。用IPTG诱导唾液酸转移酶(Nst)的表达,其SDS-PAGE电泳结果如图3-b所示,诱导20 h的全细胞与诱导前相比,其在35 k~45 kDa有明显的表达条带,与目标蛋白(43.3 kDa)一致。这表明Nst在工程菌JM109(DE3)/pET28a-nst中成功表达。
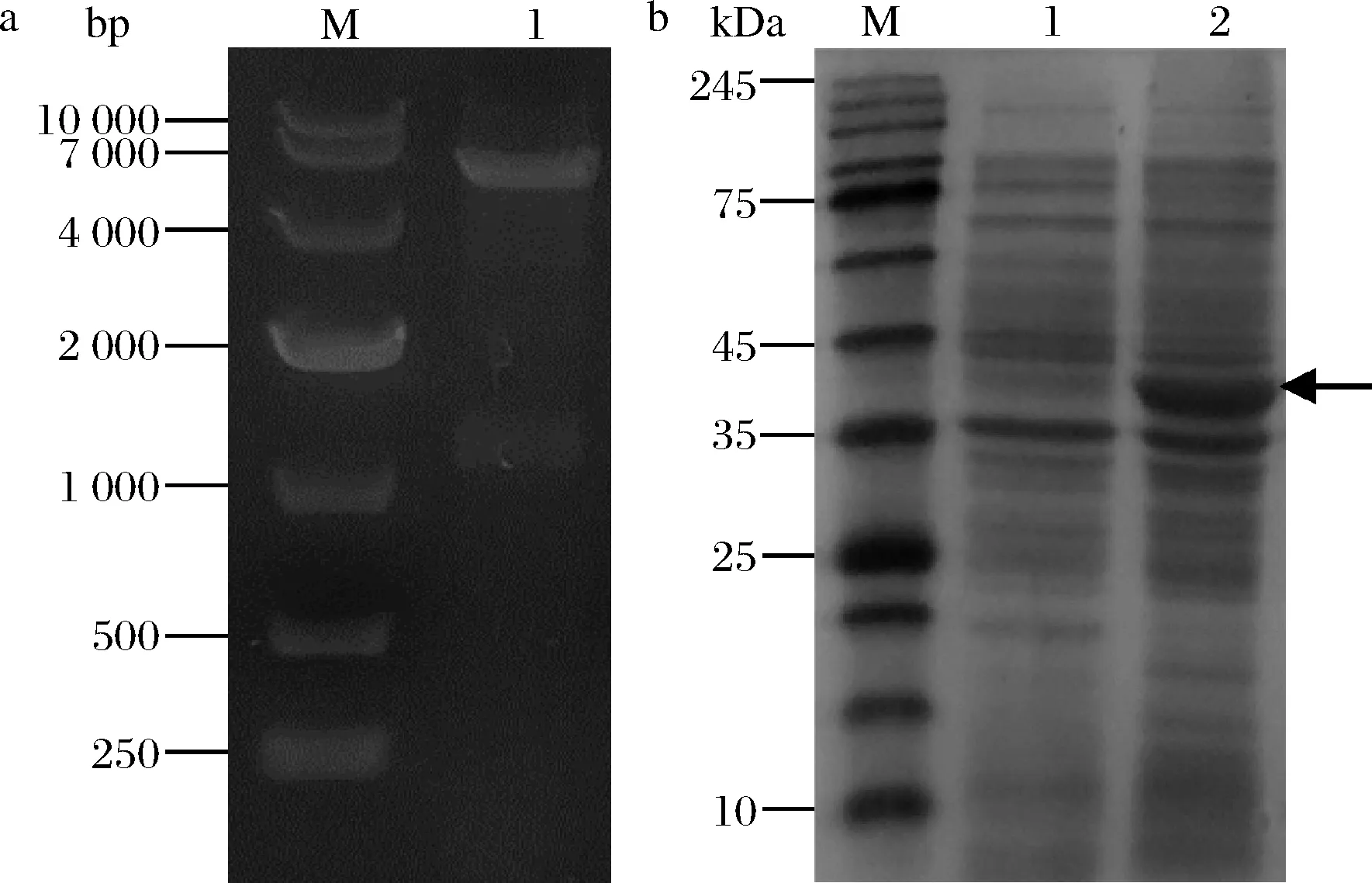
a-重组质粒pET28a-nst双酶切图; b-重组质粒pET28a-nst SDS-PAGE图a:M-10 000 DNA Marker;1-Nco I/BamH I双酶切 b:M-Protein Marker;1-诱导前全细胞;2-诱导20 h的全细胞图3 重组质粒pET28a-nst电泳图Fig.3 Electrophoresis of recombinant plasmid pET28a-nst
2.3 CMP-Neu5Ac耦合发酵合成体系优化
2.3.1 工程菌JM109(DE3)/pET28a-neuA合成CMP-Neu5Ac的条件优化
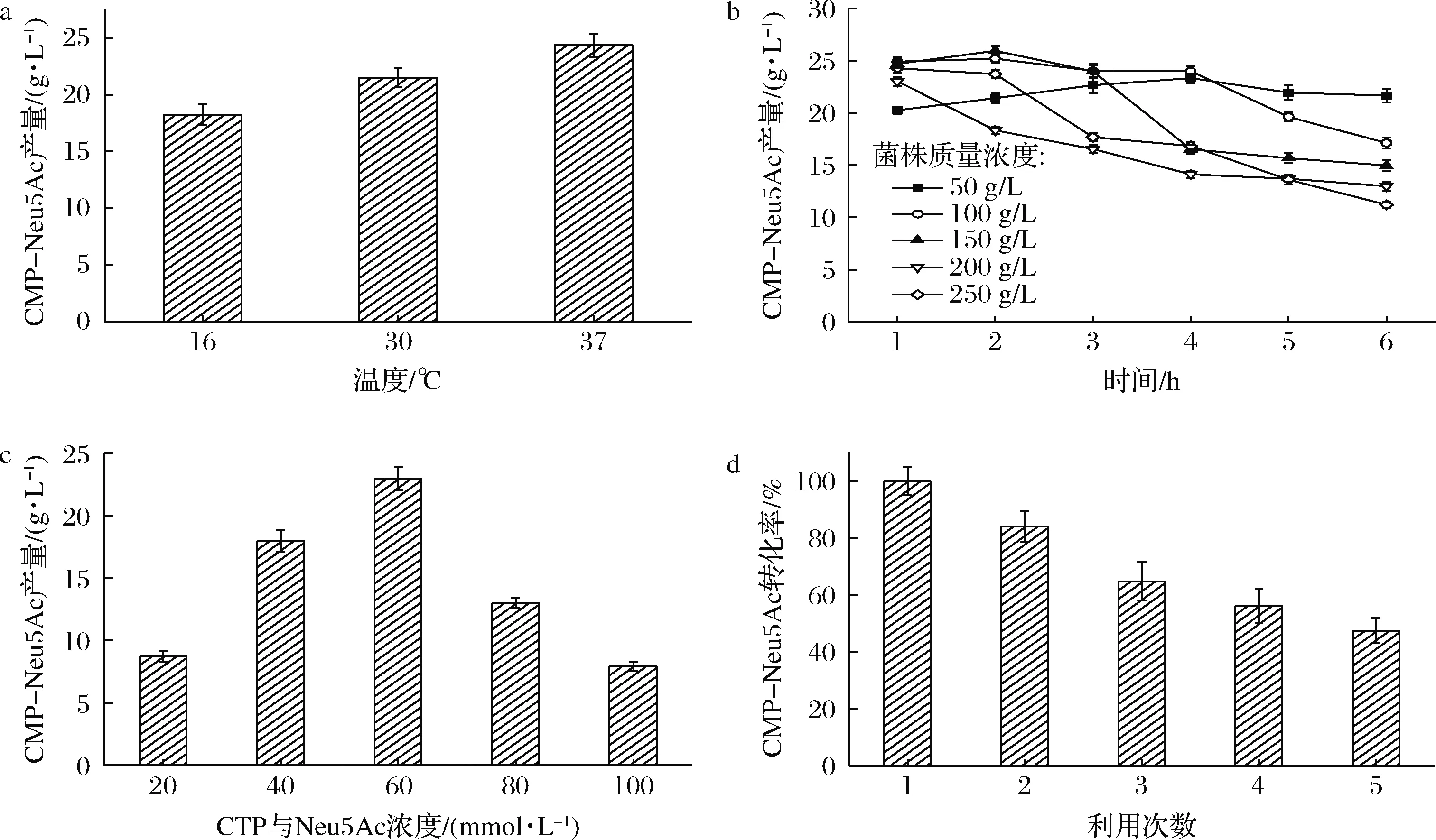
为顺利实现双菌(啤酒酵母和工程菌株JM109(DE3)/pET28a-neuA)耦合发酵高效合成CMP-Neu5Ac,对耦合发酵的条件进行了优化。首先用单一工程菌株JM109(DE3)/pET28a-neuA,从其诱导温度、工程菌株浓度、底物CTP和Neu5Ac浓度和工程菌株的循环利用次数,进行了单因素催化条件优化,结果如图4所示。
a-诱导温度;b-菌体浓度;c-底物CTP和Neu5Ac浓度;d-细胞重复使用次数图4 不同因素对JM109(DE3)/pET28a-neuA合成CMP-Neu5Ac的影响Fig.4 The influence of different factors on the synthesis of CMP-Neu5Ac by JM109(DE3)/pET28a-neuA
由图4-a可知,当细胞的诱导温度是37 ℃时,CMP-Neu5Ac产量高于16和30 ℃时的产量,因此,选取37 ℃为最佳诱导温度。
然后,以此优化的催化发酵体系为基础,探索菌体浓度对CMP-Neu5Ac合成的影响,结果如图4-b所示。菌株质量浓度为200和250 g/L时,其CMP-Neu5Ac在1 h时即达到最大值,随着催化时间的增加,CMP-Neu5Ac被逐渐降解;当菌株质量浓度为100和150 g/L时,其CMP-Neu5Ac的合成在2 h时达到最大数值,尤其是后者生成的CMP-Neu5Ac浓度最高,高达25.9 g/L,然后随着时间的增加,CMP-Neu5Ac迅速降解;当菌株质量浓度为50 g/L时,其CMP-Neu5Ac的合成先随着时间的增加而增加,反应4 h时CMP-Neu5Ac达到最大值,为23.3 g/L,转化率为63.2%,然后随着时间的增加,合成的CMP-Neu5Ac浓度基本保持稳定,维持在22 g/L。考虑到稳定的CMP-Neu5Ac体系更有利于后续唾液酸乳糖合成,因此,选择50 g/L JM109(DE3)/pET28a-neuA作为最优菌株浓度。
在确定最优诱导温度和最优细胞浓度的基础上,又进一步研究了底物CTP和Neu5Ac浓度对CMP-Neu5Ac合成的影响,结果见图4-c。在CTP和Neu5Ac浓度低于60 mmol/L时,CMP-Neu5Ac的产量逐渐上升,在60 mmol/L达到最高,但是随着底物浓度的增加,CMP-Neu5Ac的产量逐渐下降,故选取CTP和Neu5Ac浓度为60 mmol/L为最优浓度。
工程菌JM109(DE3)/pET28a-neuA是否具有重复使用性是工业应用中考虑的重要因素之一,对选择分批发酵还是流加补料发酵策略具有重要指导意义。因此,按照此前优化的条件,研究了工程菌株重复利用对CMP-Neu5Ac的影响,结果如图4-d所示,以第1次的转化率设定为100%计算,经过5次重复使用后,工程菌株的CMP-Neu5Ac转化率仍为第1次的47%。因此,工程菌株JM109(DE3)/pET28a-neuA既可以用于补料发酵,也可以用于分批发酵。
2.3.2 酵母和工程菌JM109(DE3)/pET28a-neuA耦合发酵合成CMP-Neu5Ac
为降低合成CMP-Neu5Ac的成本,进行了以CMP和Neu5Ac为底物,通过啤酒酵母和JM109(DE3)/pET28a-neuA耦合发酵来合成CMP-Neu5Ac。由图5-a可知,经耦合催化系统催化后,成功在发酵液中检测到CMP-Neu5Ac。

a-TLC图;b-标品CMP液相图;c-标品CMP-Neu5Ac液相图; d-双菌耦合催化产物液相图 a:1-CMP;2-CDP;3-CTP;4-CMP-Neu5Ac;5-双菌耦合催化产物图5 CMP-Neu5Ac的检测Fig.5 Determination of CMP-Neu5Ac
为进一步确定产物,采用HPLC对CMP、CMP-Neu5Ac标品和啤酒酵母与JM109(DE3)/pET28a-neuA耦合催化产物进行了分析,双菌耦合催化产物的出峰时间与标准CMP-Neu5Ac相同(图5-c和图5-d),并且发酵液中CMP-Neu5Ac浓度为11.9 g/L。
2.4 唾液酸乳糖的耦合发酵合成体系建立
为实现“3菌株耦合发酵”策略的唾液酸乳糖合成,采用“单菌合成唾液酸乳糖—双菌耦合发酵合成唾液酸乳糖—3菌耦合发酵合成3′-SL”的递进思路来进行。
利用JM109(DE3)/pET28a-nst全细胞催化合成3′-SL,催化反应结束后,用SPE小柱纯化,TLC分析纯化前和纯化后样品,结果如图6所示。

1-乳糖;2-3′-SL;3-纯化前;4-纯化后图6 TLC检测单菌催化产物Fig.6 Detection of the product producing from engineered bacteria fermentation with TLC
从图6可以看出,发酵液中乳糖并没有被利用完全,纯化后组分(L4)与标准品3′-SL的比移值(retention factor value,Rf)相同。因此,单细胞存在的条件下,以CMP-Neu5Ac和乳糖为底物,可以合成3′-SL。
接着,进行了JM109(DE3)/pET28a-neuA和JM109(DE3)/pET28a-nst双菌耦合发酵合成3′-SL的探索工作。双菌催化结束后,上清液用SPE小柱纯化,进行TLC检测,结果如图7所示。L3有与标准品3′-SLRf相同的寡糖存在,发酵液用SPE柱纯化后的不同组分依次为L4、L5和L6,其中L6的Rf值与标准品3′-SL完全相同,但同时有乳糖的存在,这是因为80%(体积分数)乙腈不仅能洗脱酸性寡糖,还能把中性寡糖洗脱下来,与PACKER等[20]研究结果一致。这表明以CTP、唾液酸和乳糖为底物,通过双菌耦合发酵成功合成了3′-SL。
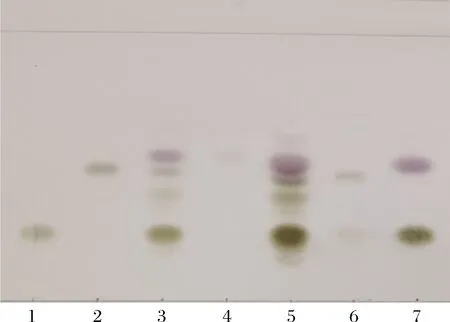
1-乳糖;2-3′-SL;3-纯化前;4-流穿;5-水洗; 6-纯化后;7-对照(CMP-Neu5Ac和乳糖混合)图7 TLC检测双菌耦合催化产物Fig.7 Detection of the product producing from two strains coupling fermentation with TLC
为建立“3菌株耦合发酵”体系,合成3′-SL,在双菌株耦合发酵成功合成3′-SL体系基础上,添加了啤酒酵母,进行3菌混合发酵,而底物则用廉价的CMP替代价格昂贵的CTP。经过30 h的发酵后,用TLC分析检测,结果如图8所示,发酵液(L3)中含有与标准品3′-SL相同Rf值的组份,这表明利用“3菌株耦合发酵体系”成功实现了3′-SL的合成。但是同时发酵液中残留大量的乳糖,3′-SL转化率不高,如何解决3′-SL转化率不高问题成为下一步需要解决的问题。

1-乳糖;2-3′-SL;3-三菌耦合催化产物图8 3菌耦合催化产物的TLC分析图Fig.8 Detection of the product producing from three strains coupling fermentation with TLC
3 讨论
本文通过废啤酒酵母与JM109(DE3)/pET28a-neuA耦合发酵,实现了以CMP和Neu5Ac为底物,高效合成CMP-Neu5Ac的目的,在CTP充足的条件下,JM109(DE3)/pET28a-neuA经过5个批次的分批发酵,其转化率仍可达到第1次使用时的47%,唾液酸乳糖合成中,最为关键的是CMP-Neu5Ac的供给问题,本研究以啤酒酵母和JM109(DE3)/pET28a-neuA耦合,实现了CMP-Neu5Ac的高效再生和供给,尤其是JM109(DE3)/pET28a-neuA可重复使用特性对低成本合成CMP-Neu5Ac具有重要意义。
本研究利用“3菌耦合发酵体系”成功实现了3′-SL的合成。以往合成唾液酸乳糖主要采用酶法和单细胞法。酶法合成由于存在着酶提取纯化工艺,增加了生产成本;而单细胞合成由于存在代谢负担和代谢压力,新的合成途径的引入可能会打破宿主原有的物质能量代谢平衡等问题,产量相对较低。本研究针对自然界的共生互利现象,建立了耦合发酵体系,实现了唾液酸乳糖的合成,为唾液酸乳糖的大规模、廉价合成提供了可能。

