重症监护病房收治重症活动性狼疮性肾炎患者的临床特征及转归
苗译亓 李 喆 许书添 周玉超 周 云 王 杨 李世军 胡伟新
系统性红斑狼疮(SLE)常累及肾脏、中枢神经系统(CNS)、心脏等,与无肾脏受累的SLE患者相比,狼疮性肾炎(LN)患者预后更差[1]。近年来随着新型免疫抑制剂的使用和个体化治疗的推进,LN预后已得到明显改善[2],但其仍是SLE早期死亡的关键因素[3]。SLE活动导致多器官功能损伤,免疫功能紊乱,感染风险增加,常危及生命需收入重症监护病房(ICU)。早期判断重症LN患者各器官损伤及感染情况,及时治疗有助于逆转疾病进展,改善预后。本研究回顾性分析ICU收治的重症LN患者的病因、临床特点及预后,提高对重症LN的认识。
对象和方法
研究对象在2010年1月至2019年12月于东部战区总医院国家肾脏疾病临床医学研究中心ICU住院的患者中筛选出符合以下条件的患者纳入本研究:(1)符合1997年美国风湿病学会(ACR)修订的SLE诊断标准,有肾脏损害的临床表现;(2)存在严重器官功能损伤;(3)病情活动,SLE疾病活动指数2000(SLEDAI-2000)评分≥6。根据是否存在感染,分为感染组和不伴感染组。CKD 5D期并开始透析,入院病因非SLE活动的患者除外。
感染诊断根据临床表现,血液炎症指标,病原学(包括血、尿、痰等标本的病原体培养,结核感染T细胞斑点试验(T-spot),二代基因测序等)及影像学检查明确感染及其部位、病原体。
各器官损伤评估根据各器官损伤临床表现、体格检查,实验室及影像学检查评估各器官损伤,并排除感染、缺血、肿瘤、药物等因素。急性肾损伤(AKI)参照2012年KDIGO指南相关定义[4]。SLE相关CNS损伤参照1999年ACR发布的神经精神性狼疮相关定义[5],出现癫痫、精神异常、认知障碍等表现,结合头颅磁共振、脑电图等异常改变。心脏损伤根据心悸、胸闷气短、胸痛等临床表现,结合血液心肌损伤标志物、心脏超声、心脏磁共振等结果[6]。消化系统损伤根据腹痛、恶心呕吐、腹泻等表现,腹部CT见肠壁增厚、水肿、“靶征”、“梳状征”等[7]。肺损伤根据咳嗽、咯血、呼吸困难等表现[8],结合胸部CT、肺动脉CTA等检查。血液系统损伤包括免疫性血小板减少症、粒细胞缺乏症、溶血性贫血等。多器官损伤定义为SLE活动导致3个及以上脏器损伤,并排除脓毒症导致的多器官损伤。血栓性微血管病(TMA)的诊断根据发热、溶血性贫血、血小板减少、器官功能障碍(AKI、CNS病变、心肌损伤等)等表现,和(或)肾活检见TMA特征性改变[9]。
肾活检病理部分患者住院前或病情稳定后在B超引导下行经皮肾穿刺活检术,肾组织按常规方法行光镜、免疫荧光及电镜检查,病理分型参照2003年国际肾脏病学会/肾脏病理学会(ISN/RPS)的分型标准[10]。
资料收集记录患者的性别、年龄、病程、SLEDAI-2000评分、急性生理与慢性健康评分(APACHE-Ⅱ 评分)、感染及器官损伤情况、治疗及ICU住院时间,并收集血常规、血生化、补体、抗dsDNA抗体、抗磷脂抗体、CD4+T淋巴细胞计数、24h尿蛋白定量等实验室指标及肾活检资料。
治疗及随访根据SLE活动性及器官损伤严重程度,给予甲泼尼龙冲击、连续性肾脏替代治疗(CRRT)、免疫球蛋白冲击(IVIG)、血浆置换或双重滤过血浆置换(PE/DFPP)、抗感染、辅助通气、肠外营养等。随访时间自患者转出ICU至2020-12-31。随访终点为死亡或进入终末期肾病(ESRD)[肾小球滤过率<15 ml/(min·1.73 m2)或规律透析>3个月],记录患者转出ICU后28d及3个月的人肾生存情况。
统计学方法使用《SPSS 21.0》软件进行数据分析,正态分布计量资料以均数±标准差表示,组间比较采用t检验;偏态分布计量资料以中位数(四分位间距)表示,组间比较采用Mann-Whitney U检验;分类资料用数量(构成比)表示,组间比较采用卡方检验或Fisher精确检验。生存率采用Kaplan-Meier法分析,生存率比较使用Z检验,生存曲线之间的比较采取Log-Rank检验。单因素COX回归模型计算各影响因素的风险比(HR),并将单因素P<0.1的变量纳入多因素COX回归模型。所有检验均为双侧检验,P<0.05为差异有统计学意义。
结 果
一般资料2010年1月至2019年12月ICU共收治LN 776例,占同期ICU患者的14.6%,其中450例存在狼疮活动[168例(37.3%)伴感染,356例(79.1%)伴AKI],临床特征和实验室指标见表1。与不伴感染组相比,感染组血小板、血红蛋白、CD4+T淋巴细胞计数显著低下(P<0.05)。
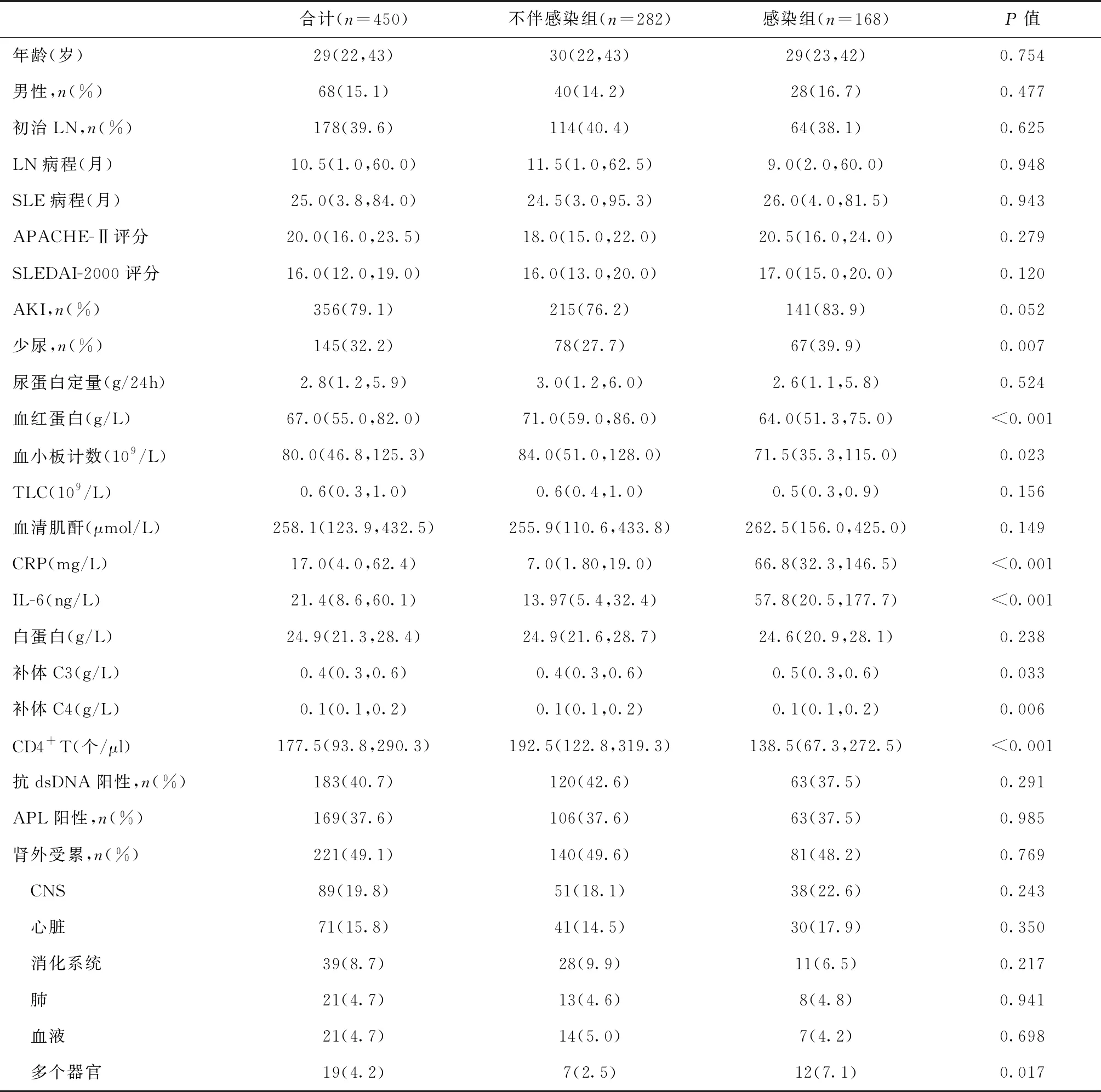
表1 重症活动性LN患者的基线资料及脏器受累特征
器官受累情况229例(50.9%)为LN伴AKI,而无其他器官受累。221例(49.1%)为LN伴肾外器官损伤,其中CNS损伤最常见(89例),其次为心脏损伤71例(狼疮性心肌炎43例、心包积液24例、心内膜炎4例),消化系统损伤39例(狼疮性肠炎31例、急性胰腺炎8例),肺(肺泡出血12例、肺栓塞7例、间质性肺炎2例)和血液系统损伤各21例。19例(4.2%)表现为多器官损伤,主要为肾脏伴CNS和心脏损伤。感染组多器官损伤的比例明显高于不伴感染组(7.1%vs2.5%,P=0.017)。
79例(17.6%)合并TMA,多器官损伤和LN伴心脏损伤者TMA比例高达36.8%和35.1%。仅肾脏受累、LN伴CNS、肺、血液和消化系统损伤者TMA发生率分别为16.6%、12.5%、9.5%、9.5%和3.2%。282例行肾活检,其中Ⅳ型LN 126例(44.7%),Ⅲ型LN 11例(3.9%),Ⅳ+Ⅴ型LN 87例(30.9%),Ⅲ+Ⅴ型LN 21例(7.4%),Ⅴ型LN 18例,Ⅱ型LN 17例,狼疮足细胞病2例(0.7%)。32例有肾脏TMA。
感染部位及病原学168例患者存在感染,最常见的感染部位是肺(89.9%),其次是皮肤软组织、尿路和肠道等。73例(43.5%)感染的病原体确定,以革兰阴性菌(45.2%)和真菌(37.0%)多见,21例患者同时检出2种及以上病原体。
治疗及转归246例(54.7%)接受CRRT,其中多器官损伤者接受CRRT比例最高(89.5%),其次是LN伴心脏损伤者(66.7%)(图1)。感染组接受CRRT比例显著高于不伴感染组(68.5%vs46.5%,P<0.001)。
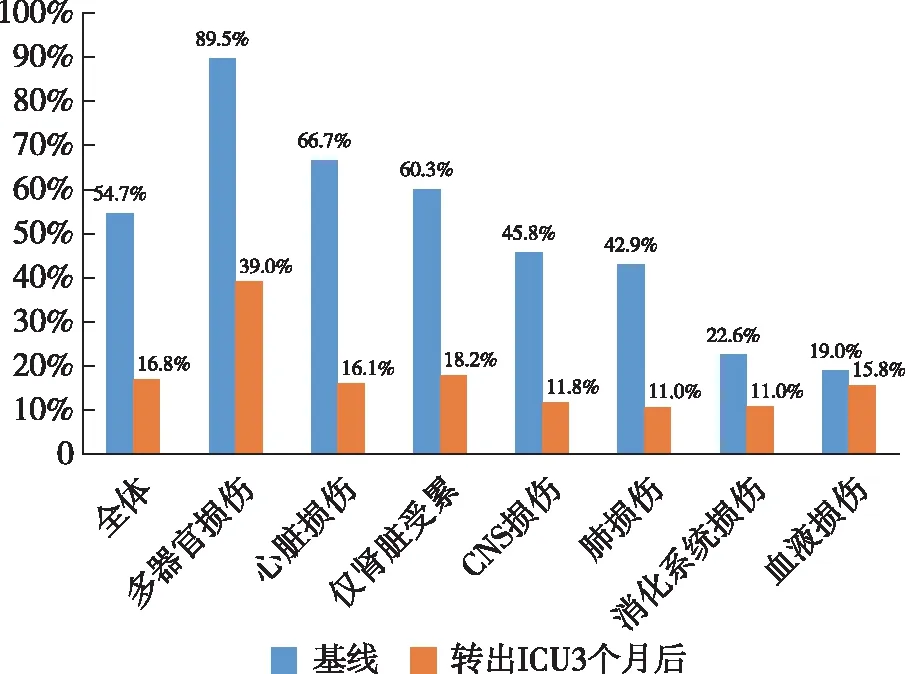
图1 重症活动性LN患者各器官损伤组接受CRRT治疗情况
21例(4.7%)接受2次以上PE/DFPP,多器官损伤和LN伴心脏损伤者接受PE/DFPP的比例较高(分别为10.5%和7.0%)。感染组接受IVIG、辅助通气、肠外营养的比例均明显高于不伴感染组(表2)。
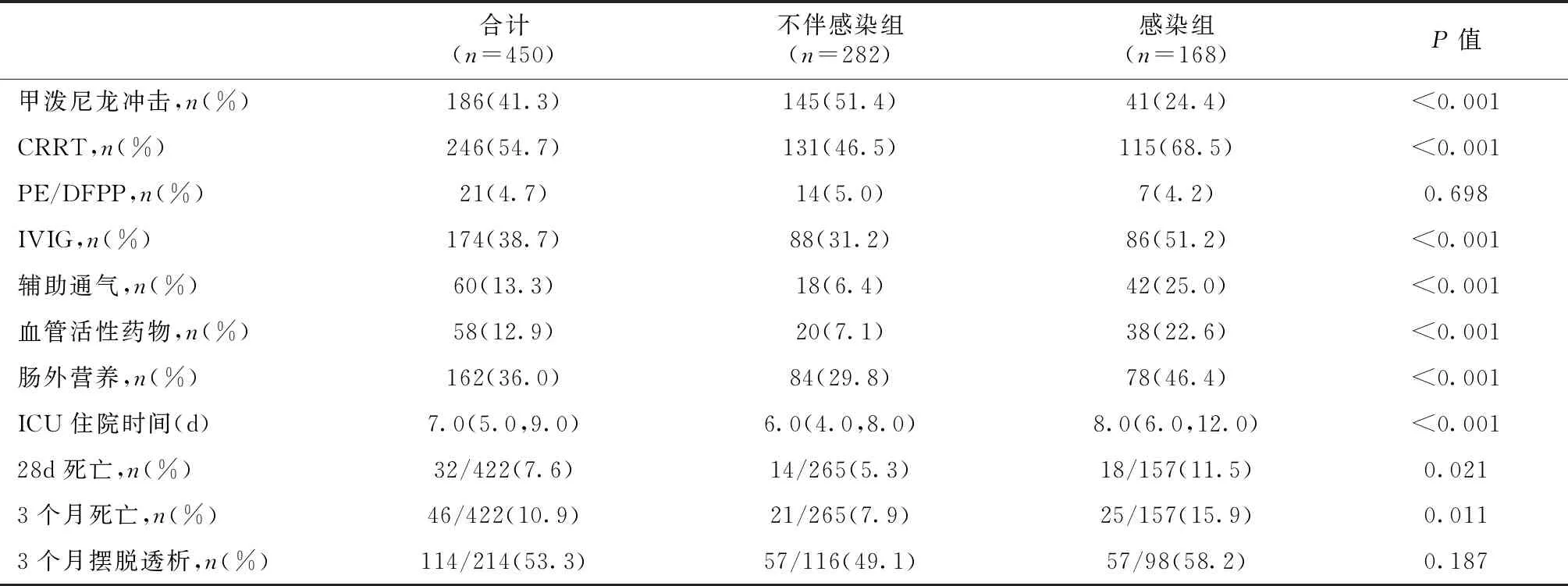
表2 重症活动性LN患者的治疗及转归
本研究累计28例失访,中位随访36.0(11.0,69.3)个月。转出ICU后28d和3个月死亡率分别为7.6%和10.9%。感染组28d(11.5%vs5.3%,P=0.021)和3个月死亡率(15.9%vs7.9%,P=0.011)均显著高于不伴感染组。多器官损伤者3个月死亡率最高达27.8%,LN伴CNS(19.1%)、心脏(10.7%)、肺损伤(10.5%)者死亡率也较高。
3个月肾脏存活率为72.3%,其中多器官损伤者3个月肾脏存活率显著低于其他患者(33.3%vs74.0%,P<0.001)。与无TMA者相比,LN合并TMA患者3个月肾脏生存率明显降低(61.8%vs74.6%,P=0.012),其中接受PE/DFPP治疗者3个月肾脏生存率为75.0%,未接受PE/DFPP者肾脏生存率为59.4%(P=0.734)。3个月内摆脱透析率为53.3%,其中仅肾脏受累(58.3%)和LN伴心脏损伤者(57.6%)摆脱透析率稍高。
随访1年,人和肾脏存活率分别为82.4%和70.5%。感染组人存活率明显低于不伴感染组(77.6%vs85.4%,Log-Rank检验χ2=3.941,P=0.047)(图2),两组肾脏生存率无明显差异(69.2%vs71.2%,P=0.66)。
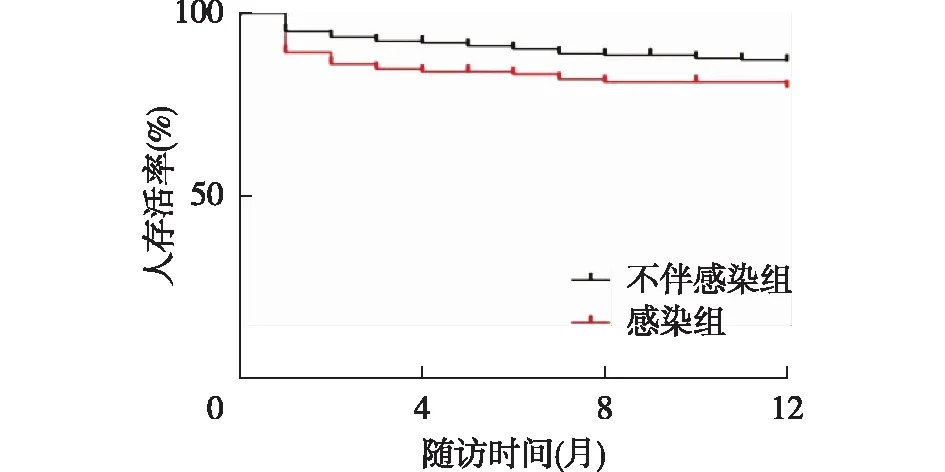
图2 感染组与不伴感染组重症活动性LN患者的生存曲线对比
预后因素分析COX多因素回归分析示感染(HR=0.032,95%CI 1.056~3.406)、CNS(HR=0.012,95%CI 1.207~4.507)和多器官损伤(HR=0.024,95%CI 1.160~7.926)是重症LN患者3个月内死亡的独立危险因素;年龄(HR=0.036,95%CI 1.001~1.032)和血液系统损伤(HR=0.013,95%CI 1.365~14.181)是3个月内无法摆脱透析的独立危险因素。
讨 论
近年来随着诊治水平的提升,LN患者预后明显改善,但重症LN预后仍较差。SLE活动导致肾功能恶化、狼疮性心脏损害、CNS病变、肠道损伤等,器官损伤可同时或先后出现,病情进展迅速,合并感染时临床诊治困难,常危及生命需收住ICU。
哥伦比亚一项研究显示ICU内SLE患者,81.8%合并LN,42.2%伴感染,肺和CNS损伤比例分别为40%和20%,心脏和肠道受累各占11.1%[11]。本研究活动性LN患者肾外受累以CNS(19.8%)和心脏(15.8%)多见。CNS损伤是SLE的常见临床并发症,发生率4.3%~44.5%[12]。SLE活动初期头痛、情绪异常等症状常被忽视,因此各项研究CNS损伤比例差异较大。SLE相关心脏损伤以心包炎最常见,发生率约25%,其次是狼疮性心肌炎、心内膜炎。虽然尸检显示亚临床心脏损害发生率较高,但临床检出率很低[13]。本研究心脏损伤发生率稍高,可能与我科心脏磁共振检查的普及有关[6]。
感染是SLE的常见并发症,也是死亡的首要原因。LN患者由于免疫功能紊乱,低蛋白血症、肾性贫血以及长期使用激素、免疫抑制剂,感染风险大幅升高。病原体通过分子模拟、表位扩展、旁位活化等机制激活机体异常免疫反应[14],进一步加重病情或促进SLE复发。感染部位多为肺和皮肤软组织,可能与SLE活动破坏机体皮肤黏膜固有免疫屏障有关。病原体以革兰阴性菌和真菌多见,对临床抗菌药物的选择具有指导意义。活动性LN伴感染者血液系统及免疫功能受累更严重,临床难以使用大剂量激素和免疫抑制剂,狼疮活动不能得到有效控制,人、肾预后差[15]。
既往研究报道LN患者TMA发生率0.5%~10%[16-17],本研究17.6%的患者合并TMA,其中多器官损伤和LN伴心脏损伤者TMA发生率更高。多器官损伤者多为肾脏、CNS和心脏同时受累,狼疮活动程度高,免疫功能损伤重。Drissa等[18]发现SLE持续活动、ACL阳性的患者更容易出现心脏损伤。ACL通过损伤内皮细胞,诱导微血管血栓形成,进而导致心肌缺血,影响心肌顺应性[19-20],进一步加重心脏损害。目前SLE导致TMA相关机制尚不明确,本研究TMA发生率较高可能与SLE活动、自身抗体生成等有关。
既往研究报道ICU内SLE患者在院死亡率29.6%~57.0%[21],本研究3个月死亡率为10.9%,可能与排除了重症感染而无SLE活动的患者有关。感染、CNS和多器官损伤是重症LN患者3个月内死亡的独立危险因素。CNS损伤与生活质量降低,死亡率升高密切相关[22],SLE患者中10%~15%因脑血管疾病死亡[23]。临床上需早期识别肾外受累,灵活运用CT、磁共振、肠镜等检查评估器官功能损伤并采取有效治疗手段逆转疾病进展,避免多器官损伤[15]。感染和SLE活动互为因果,常形成恶性循环。SLE活动初期和感染急性期均可出现发热,炎症指标显著升高,而补体、自身抗体滴度正常,SLEDAI-2000评分低提示发热与感染有关,需予以抗感染治疗并减少免疫抑制剂剂量,反之则需要加强免疫抑制治疗。
小结:本研究发现活动性LN患者TMA和感染发生率高,器官损伤严重,预后较差。临床除了关注肾脏损伤,更需注意肾外器官损伤和感染的评估。早期控制感染和SLE活动,寻找更加安全有效的治疗方法有助于改善预后。

