中枢神经系统TauT基因敲除大鼠的构建及对线粒体DNA氧化损伤影响
夏一鸣黄晓玲仝慧慧齐浩铭莫丽冬王 辰范维佳黄慧玲∗
(1.天津医科大学,天津 300070;2.天津市环湖医院,天津市神经外科研究所,天津市脑血管与神经变性重点实验室,天津 300350)
基因敲除技术是通过同源重组将靶基因的某些重要外显子或功能结构域、甚至所有外显子敲除掉,导致靶基因的表达失败。而条件性基因敲除技术可以对感兴趣的特异性组织或细胞中的细胞进行时空特异性的敲除,却不造成生物本身的死亡。自从1994年Gu等[1]第一次报道了利用噬菌体P1的Ⅰ型拓扑异构酶Cre重组酶条件性敲除DNA聚合酶β片段后,在新型基因打靶中,Cre-loxP重组系统获得广泛应用,成为条件性打靶技术、诱导性基因打靶、时空特异性基因打靶策略核心。随着CRISPR/Cas9技术的迅速崛起,使用CRISPR/Cas9技术和Cre-loxP技术条件性敲除小鼠或大鼠已成为基因敲除研究的新型方式。
牛磺酸(taurine,Tau)是一种内源性的含硫β-氨基酸,化学结构式为H2N-CH2-CH2-SO3H。Tau虽不参与蛋白质的合成,但是具有非常广泛的营养生理作用[2]。Tau能够改善低蛋白孕鼠甲状腺功能,可以促进大脑的发育[3-4]。在脑组织中,Tau含量水平非常高,高达40 mmol/L[5]。研究表明:长期缺乏Tau将导致脑萎缩、心力衰竭、视网膜病或免疫缺陷[6-7]。文献报道以及我们的前期研究显示:Tau对维持机体正常功能有广泛的生物学作用,对神经组织缺血、缺氧及缺血再灌注损伤具有明显的防治作用[8]。
Tau主要是通过细胞膜上高亲和性的牛磺酸转运体(taurine transporter;TauT;slc6a6)逆浓度梯度主动跨膜转运,以维持脑细胞内的Tau高浓度(胞内浓度约为细胞外的400倍),调节脑细胞渗透压[9]。TauT由621个氨基酸组成,分子质量约为70×103,存在于细胞膜上,包含12个跨膜螺旋结构域。一个分子的Tau的主动摄取需要2~3个钠离子和1个氯离子转运进细胞质[10]。TauT的活性对Tau的转运起着至关重要的作用。
我们的课题一直关注Tau对神经疾病后线粒体功能的影响,我们的研究和文献报道也证实:Tau对线粒体功能稳定具有重要的保护作用[11-12]。线粒体(mitochondrion)被称为细胞的氧化中心和“动力工厂”,为有机体提供约90%的能量。线粒体参与很多疾病的生理、病理过程。一方面,Tau是线粒体tRNA的组成部分,线粒体tRNA中缺乏Tau修饰会引起线粒体疾病[13-14]。另一方面,它可抑制多种刺激下介导的细胞凋亡[15-16],Tau的缺乏会引起线粒体呼吸链复合酶Ⅰ、Ⅲ活性降低,ATP生成减少、超氧化物生成增加和自噬的缺陷[17-18]。
传统Tau缺乏模型的构建基本采用加入胍基乙烷磺酸盐等TauT抑制剂,或者通过喂养不含Tau食物的饲料来抑制Tau的摄入[19-20]。在本课题中,我们首次利用Cre-loxP技术和CRISPR/Cas9技术构建神经特异性敲除TauT基因大鼠模型(TauTloxP/loxP/Cre+),使得TauT基因能够在大鼠脑组织中稳定敲除,克服了传统Tau缺乏模型的不稳定、持续时间短等缺点。这为研究Tau对神经系统中的作用提供了新的长久模型,并可以在此平台下研究TauT在各种神经疾病治疗和诊断中的作用及分子机制。
1 材料和方法
1.1 实验动物
神经特异性表达Nestin-Cre雄性大鼠,SPF级,1只,体重200 g(购自中国医学科学院医学实验动物研究所[SCXK(京)2019-0011]);TauTloxP/WT大鼠雌雄各1只,体重200 g,委托中国医学科学院医学实验动物研究所基因工程创制平台构建;实验所用的条件性敲除大鼠(TauTloxP/loxP/Cre+大鼠)为Nestin-Cre大鼠和TauTloxP/WT大鼠杂交后获得。实验中所用TauTloxP/loxP/Cre+大鼠、野生型SD大鼠(WT大鼠,北京华阜康生物科技股份有限公司购买[SCXK(京)2019-0008])均为SPF级健康雄性大鼠,2月龄大鼠每组各24只,体重(250±30)g。12月龄大鼠每组各2只,体重(850±30)g。
TauTloxP/WT和Nestin-Cre大鼠以及WT大鼠均在中国医学科学院放射医学研究所实验动物中心SPF环境中饲养[SYXK(津)2019-0002],温度25℃左右、空气湿度保持在50%、明暗循环12 h/d。实验研究的全部动物均遵守3R原则且通过中国医学科学院放射医学研究所实验动物伦理委员审查(DWLL-20180916和DWLL-20180917)。
1.2 主要试剂与仪器
体外转录试剂盒(美国Invitrogen公司,Am1345);EasyPure Genomic DNA Kit(北京全式金生物技术有限公司,EE101-12);2×Taq PCR StarMix、总RNA提取试剂盒、FastKing gDNA Dispelling RT SuperMix、SuperReal PreMix Plus(SYBR Green)(天根生化科技(北京)有限公司,KT201、DP419、KR118、FP205);高效RIPA裂解液(北京索莱宝科技有限公司,R0010);PageRulerTMPlus Prestained Protein Ladder(美国Thermo公司,26619);Millipore Western blot ECL(德国Merck公司,WBKLS0500);TauT一抗(英国St John’s Laboratory,STJ95923);GAPDH一抗(美国Proteintech公司,60004-1-lg);HRP标记的山羊抗小鼠二抗、抗兔二抗(北京中杉金桥生物技术有限公司,ZB-2305、ZB-2301);Bradford蛋白浓度测定试剂盒(上海碧云天生物技术有限公司,P0006);动物细胞/组织活性线粒体分离试剂盒、线粒体呼吸链复合物I(NADH-辅酶Q还原酶,Complex I)、线粒体呼吸链复合物II(琥珀酸-辅酶Q还原酶,Complex II)、线粒体呼吸链复合物III(辅酶Q-细胞色素C还原酶,Complex III)、线粒体呼吸链复合物IV(正铁细胞色素C-氧化还原酶,Complex IV)、线粒体呼吸链复合物V(F0F1-ATP酶/ATP合成酶,Complex V)的活性比色法定量检测试剂盒(上海杰美基因医药科技有限公司,GMS10006.2、GMS50007、GMS50008、GMS50009、GMS50010、GMS50083);高电流电泳仪PowerPacTMHC(美国Bio-RAD公司,1645052);多功能成像系统(法国Vilber公司,HC006);PCR仪(杭州博日科技股份有限公司,TC-96/G/H(b));荧光定量PCR仪(瑞士Roche公司,LC480);显微镜(日本OLYMPUS公司,BX53);全自动免疫组化仪(德国Leica公司,BOND-Ⅲ);紫外/可见分光光度仪(英国JENWAY公司,6850)。
1.3 实验方法
1.3.1 TauTloxP/loxP/Cre+大鼠的构建
TauTloxP/loxP/Cre+大鼠模型构建首先需要利用CRISPR/Cas9技术构建TauTloxP/WT杂合子大鼠。一方面针对TauT基因第5外显子390 bp序列两端设计两个不同的sgRNA序列(Rat-TauT-gRNA-up:5’-TAGGCCCCTTTGTCCCACAGAC-3’,Rat-TauT-gRNAdown:5’-AAACGTCTGTGGGACAAAGGGG-3’;RTauT-gRNA-up:5’-TAGGGACAGACCCTGTCTCTGG-3’,R-TauT-gRNA-down:5’-AAACCCAGAGACAGG GTCTGTC-3’),合成的sgRNA单链通过退火复性结合成小片段,连接到BsaI酶处理的线性化的表达质粒(pUC57-sgRNA)中,经质粒的连接、转化后再通过Dra I内切酶线性化后转录出sgRNA。另一方面构建Cas9表达载体(pST1374-NLS-flag-linker-Cas9),再用Age I内切酶线性化转录出Cas9 mRNA。通过将体外转录的sgRNA和Cas9 mRNA以及TauT基因第5外显子两端各含有一个loxP序列的供体通过显微注射法注射进SD大鼠受精卵,利用同源重组获得F0代TauTloxP/WT杂合子大鼠(图1所示)。
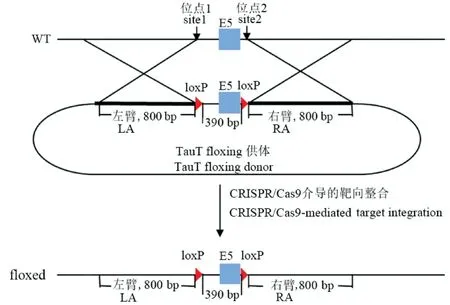
图1 利用CRISPR/Cas9技术构建TauTloxP/W T大鼠示意图Figure 1 TauTloxP/WT rat schematic diagram constructed by CRISPR/Cas9 technology
将获得的TauTloxP/WT大鼠杂交繁殖得到TauTloxP/loxP纯合子大鼠,并和Nestin-Cre大鼠进行杂交,获得TauTloxP/WT/Cre+转基因大鼠,再由TauTloxP/WT/Cre+大鼠和TauTloxP/loxP大鼠杂交得到神经特异性TauTloxP/loxP/Cre+基因敲除大鼠。
1.3.2 TauTloxP/loxP/Cre+大鼠PCR鉴定
将出生21 d左右的大鼠,剪趾编号并提取基因组总DNA,PCR扩增目的条带,电泳成像分析。根据两个loxP外端基因序列设计引物。loxP上游引物:5’-ATTCAGTCACTCATCCGTCCCT-3’,下游引物:5’-TCTGACAGTTAAAGAATCTAAGGCTCA-3’,片段大小为712 bp。Cre鉴定上游引物:5’-TACTGACGGTGGGAGAATG-3’,下 游 引 物:5’-CTGTTTCACTATCCAGGTTACG-3’,片段大小为432 bp。将鉴定的TauTloxP/loxP/Cre+大鼠,提取脑组织DNA进一步PCR鉴定,TauTloxP/loxP/Cre+大鼠在脑组织中loxP引物扩增条带为290 bp。
1.3.3 实时荧光定量PCR检测TauTloxP/loxP/Cre+、WT大鼠脑及各器官TauT基因表达量
2月龄TauTloxP/loxP/Cre+大鼠、WT雄性大鼠脑及各脏器组织研磨后取100 mg左右,提取总RNA,接着反转录成cDNA后,进行实时荧光定量PCR(qPCR)。TauT目的基因引物序列:上游5’-GAGGTCATCATAGGCCAGTAC-3’;下 游5’-GTACACATTCAGGAGGGACAC-3’,片段大小为120 bp。GAPDH内参引物序列:上游5’-AACTCCCA TTCTTCCACC-3’;下 游5’-ACCACCCTGTTGCT GTAG-3’,片段大小为100 bp。20 μL PCR反应体系:2×SuperReal PreMix Plus 10 μL,ddH2O 7.8 μL,引物各0.6 μL,cDNA模板1 μL。qPCR反应条件:95℃15 min预变性,95℃15 s,60℃1 min,40个循环。
qPCR相对定量分析:2-△△Ct法,其中[△△Ct=(待测目的基因平均Ct值-待测内参基因平均Ct值)-(对照组目的基因平均Ct值-对照组内参基因平均Ct值)]。
1.3.4 Western blot检测TauTloxP/loxP/Cre+、WT大鼠脑及各器官TauT蛋白表达
2月龄TauTloxP/loxP/Cre+大鼠、WT雄性大鼠脑组织及心、肝、肾,匀浆裂解后,11430 r/min心10 min,取上清,Bradford法测定蛋白浓度。上样总蛋白浓度为40 μg,SDS-PAGE电泳,70 V,40 min后转120 V至溴酚蓝条带到底部,300 mA转膜90 min,5%脱脂奶粉封闭2 h,TauT一抗(1∶1000)、GAPDH一抗(1:10000),4℃孵育过夜,TBST洗膜3次,TauT用山羊抗兔二抗(1∶10000)和GAPDH使用的山羊抗小鼠二抗(1∶10000)常温孵育2 h,TBST洗膜3次,显影、成像。
1.3.5 免疫组化及HE染色
选取2月龄、12月龄TauTloxP/loxP/Cre+大鼠和WT大鼠各2只,用PBS心脏灌注至血液流尽后,换4%多聚甲醛继续灌注至大鼠身体僵硬,取脑,4%多聚甲醛固定24 h,脱水,石蜡包埋,切片脱蜡至水后,分别做HE染色和免疫组化。HE染色:苏木精染色,水洗,伊红染色,水洗,脱水封片,镜下观察。免疫组化:取2月龄大鼠的切片脱蜡至水后,封闭、TauT一抗(1∶100)、冲洗、TauT二抗孵育、冲洗、DAB染色、苏木精复染、脱水透明、封片,镜下观察并分析。1.3.6 TauTloxP/loxP/Cre+、WT大鼠脑组织mtDNA拷贝数检测
2月龄TauTloxP/loxP/Cre+大鼠、WT雄性大鼠脑组织研磨后取100 mg左右,提取总DNA,使用40 ng DNA作为起始量,进行实时荧光定量PCR。目的基因COXⅠ上游基因引物:5’-TAATTCGAGCTGAA CTAGGAC-3’,下 游 引 物:5’-TACAAGTCAGTTC CCGAAGC-3’;片段大小143 bp。内参基因Rpl4上游基因:5’-CACGCAAGAAGATTCATCGC-3’,下游引物5’-AACAATCTTCTCCGATTTGGC-3’;片段大小194 bp。20 μL PCR反应体系:2×SuperReal PreMix Plus 10 μL,ddH2O 7.8 μL,引物各0.6 μL,模板1 μL。qPCR反应条件:95℃15 min预变性,95℃15 s,60℃1 min,40个循环。计算方法同1.3.3。
1.3.7 TauTloxP/loxP/Cre+、WT大鼠脑组织线粒体呼吸链复合酶活性测定
线粒体呼吸链复合酶活力的测定,均根据试剂盒说明书操作执行。简单来说,将2组大鼠脑组织剪碎匀浆后,1430 r/min,10 min取上清,再9525 r/min,10 min取沉淀,反复冻融破碎线粒体后,Bradford法测蛋白浓度,然后使用紫外/可见分光光度仪进行线粒体呼吸链酶活性测定。Complex I、Ⅱ、Ⅲ、Ⅳ、Ⅴ分别在340 nm、600 nm、550 nm、550 nm、340 nm波长下测吸光度。酶活力计算公式:【(样品读数-背景读数)×体系容量(mL)×样品稀释倍数】÷【样品容量(mL)×毫摩尔吸光系数×反应时间(min)】=单位/毫升÷(样品蛋白浓度)毫克/毫升=单位/毫克。Complex I/Ⅱ/Ⅲ/Ⅳ/Ⅴ结果单位分别为:μmol NADH/(min·mg);μmol DCPIP/(min·mg);μmol CoQH2/(min·mg);μmol CytC/(min·mg);μmol NADH/(min·mg)。
1.4 统计学方法
应用SPSS 17.0和GraphPad Prism 8软件进行数据分析。实验结果数据均以平均数±标准差(¯x±s)表示,组间比较采用独立t检验,P<0.05时表示组间具有显著差异,P<0.01表示差异极显著。
2 结果
2.1 大鼠构建及遗传分析
基因测序和序列比对结果显示loxP序列被成功插入在第5外显子两端(图2A、2B)。我们对插入的loxP序列进行遗传分析。TauTloxP/WT×WT出生的F1代中只有阴性和杂合子;TauTloxP/WT×TauTloxP/WT出生的F2代TauTloxP/loxP大鼠比例为22.2%;TauTloxP/WT×TauTloxP/loxP出生的F3代中TauTloxP/loxP大鼠比例为52.4%。综上,loxP插入TauT基因第5外显子两端后能够稳定的遗传,且符合孟德尔遗传定律,结果如表1所示。
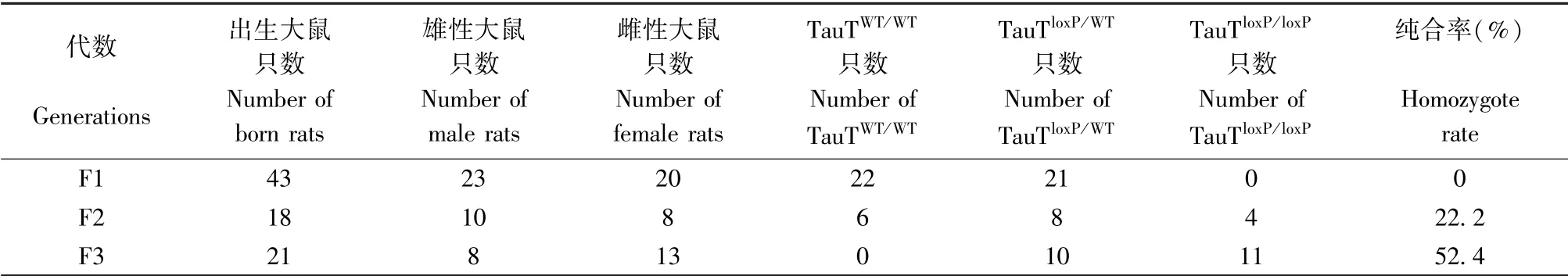
表1 F1~F3代大鼠繁殖情况Table 1 Reproduction of F1~F3 generation rats
2.2 基因型鉴定结果
新生大鼠脚趾DNA的PCR鉴定结果如图3:TauTloxP/loxP纯合子为一条带,712 bp;TauTloxP/WT杂合子为两条带,712 bp和632 bp;TauTWT/WT阴性为一条带,632 bp(图3A);Cre为一条带,437 bp(图3B);TauTloxP/loxP/Cre+大鼠脑组织TauT基因被敲除后条带大小为290 bp(图3C)。

注:A:基因测序结果显示第5外显子两端插入loxP序列(红色框);B:与基因组序列比对结果显示第5外显子两端loxP序列被插入。图2 loxP基因序列比对结果Note.A,Gene sequencing results showed that loxP sequences were inserted at both ends of the fifth exon(red box).B,Comparison with the genome sequence showed that loxP sequences were inserted at both ends of the fifth exon.Figure 2 loxP gene sequence alignment results

注:M:DNA标记;A:1、2:TauTloxP/WT;3、4:TauTWT/WT;5:TauTloxP/loxP;B:1、2、3、4:Cre阳性;C:1:大脑TauT基因敲除结果;2:小脑TauT基因敲除结果。图3 条件性基因敲除大鼠部分PCR鉴定结果Note.M,DNA marker.A,1/2,TauTloxP/WT.3/4,TauTWT/WT.5,TauTloxP/loxP.B,1,2,3 and 4,Cre positive.C,1,Result of brain TauT gene knockout.2,Result of cerebellar TauT gene knockout.Figure 3 Partial PCR identification results of conditional gene knockout rats
此外,通过RT-PCR显示:TauTloxP/loxP/Cre+大鼠大脑和肾组织TauT mRNA表达量相比较WT组显著降低;而在心、肝组织中TauT mRNA表达量没有显著差异(如图4)。
2.3 Western blot及免疫组化检测TauTloxP/loxP/Cre+、WT大鼠脑组织及各器官TauT蛋白的表达
免疫印迹实验结果显示:TauTloxP/loxP/Cre+大鼠TauT蛋白在脑组织中表达显著降低,而在心、肝、肾组织中和WT大鼠蛋白表达量并无明显差异(如图5A、5B)。
此外,通过免疫组化观察TauTloxP/loxP/Cre+大鼠大脑皮层和海马(CA3区)和小脑中TauT蛋白表达与WT组大鼠相比明显减少,而在心、肝、肾组织两者无明显差异。这与免疫印迹结果一致(如图6)。
2.4 TauTloxP/loxP/Cre+、WT大鼠脑组织HE染色结果
从HE染色结果显示:2月龄TauTloxP/loxP/Cre+大鼠与WT大鼠相比,大脑皮质和海马DG区细胞数量和密度有所减少(图7A/7B、7A1/7B1)。而12月龄的TauTloxP/loxP/Cre+大鼠与WT大鼠相比,大脑皮质和海马DG区细胞极性消失,结构排列疏松紊乱,细胞核胞浆分界模糊(图7C/7D、7C1/7D1)。此外,12月龄大鼠脑皮质和海马DG区与2月龄大鼠相比,细胞结构疏松,细胞排列不规则,这种现象在12月龄的TauTloxP/loxP/Cre+大鼠中更加明显(如图7)。

注:TauTloxP/loxP/Cre+大鼠和WT大鼠TauT mRNA表达相对定量分析比较。与WT组比较,∗∗P<0.01。图4 TauTloxP/loxP/Cre+和WT大鼠脑组织及各器官TauT mRNA表达情况(n=6)Note.TauT mRNA expression in TauTloxP/loxP/Cre+rats and WT rats was compared quantitatively.Compared with WT group,∗∗P<0.01.Figure 4 TauT mRNA expression in brain tissues and organs of TauTloxP/loxP/Cre+rats and WT rats
2.5 TauTloxP/loxP/Cre+、WT大鼠脑组织线粒体呼吸链复合物酶活性和mtDNA相对表达量检测
结果显示:和WT大鼠相比,TauTloxP/loxP/Cre+大鼠线粒体呼吸链复合酶Ⅰ、Ⅲ、Ⅳ、Ⅴ均显著低于WT组酶活性,而只有线粒体复合酶Ⅱ没有受到影响(如图8A;表2)。此外,TauTloxP/loxP/Cre+大鼠脑组织mtDNA表达量比WT大鼠显著升高(如图8B)。
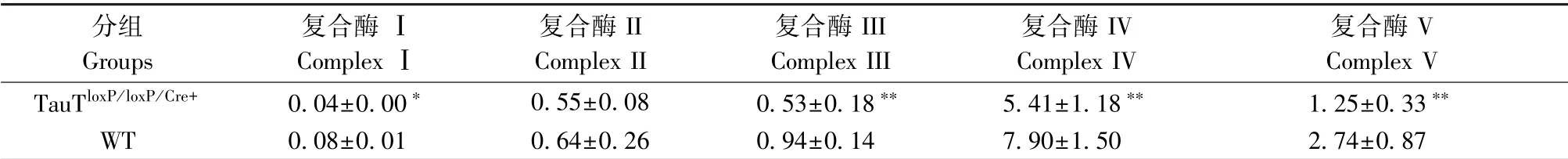
表2 TauTloxP/loxP/Cre+大鼠和WT大鼠脑组织线粒体呼吸链复合酶活性测定(¯x±s,n=6)Table 2 Activity of mitochondrial respiratory chain complex enzymes in brain tissues of TauTloxP/loxP/Cre+rats and WT rats
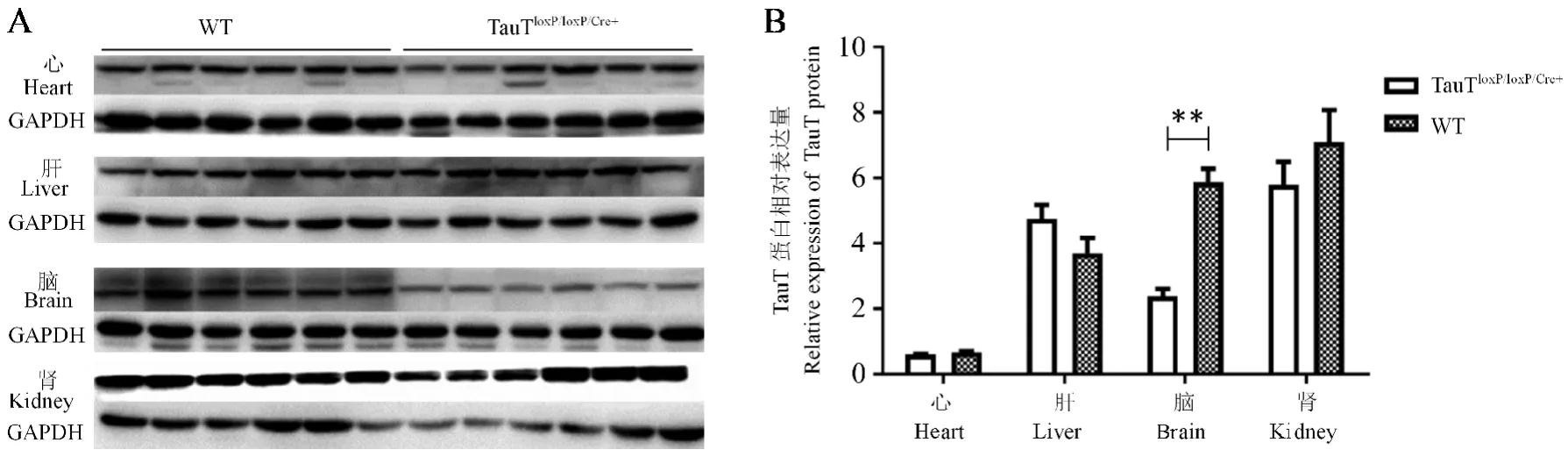
注:A:TauTloxp/loxp/Cre+大鼠和WT大鼠心、肝、脑、肾TauT蛋白表达情况;B:TauTloxp/loxp/Cre+大鼠和WT大鼠组蛋白表达相对定量分析比较。与WT组比较,∗∗P<0.01。图5 TauTloxp/loxp/Cre+大鼠和WT大鼠大鼠脑组织及其它器官TauT蛋白表达情况(n=6)Note.A,Expression of TauT protein in heart,liver,brain and kidney of TauTloxp/loxp/Cre+rats and WT rats.B,Relative quantitative analysis of TauT protein expression in the TauTloxp/loxp/Cre+and WT groups.Compared with WT group,∗∗P<0.01.Figure 5 TauT protein expression in brain tissues and other organs of TauTloxp/loxp/Cre+rats and WT rats

注:A、A1:2月龄WT大鼠皮质、海马;B、B1:2月龄TauTloxp/loxp/Cre+大鼠皮质、海马;C、C1:12月龄WT大鼠皮质、海马;D、D1:12月龄TauTloxp/loxp/Cre+大鼠皮质、海马。图7 不同月龄TauTloxP/loxP/Cre+大鼠和WT大鼠脑皮质、海马HE染色Note.A/A1,Cortex and hippocampus of 2-month-old WT rats.B/B1,Cortex and hippocampus of 2-month-old TauTloxP/loxP/Cre+rats.C/C1,Cortex and hippocampus of 12-month-old WT rats.D/D1,Cortex and hippocampus of 12-month-old TauTloxP/loxP/Cre+rats.Figure 7 HE staining of cerebral cortex and hippocampus in TauTloxP/loxP/C re+rats and WT rats of different months of age
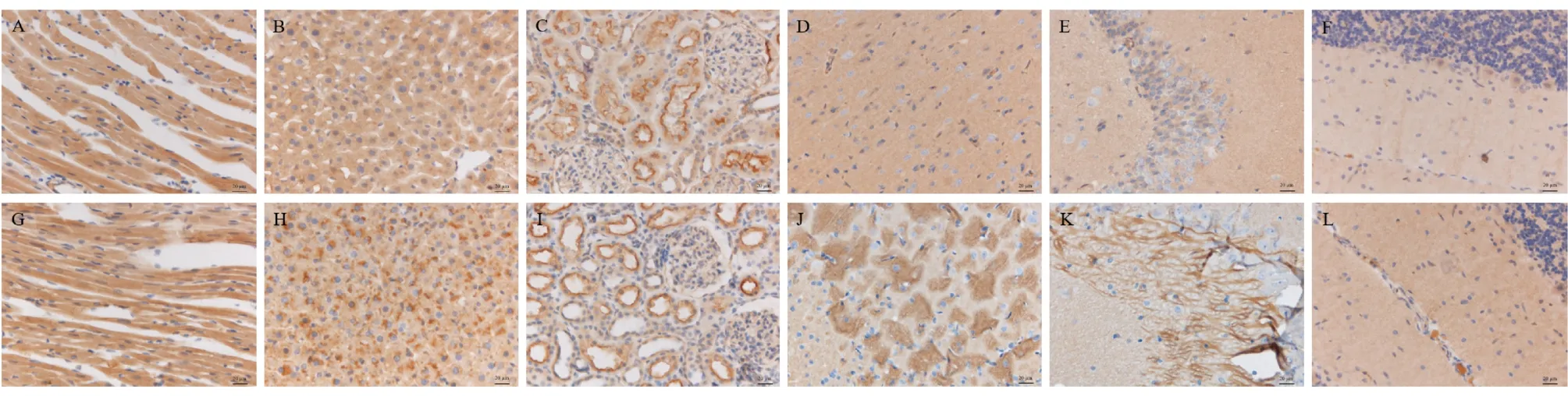
注:A、B、C、D、E、F:TauTloxp/loxp/Cre+大鼠心、肝、肾、皮质、海马(CA3)、小脑;G、H、I、J、K、L:WT大鼠心、肝、肾、皮质、海马(CA3)、小脑。图6 TauTloxp/loxp/Cre+大鼠和WT大鼠在心、肝、肾、皮层、海马和小脑免疫组化结果比较Note.A/B/C/D/E/F,TauTloxp/loxp/Cre+rat heart,liver,kidney,cortex,hippocampus(CA3),cerebellum.G/H/I/J/K/L,WT rat heart,liver,kidney,cortex,hippocampus,cerebellum.Figure 6 Comparison of immunohistochemical results in the heart,liver,kidney,cortex,hippocampus and cerebellum of TauTloxp/loxp/Cre+and WT rats
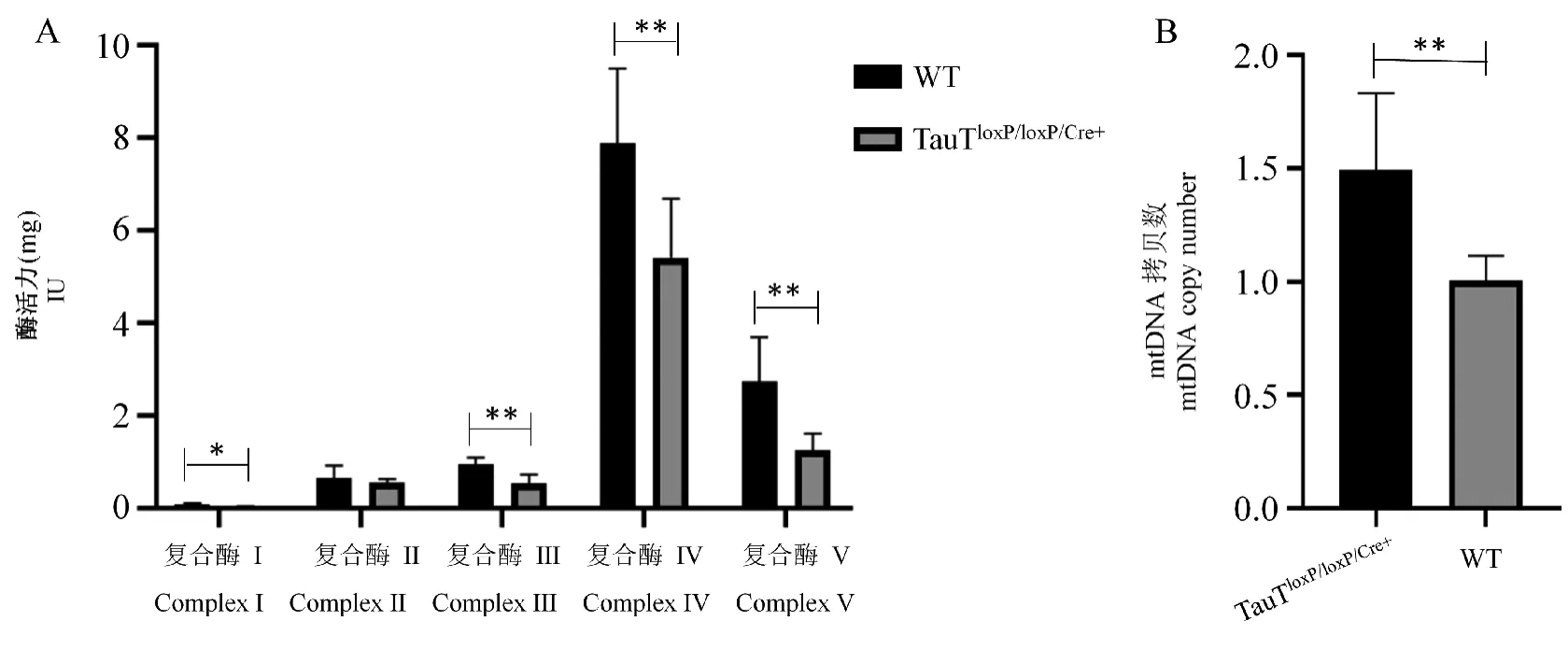
注:A:TauTloxP/loxP/Cre+大鼠和WT大鼠脑组织线粒体呼吸链复合物酶活性;B:TauTloxP/loxP/Cre+大鼠和WT大鼠脑组织mtDNA相对表达量。与WT组比较,∗P<0.05,∗∗P<0.01。图8 TauTloxP/loxP/Cre+大鼠和WT大鼠脑组织线粒体呼吸链复合物酶活性和mtDNA相对表达量(n=6)Note.A,Activity of mitochondrial respiratory chain complex in brain tissue of TauTloxP/loxP/Cre+rats and WT rats.B,Relative expression levels of mtDNA in brain tissues of TauTloxP/loxP/Cre+rats and WT rats.Compared with WT group,∗P<0.05,∗∗P<0.01.Figure 8 Activity of mitochondrial respiratory chain complex enzyme in TauTloxP/loxP/Cre+rat and WT rat brain tissues
3 讨论
传统的条件性敲除技术需要使用胚胎干细胞的同源重组、胚胎操作、显微注射和辅助生殖技术[21],操作繁琐,实验周期长[22]。目前,对于TauT敲除模型的研究,一般通过敲除TauT第1外显子或者第2~5外显子形成TauT全身性敲除小鼠,TauT的全身性敲除会引起心肌功能的损伤和视网膜变形以及运动能力的减弱[23-24]。众所周知,大鼠提供的人类疾病模型,尤其是神经疾病的行为学和药理学上,大鼠比小鼠提供更有效的生理学指标[25-26]。本文我们用SD大鼠,选择TauT第5外显子,运用CRISPR/Cas9技术在基因组中产生精确的双链断裂,提高了基因打靶的效率,同时利用同源重组机制,整合转染的同源DNA模板[27-28]。结合Cre-loxP技术,构建TauT在中枢神经系统中特异性敲除大鼠模型。查阅文献,这是在国际上Tau领域中第一次利用大鼠的TauT基因的条件性敲除报道,进一步证明CRISPR/Cas9技术介导目的基因的条件性敲除是一种十分可靠的方法[22]。
本实验成功构建了TauTloxP/loxP/Cre+大鼠模型,从大鼠繁殖情况来看,插入的loxP序列可以稳定遗传,且符合孟德尔遗传定律。通过RT-PCR结果显示:与WT大鼠比较,TauTloxP/loxP/Cre+大鼠在脑组织中TauT mRNA表达水平显著降低,表明TauT基因的确被明显敲除。免疫印迹显示:与WT相比,TauTloxP/loxP/Cre+大鼠TauT表达在脑中显著降低,而在心、肝和肾中TauT表达并无显著差异,这与大脑组织的免疫组化结果一致。对提取TauTloxP/loxP/Cre+大鼠的小脑做免疫组化结果也表明了TauT蛋白的敲除。但是在本实验中发现大脑组织仍有少量的TauT的基因和蛋白表达,这可能与Nestin-Cre大鼠有关。为了实现中枢神经系统TauT基因的特异性敲除,Cre重组酶的表达受大鼠Nestin启动子和内含子2增强子控制。Nestin是神经干细胞特征性标志物,在胚胎发育早期的神经上皮中表达,对神经元分化具有重要作用。由于Nestin神经特异性启动只在神经干细胞中表达,而我们的样本是取自大鼠半脑,这其中包含着大量的细胞类型,可能包含着TauT表达的细胞,从而导致产生了少量的TauT表达。
有趣的是,在对心、肝和肾组织的TauT mRNA表达水平研究发现:TauTloxP/loxP/Cre+大鼠的心和肝组织TauT mRNA表达水平没有受到影响,肾组织中TauT mRNA表达水平却显著降低,但不影响其TauT蛋白表达。这种结果表明:Nestin-Cre介导的重组不仅发生在神经外胚层,也发生在肾细胞类型中。这也证实了Dubois研究Nestin-Cre大鼠在肾中表达的结果[29]。本实验中我们多次实验证实大鼠肾的TauT mRNA基因下降而蛋白质表达不变,表明对于肾,中枢神经TauT敲除只是影响其转录水平,还未出现翻译水平的变化即蛋白功能的变化。这可能是由于mRNA表达量的下调不足以引起蛋白表达量的变化。一般而言,真核生物中基因表达的转录和翻译两个水平所发生时间和位点存在时空间隔,后者因磷酸化等一系列转录后修饰,对蛋白功能的调控比较复杂。由于不同的半衰期,mRNA和蛋白质水平有时不能直接相关,有时会有相反的结果。
从基因敲除大鼠表型上观察,我们很难判断TauTloxP/loxP/Cre+大鼠和WT大鼠之间的区别。观察其生长1~6月龄体重变化过程中,TauTloxP/loxP/Cre+大鼠并没有显示出明显的不同,出生也没有出现致死现象,其脑、心、肝、肾、肺、脾等脏体系数的比较也无明显区别(数据未列出)。这与我们同期所构建的TauT全身性敲除大鼠会体重减轻有所不同[30]。对TauTloxP/loxP/Cre+大鼠的核磁共振检测,也未发现实验大鼠脑部无明显病变,核磁波谱也显示ROI区的Tau水平无明显差异(数据未列出)。但HE染色显示:TauTloxP/loxP/Cre+大鼠脑皮质、海马DG区细胞数量和致密度有所减低,这可能是由于TauT的敲除会导致Tau供给不足,使脑组织细胞体积调节能力降低,从而影响了脑组织细胞形态、数量的变化。此外,TauT敲除在脑中可能出现时间累积效应。与年老的WT大鼠相比,年老大鼠TauTloxP/loxP/Cre+大鼠脑皮质和海马DG区细胞出现极性消失,结构排列疏松、紊乱以及细胞核胞浆分界模糊等现象,这些结果表明TauT敲除会加速大鼠的衰老。
利用我们所构建的TauTloxP/loxP/Cre+大鼠模型,我们初步研究了脑组织线粒体的mtDNA和线粒体呼吸链复合酶I、Ⅱ、Ⅲ、Ⅳ、Ⅴ活性。发现中枢神经系统的TauT的条件性敲除会抑制脑组织线粒体呼吸链复合酶I、Ⅲ、Ⅳ、Ⅴ活性,而复合酶Ⅱ的活性没有收受到影响。我们分析,这可能与Tau的抗氧化特性和阻止线粒体渗透性的转变有关[11],TauT敲除抑制了Tau的摄取,从而导致线粒体抵抗细胞内的氧化应激和渗透性转变能力降低,线粒体呼吸链复合酶活性降低,ATP合成的减少。而大鼠脑组织mtDNA的拷贝数可能是对其线粒体ATP减少所做的代偿性的增加[31]。后期我们进一步实验进行论证。
综上所述,我们用CRISPR/Cas9和Cre-loxp技术成功构建了中枢神经系统TauT敲除大鼠模型,发现TauT的敲除对脑组织的形态、线粒体呼吸链复合酶活性及mtDNA拷贝数都有着较显著影响,为研究Tau及TauT在中枢神经系统中的作用提供一种有效的实验平台,为进一步研究Tau治疗神经疾病的机理提供了一种稳定而有力的工具。

