2种高糖诱导海马神经元模型应用及优势比较
许永劼许 雯陈 钢林海容黄昶煜东朱丽英潘 卫∗
(1.贵州医科大学附属医院产前诊断中心,贵阳 550025;2.贵州医科大学医学检验学院,贵阳 550025;3.贵州医科大学公共卫生学院,贵阳 550025)
糖尿病是急需攻克的世界性重大疾病,发病人数多,并发症多[1]。糖尿病脑病是糖尿病的重大并发症之一,缺乏有效的预防和治疗方法,这与其发病机制不明有密切关系[2-3]。糖尿病脑病的发病机制复杂,目前研究均未能阐释其发病机制[4-6]。
由于糖尿病脑病患者临床标本获取困难,多数研究采用动物或细胞模型。研究发现海马区是糖尿病脑病的主要病变区[7],海马神经元功能直接影响机体认知功能[8]。现阶段糖尿病脑病细胞模型基于海马神经元进行高糖诱导处理,以求模拟神经元生物学变化过程[8]。已有研究通过构建高糖诱导原代海马神经元细胞模型、高糖诱导PC12大鼠嗜铬瘤细胞系、高糖诱导HT-22小鼠海马神经元等[9-11],研究糖尿病脑病的发病机制,但目前未出现公认的较为稳定和经典的糖尿病脑病细胞模型,这与海马神经元培养困难、细胞不增值、转染效率低下有关。因此,选择适合的细胞模型是研究糖尿病脑病的重要基础。
本课题组一直致力于糖尿病脑病海马神经元机制研究,构建以原代SD大鼠海马神经元和HT-22小鼠海马神经元的高糖诱导细胞模型,本文旨在通过系统评估2种细胞模型的优缺点,为后期不同细胞模型的选择及应用提供数据参考,为糖尿病脑病发病机制的研究提供有效手段。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
100只出生24 h内SPF级SD大鼠乳鼠,体重9~11 g,由贵州医科大学动物中心提供[SCXK(黔)2018-0001],实验动物由贵州医科大学动物中心代养[SYXK(黔)2016-003],喂养期间自由饮水进食,室内温度(24±1)℃。所有动物实验均经本校动物实验伦理委员会审核并批准(IACUC-1900620),严格遵循3R原则。
1.1.2 细胞
HT-22细胞系购于中乔新舟公司。
1.2 主要试剂与仪器
CCK-8试剂盒(日本同仁);DMEM培养基、Neurobasal-A培养基、B-27神经元营养因子(美国Gibco公司);脂质体Lipo2000和LipoRNAiMax转染试剂(美国赛默飞);双染凋亡试剂盒(中国凯基);Bax和Bcl-2抗体(武汉三鹰);胎牛血清(以色列BI);流式细胞仪(Navios,美国贝克曼);倒置荧光显微镜(Ti2-U,日本尼康);Western blot设备(美国伯乐);细胞培养箱(40 PLATE BIOSOURCE,日本SANYO);酶标仪(IMARK,美国Bio-Rad公司)。
1.3 实验方法
1.3.1 细胞培养
按照课题组原代海马神经元培养方式[12],取乳鼠海马组织,经过消化分离纯化后,以每毫升1×105个浓度种植到培养瓶中。HT-22细胞按照课题组培养方式进行复苏、传代,按每毫升1×105个浓度种植到培养瓶中。原代神经元每2 d需半定量换液一次,HT-22细胞生长至90%需进行细胞传代处理。
1.3.2 细胞分组
原代海马神经元培养到第5天,进行细胞分组,分为原代对照组(25 mmol/L)和原代高糖组(45 mmol/L),高糖作用时间48 h。选择对数生长期HT-22细胞,进行消化、传代后,分为HT-22对照组(25 mmol/L)和HT-22高糖组(55 mmol/L),高糖作用时间48 h。
1.3.3 NSE免疫组织化学染色鉴定神经元纯度
按课题组之前的方法[12],取培养至第5天的原代神经元进行NES染色,全部操作严格按照说明书进行。显微镜下观察和计数海马神经元纯度,棕色细胞为海马神经元。
1.3.4 CCK-8检测2种细胞模型活力
原代对照组、原代高糖组神经元和HT-22对照组、HT-22高糖组按每毫升1×105个浓度种植于96孔板中,高糖作用时间12 h、24 h、48 h后,按照CCK-8试剂盒操作说明,每孔加入5 μL CCK-8试剂,每组需5个复孔,避光放置37℃细胞培养箱孵育2 h后,上酶标仪450 nm波长检测各组细胞活性。
1.3.5 不同转染试剂对神经元模型影响
脂质体Lipo2000和LipoRNAiMax分别作用于原代对照组、原代高糖组神经元和HT-22对照组、HT-22高糖组,每组按每毫升1×105个浓度种植于96孔板和6孔板中,同时设置不加脂质体的原代空白对照组和HT-22空白对照组,5 μL脂质体和5 μL阴性荧光siRNA(浓度20 μm)按1∶1比例融入100 μL OptiMEM培养基中,后加入培养板中,作用5 h后。细胞换液,按1.3.4 CCK-8法检测细胞活力。作用12 h后,使用倒置荧光显微镜观察不同转染试剂在海马神经元转染效率。
1.3.6 流式细胞术检测细胞凋亡
原代对照组、原代高糖组神经元和HT-22对照组、HT-22高糖组到达作用时间后,使用0.25%无EDTA胰酶消化后,收集细胞,按照双染凋亡试剂盒说明书进行,PBS洗涤3次后收集细胞,加入500 μL Buffer后,分别每孔加入5 μL PI和FITC后,室温避光混匀,1 h内上流式细胞仪检测。
1.3.7 Western blot检测凋亡蛋白表达情况
收集各组细胞后,按照课题组之前的方法提取细胞总蛋白,采用BCA法定量蛋白浓度。按每孔35 μg上样量,经10%聚丙烯酰胺凝胶电泳分离后,将目的蛋白转印到PVDF膜上,脱脂牛奶封闭2 h后,加入兔单抗Bax(1∶2000)、Bcl-2(1∶2000)、βactin(1∶5000),4℃摇床孵育过夜,第2天TBST漂洗3次后,孵育羊抗兔二抗(1∶10000)2 h后,ECL法显色,上曝光仪收集图像,Image J软件分析目的蛋白灰度值。
1.4 统计学方法
收集整理数据后,采用SPSS 21.0软件进行统计学分析,计量数据均采用平均数±标准差(¯x±s)表示,2组间比较采用独立样本t检验分析各组数据差异,当P<0.05时,差异显著,具有统计学意义。
2 结果
2.1 原代海马神经元培养及鉴定
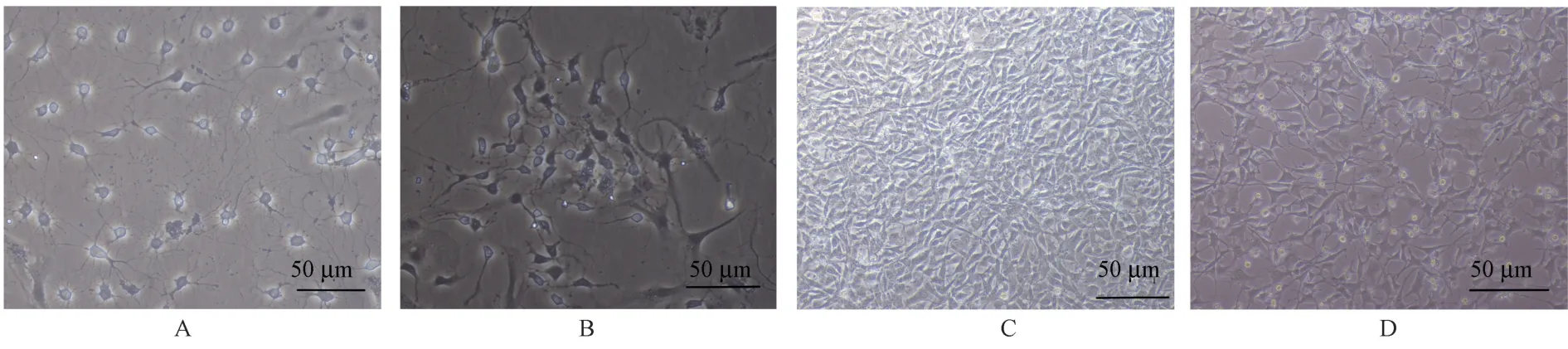
从24 h乳鼠海马中提取原代海马神经元后,种植于培养基中。细胞生长第1天,细胞基本贴壁,细胞周围出现光晕(见图1A);细胞培养至第3天,细胞进一步变大呈锥形,突触生长迅速,形成稀疏的网状结构(见图1B);到第7天后,细胞胞体光晕显著,细胞间网络密集(见图1C);细胞经NSE免疫组织化学染色后,阳性细胞为棕黑色(见图1D),细胞分布均匀,细胞间突触由网络连接,经显微镜下计数,本实验海马神经元纯度达85%,符合后续试验要求。
2.2 2种高糖诱导神经元细胞形态变化
在高糖诱导原代海马神经元中,对照组神经元生长状态良好,细胞胞体发亮,突触数量多;高糖组细胞状态较差,细胞胞体变暗、数量减少、突触减少(见图2)。在高糖诱导HT-22小鼠海马神经元中,对照组神经元数量多,状态良好;高糖组细胞数量减少,细胞状态变差(见图2)。2种细胞模型中,高糖作用48 h后,神经元数量均减少,细胞状态显著下降,提示高糖可损伤神经元。
2.3 2种高糖诱导神经元细胞活力变化情况
由CCK-8法检测不同细胞组的细胞活力,与原代对照组对比,原代高糖组细胞活力随着作用时间延长,细胞活力逐渐下降,到48 h作用时间后,细胞活性降到最低(见图3)。HT-22对照组细胞活力较高,与HT-22对照组对比,HT-22高糖组细胞活力在12 h和24 h逐渐下降,但在高糖作用48 h后,细胞活力有上升趋势(见图3)。原代高糖组细胞活性持续下降,而HT-22高糖组细胞活力在下降后呈现一个恢复状态。
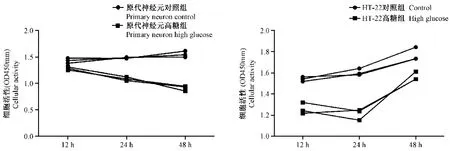
图3 2种高糖诱导神经元细胞活性变化Figure 3 Two kinds of high glucose induced changes in cell viability of neuron model
2.4 不同脂质体对神经元活力影响
我们运用2种不同脂质体作用2种神经元模型中。由CCK-8检测结果可知,2种脂质体均能导致原代神经元对照组和高糖组神经元大量死亡,导致细胞活力大幅下降(P<0.05)(见图4);2种脂质体作用HT-22对照组和高糖组神经元后,两组细胞均部分死亡,2组细胞活力有一定程度下降,其中LipoRNAiMax对神经元伤害小于Lipo2000,(P<0.05)(见图4)。综合以上结果,我们认为原代神经元受脂质体影响较大,不适合后续分子生物学实验研究,而脂质体LipoRNAiMax对HT-22神经元细胞毒性小,因此我们后期选择LipoRNAiMax作用HT-22神经元,进行后续实验。
2.5 不同脂质体对神经元转染效率
上面的结果提示,脂质体LipoRNAiMax对神经元的损伤小,因此我们选择该脂质体进行细胞转染。原代海马神经元加入脂质体和阴性荧光siRNA后,荧光显微镜下观察细胞发现,对照组和高糖组基本无显著荧光(见图5),提示细胞转染效率低下;HT-22海马神经元加入脂质体和阴性荧光siRNA后,荧光显微镜激发后,对照组和高糖组观察到大量绿色荧光(见图5),提示HT-22神经元转染效率较高,可用于后续实验。
2.6 2种高糖诱导神经元细胞凋亡率
采用流式细胞术检测2种细胞模型凋亡情况,原代海马神经元高糖组与对照组相比,细胞凋亡显著增加(P<0.05)(见图6);HT-22高糖组较对照组相比,细胞凋亡稍有增加,差异无统计学意义(P<0.05)(见图6)。
2.7 2种高糖诱导神经元细胞凋亡蛋白表达情况
凋亡相关蛋白Bcl-2和Bax的表达直接关系细胞凋亡水平。Western blot结果显示,与原代神经元对照组相比,原代高糖组海马神经元中Bcl-2表达下降、Bax表达上升,差异有统计学意义(P<0.05)(见图7);与HT-22对照组相比,海马神经元中Bcl-2表达下降,差异有统计学意义(P<0.05),Bax表达无显著差异(见图7)。
3 讨论
由于无法获得临床患者样本,现阶段糖尿病脑病发病机制研究多基于细胞模型和动物模型,已有大量实验基于高糖诱导神经元模型探究糖尿病脑病可能的作用机制。本课题组前期构建2种高糖诱导海马神经元细胞模型为糖尿病脑病研究提供参考方法。同时有报道利用大鼠肾上腺嗜铬细胞瘤PC12细胞作为类神经元细胞研究糖尿病脑病,文献报道PC12细胞在结构与功能上与神经元类似,相比神经元培养更为简单,因此被运用于神经疾病研究[13]。本课题组结合文献报道,将实验细胞选为海马神经元,海马区作为认知功能的主要功能结构,其神经元的功能直接影响机体认知[14-15],PC12细胞虽然能一定程度模拟神经元,但依据不能代表海马神经元的生理过程,因此我们将海马神经元作为细胞模型的首选。

注:A:神经元培养第1天;B:神经元培养第3天;C:神经元培养第5天;D:海马神经元纯度鉴定。图1 原代神经元培养及鉴定Note.A,Culture day 1.B,Culture day 3.C,Culture day 5.D,Hippocampal neuronal cells were identified following immunocytochemical staining with anti neuron specific enolase.Figure 1 Culture and identification of primary hippocampal neurons
注:A:原代神经元对照组(正常培养至第7天);B:原代神经元高糖组(培养至第5天后,加高糖培养基继续培养48 h至第7天);C:HT-22对照组(正常糖浓度培养48 h);D:HT-22高糖组(高糖浓度培养48 h)。图2 2种高糖诱导海马神经元细胞形态变化Note.A,Primary neuron control group(Normal culture to day 7).B,Primary neuron high glucose group(After culturing to the 5th day,add high-glucose medium to continue culturing for 48 h to the 7th day).C,HT-22 control group(Normal glucose concentration cultured for 48 h).D,HT-22 high glucose group(High glucose concentration culture for 48 h).Figure 2 Two kinds of high glucose induce neuronal cell morphology
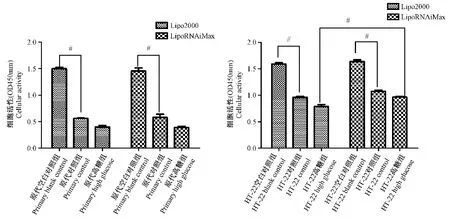
注:2组间比较,#P<0.05。图4 2种脂质体对神经元活性影响Note.Comparison between the 2 groups,#P<0.05.Figure 4 Effect of two kinds of liposomes on neuronal activity

注:A:原代神经元对照组(正常糖浓度培养第7天);B:原代神经元高糖组(培养至第5天后,加高糖培养基继续培养48 h至第7天);C:HT-22对照组(正常糖浓度培养48 h);D:HT-22高糖组(高糖浓度作用48 h)。图5 2种高糖诱导神经元转染效率Note.A,Primary neuron control group(Normal culture to day 7).B,Primary neuron high glucose group(After culturing to the 5th day,add highglucose medium to continue culturing for 48 h to the 7th day).C,HT-22 control group(Normal glucose concentration cultured for 48 h).D,HT-22 high glucose group(High glucose concentration culture for 48 h).Figure 5 Two kinds of high glucose induce neuronal transfection efficiency
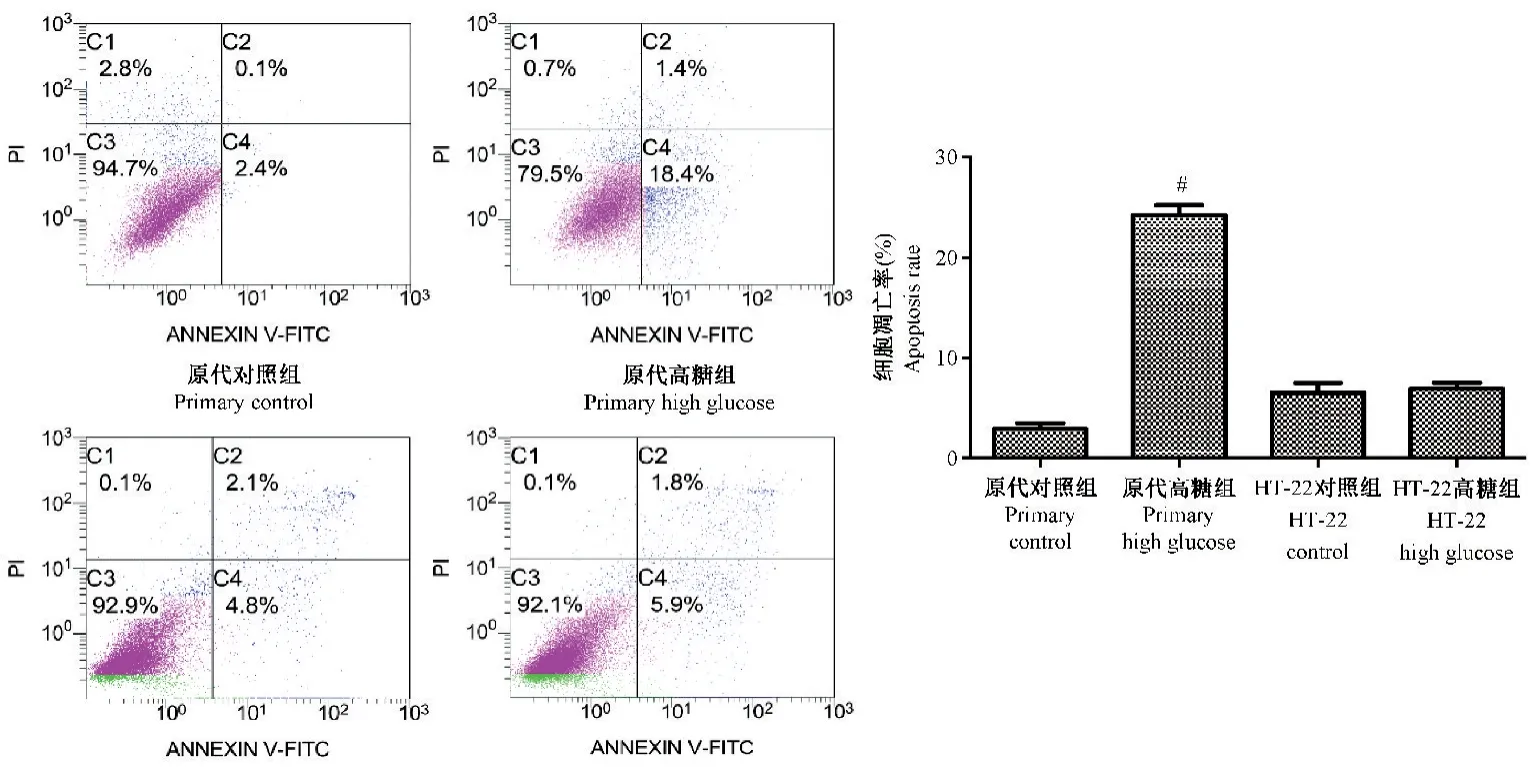
注:与原代对照组比较,#P<0.05。图6 2种高糖诱导神经元凋亡情况Note.Compared with the primary control group,#P<0.05.Figure 6 Two kinds of high glucose induce neuronal cell apoptosis rate
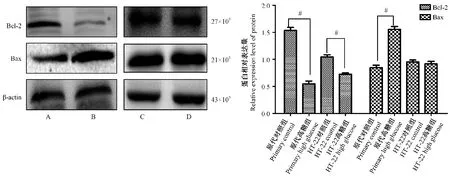
注:A:原代神经元对照组;B:原代神经元高糖组;C:HT-22对照组;D:HT-22高糖组。2组间比较,#P<0.05。图7 2种高糖诱导神经元凋亡蛋白表达情况Note.A,Primary neuron control group.B,Primary neuron high glucose group.C,HT-22 control group.D,HT-22 high glucose group.Comparison between the 2 groups,#P<0.05.Figure 7 Two kinds of high glucose induce neuronal apoptosis protein expression
大量体外试验证明,海马神经元基础培养糖浓度为25 mmol/L,该浓度下神经元生长旺盛、突触密集[16-17]。本文也将2种细胞对照组糖浓度设置为25 mmol/L,所培养原代海马神经元纯度高和HT-22海马神经元均长势良好、形成密集的网络结构。为了模拟糖尿病脑病的高糖环境,我们分别按照2种细胞的高糖模型条件给予高糖刺激,随着高糖作用时间的延长,原代神经元细胞活性持续下降,而HT-22海马神经元活性在24 h达到最低,随后活性上升。我们推测原代海马神经元由于其无法增殖,在高糖环境的持续刺激下,神经元受损严重;而HT-22由于其可增殖特性,在高糖环境短暂刺激后,细胞产生一定抗性,加之细胞增值过程中可消耗葡萄糖,糖浓度下降导致细胞活性升高。我们的结果与谭潮航等[18]研究结果类似,他选择40 mmol/L糖浓度作用HT-22细胞,但并未发现细胞活力随时间延长升高。因此我们建议若选择HT-22细胞作为研究对象,可适当考虑提高糖浓度或缩短作用时间。由于原代海马神经元提取和培养较昂贵、复杂,若课题组经费有限或实验条件不足,可考虑选择HT-22细胞,但原代海马神经元源于乳鼠海马组织,更能真实反映神经元的生长发育过程,值得我们考虑。
分子生物学手段是研究基因功能的主要途径,在疾病发病机制中研究运用广泛[19],常用分子生物学技术如RNAi技术、基因过表达载体等已广泛运用在细胞模型中。无论是基因干扰还是基因过表达均离不开细胞转染,大量研究证明神经元存在转染效率低、细胞易受损等问题,这极大限制了后续研究[20]。常用的转染方式有磷酸钙法、脂质体法、电穿孔法、病毒感染等[21],由于价格和仪器受限,脂质体转染是目前应用最广泛的转染手段。因此本文选择常用的脂质体LipoRNAiMax和Lipo2000作用神经元,本文结果显示原代海马神经元受脂质体毒性影响大,很难应用后期研究,这与李莎等[22]研究不符合,可能脂质体用量过大有关;选择LipoRNAiMax作用HT-22神经元,可见荧光siRNA可进入神经元中,且细胞活性受损较轻,可用于后续实验。研究报道利用慢病毒和电穿孔法转染原代神经元可作为高效的技术手段[23],但受困其高昂和仪器,很难大规模使用,脂质体转染仍是首选。因此我们建议若在高糖诱导神经元模型中使用转染技术,选择HT-22细胞有助于后续实验进行。
目前有关糖尿病脑病发病机制解释很多,其中神经元凋亡增加被认为是认知功能障碍发生的主要因素之一。血糖浓度异常升高可引起神经细胞凋亡增加,学习记忆能力下降,导致认知功能障碍[24]。Bc1-2与Bax是经典的凋亡相关蛋白,其数量平衡是维持细胞凋亡的重要环节[25],研究发现在正常大鼠海马中Bc1-2扮演着抑制神经元凋亡的作用[26-27]。本研究在高糖诱导原代海马神经元中发现,细胞受高糖刺激后,凋亡率显著升高,且凋亡相关蛋白Bcl-2显著下降、Bax显著升高,这与闫斌等[28]的实验结果一致;在高糖诱导的HT-22神经元中,细胞凋亡并不显著,但凋亡蛋白Bcl-2下降,我们推测由于HT-22细胞可进行增殖,导致细胞凋亡率无显著变化。综上我们建议若选择HT-22细胞,应适当提高糖浓度,以便更好模拟高糖损伤神经元过程。
综上所述,本文所介绍的2种高糖诱导神经元细胞模型具备不同的优势和应用价值,均可应用于糖尿病脑病发病机制的研究。针对不同的实验目的,我们建议因地制宜的选择细胞模型,有助于课题的实施和完成,同时可根据实验情况,可适当改变细胞模型中糖浓度或作用时间,以便更好研究疾病发生过程。

