rpl15在斑马鱼胚胎中的表达形式探究
周唯君彭 涛周栋珍杨懿琛周艳华李 化何志旭舒莉萍∗
(1.贵州医科大学细胞工程生物医药技术国家地方联合工程实验室,贵州省再生医学重点实验室,基础医学院免疫学教研室,贵阳 550004;2.中国医学科学院成体干细胞转化研究重点实验室,贵阳 550004;3.遵义医科大学附属医院 儿科学教研室,贵州 遵义 563003;4.贵州大学,贵阳 550025)
核糖体蛋白(ribosomal proteins,RPs)广泛存在于细胞中,参与RNA结合的过程,并在蛋白质的生物合成中发挥重要作用,同时还在细胞的增殖与凋亡、耐药、发育、免疫等多个方面发挥作用[1-2]。RPs的功能障碍与如血液系统疾病、代谢性疾病与癌症等的多种疾病密切相关[3]。核糖体蛋白L15(ribosomal protein L15,RPL15)是核糖体L15E蛋白家族的成员,RPL15主要定位于真核细胞的核仁内并且呈现点状分布,位于60 S的核糖体大亚基上,对核仁的形成及核仁结构的维持有着重要的作用[4]。
随着对RPL15的深入研究,RPL15表达水平的异常与多种疾病的发生或发展有着密切关联,在胃癌、食管癌、胰腺癌及结肠癌中均发现RPL15的异常表达[5-8]。在先天性红系再生障碍性贫血(Diamond-Blackfan anemia,DBA)中也发现了一个由RPL15基因突变引起的DBA新亚型,由此确定了RPL15为一个新的DBA致病基因之一[9]。DBA是一种罕见的常染色体骨髓衰竭综合征,也被认为是一种核糖体病,患病者具有核糖体蛋白基因突变。DBA的主要表现为:红细胞再生障碍性贫血、皮肤和骨骼异常以及癌症易发,在临床上,DBA一直缺乏有效的治疗,主要是通过长期输注红细胞和使用激素冲击疗法来缓解病程的进展,唯一的治疗方式为造血干细胞移植[10]。核糖体蛋白的表达受到影响将会进而影响细胞的存活[11]。然而对于核糖体蛋白在这些疾病中发挥作用的作用机制及分子机制不甚清楚。
斑马鱼作为与人类造血调控高度保守的模式生物,其拥有造血系统发育过程与人类相似、胚胎发育迅速、饲养成本相对低廉且易于观察等优势。本研究旨在斑马鱼中找到人rpl15基因的同源物,分析其部分遗传学特征,通过探究rpl15基因在胚胎中的表达形式,以期了解rpl15基因在造血发育过程中可能的作用。
1 材料和方法
1.1 实验动物
实验中采用0~3日龄的Tüebingen品系野生型斑马鱼的胚胎与幼鱼,其中用于繁殖幼鱼的成鱼体重约为350~400 mg,雌雄各10尾,严格遵循使用实验动物的3R原则,所用斑马鱼均为本实验室自行繁育、培养[SYXK(黔)2018-0001]。所有研究方案均通过贵州医科大学实验动物伦理委员会的审批(No.1603041)。
1.2 主要试剂与仪器
pCS2+载体由本实验室保存;E.coliDH5α菌株、质粒小提试剂盒、琼脂糖凝胶DNA回收试剂盒均购自天根生化科技(北京)有限公司;高保真KODPLUS PCR酶购自日本Toyobo公司;反转录试剂First Stand cDNA Synthesis Kit、限制性内切酶EcoRⅠ、NotⅠ、T4DNA连接酶、NE-PERTM细胞核和细胞质提取试剂盒、BCA蛋白质定量试剂盒购自美国Thermo Fisher公司;DIG RNA Labeling Mix、蛋白酶K购自瑞士Roche公司;TRIzol试剂、NucAwayTMSpin Columns购自美国Ambion公司;T3聚合酶购自美国Promega公司;BCIP/NBT购自日本VectorLab公司;Rabbit Anti-RPL15抗体和Goat Anti-Rabbit IgG H & L(HRP)均购自英国Abcam公司;PVDF膜和ECL化学发光液均购自美国Millipore公司;PCR仪购于德国Eppendorf公司;分子杂交箱购于美国UVP公司。
1.3 实验方法
1.3.1 斑马鱼养殖方法
斑马鱼野生型Tüebingen品系养殖标准参照The Zebrafish book[12],养殖在本课题组28.5℃的14 h光照/10 h黑暗的循环水系统中[13]。按照雌雄1∶2或者1∶1的比例将性成熟(16~24周龄)的斑马鱼进行配对,并在中间用透明胶板隔开,在第2天光照刺激5~10 min后拔去胶板,约在1.5 h后收集斑马鱼胚胎,加入胚胎培养液eggwater(0.06 mg/mL海盐、0.5 mg/L亚甲基蓝)并置于28.5℃的培养箱中孵化,每天更换eggwater两次并吸出死胚。
1.3.2 基于数据库和软件的斑马鱼rpl15基因生物信息学分析
在美国国家生物信息技术中心(NCBI)数据库中分别查找出rpl15基因在人类、斑马鱼、小鼠染色体的位置,记录汇总,并与Ensemble数据库中的基因信息进行比对,进行共线性分析并绘图。分别记录人类、斑马鱼、小鼠和果蝇等物种的rpl15基因的蛋白序列,用DNAMAN进行多序列比对出蛋白质相似性,再利用MEGA X构建系统发生树,采用Neighbor-joining算法并运行500次bootstarp对系统发生树进行评估。
1.3.3 斑马鱼总RNA的提取及cDNA的合成
收集0.75~72 hpf(hourspost-fertilization,受精后小时)之间多个时相的斑马鱼胚胎置于离心管中(30枚/管),蛋白酶K脱卵膜,每管再加入1 mL TRIzol充分匀浆处理,经氯仿抽提两次,然后异丙醇沉淀、75%乙醇洗涤晾干后,加入适量DEPC水溶解。反转录按照First Stand cDNA Synthesis Kit试剂盒的说明书在PCR仪上操作,得到的cDNA置于-20℃冻存。
1.3.4 制备地高辛标记的rpl15基因的反义mRNA探针
根据GenBank中的rpl15基因序列(NM_001003447.1)设计引物(表1),引物由上海捷瑞生物工程有限公司合成。将用EcoRⅠ和NotⅠ双酶切后的pCS2+载体和用同样两种酶切处理的rpl15基因片段用T4DNA连接酶进行重组连接,测序鉴定重组质粒的序列并比对无误后,将重组质粒pCS2+-rpl15经EcoRⅠ单酶切线性化,T3体外转录后经核酸纯化柱纯化,最后将得到的探针分装并置于-80℃备用。
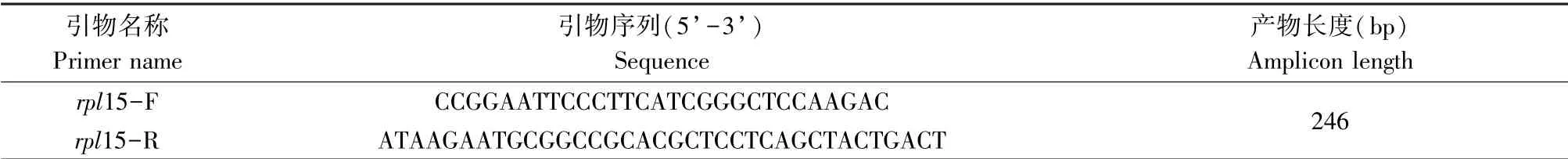
表1 斑马鱼rpl15基因PCR引物序列Table 1 Primers used for PCR of zebrafish rpl15 gene
1.3.5 斑马鱼全时相胚胎原位杂交
收集0.75~72 hpf之间的11个时相点的胚胎,每组35枚,脱膜用4% PFA固定,甲醇梯度脱水后置于-20℃冻存备用。固定好的胚胎洗去多余甲醇,时相大于24 hpf的胚胎用蛋白酶K进行通透处理,先置于68℃杂交炉中预杂交1 h,再加入地高辛标记的rpl15反义mRNA探针杂交过夜。第2天依次用不同浓度的SSC缓冲液洗去多余的探针,加入稀释5000倍的anti-DIG-AP于4℃反应过夜。第3天用MABT洗掉多余抗体,再加入新鲜配制的BCIP/NBT避光显色,在体式显微镜下观察到出现蓝紫色杂交信号即终止染色,并用4% PFA固定后,将胚胎放在均匀涂抹甲基纤维素的玻璃皿上,在体视显微镜下拍照。
1.3.6 Western blot法检测斑马鱼Rpl15蛋白表达水平
收集24、48、72 hpf胚胎,每组50枚,使用NEPERTM细胞核和细胞质提取试剂分别提取斑马鱼胚胎细胞质和细胞核的蛋白质,经BCA蛋白定量后上样。变性的蛋白在SDS-PAGE凝胶中进行电泳分离,然后湿转至甲醇激活的PVDF膜上。再以5%的脱脂奶粉封闭1 h;1×TBST洗3次后,加入稀释1000倍的Rabbit Anti-RPL15抗体于4℃孵育过夜;1×TBST洗3次后,加入稀释2000倍的Goat Anti-Rabbit IgG H & L(HRP)室温孵育2 h;1×TBST洗3次后,根据ECL检测试剂盒的说明书配制曝光液,使用化学发光分析仪检测,扫描图像后,用ImageJ 8.0软件分析目的蛋白与GAPDH的灰度值。
1.4 统计学方法
所有实验均重复三次或三次以上,并用GraphPadPrism 8.0软件中的单因素方差进行统计学分析。
2 结果
2.1 不同物种间rpl15基因的生物信息学分析结果
对斑马鱼和人类的rpl15基因进行了同线性分析(synteny analysis),结果显示,rpl15基因位于斑马鱼19号染色体上,其上、下游6个基因在内的基因组序列,在小鼠14号染色体及人类3号染色体短臂上能找到与其相对应的同源区(图1)。利用DNAMAN软件对比分析斑马鱼、人类和小鼠rpl15蛋白质的相似性,结果显示,斑马鱼rpl15氨基酸序列与人氨基酸序列相似度为95%,与小鼠的相似度为74%。使用MEGA X绘制14个物种rpl15的系统发育树(图2)。
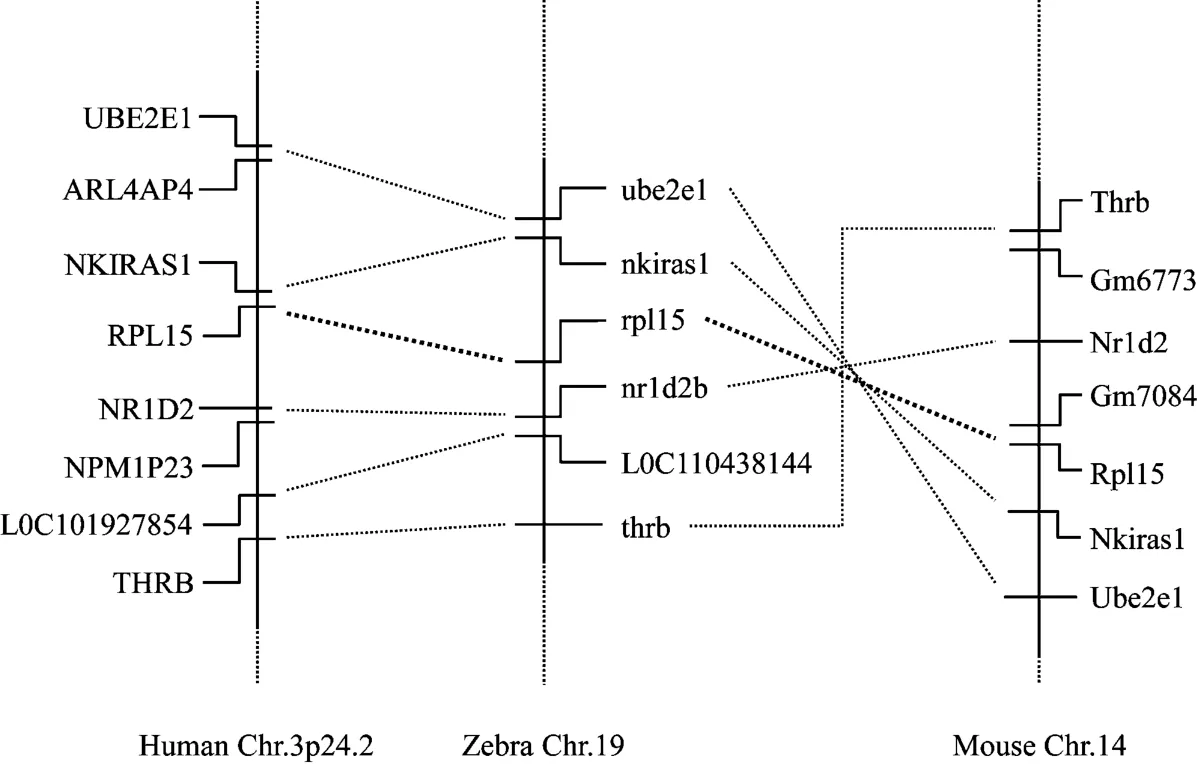
图1 rpl15基因的Synteny分析结果Figure 1 Synteny analysis of rpl15 gene among homo sapiens and zebrafish
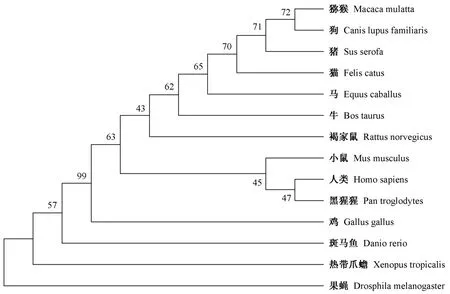
图2 rpl15基因的系统发育分析Figure 2 Alignment of rpl15 in different organizations
2.2 pCS2+-rpl15重组质粒测序结果
将经氨苄抗性筛选的重组质粒用RT-PCR初步验证,再将RT-PCR验证结果为正确(图3)的质粒进行测序,通过比对测序结果与rpl15的基因序列一致,未发生突变(图4)。
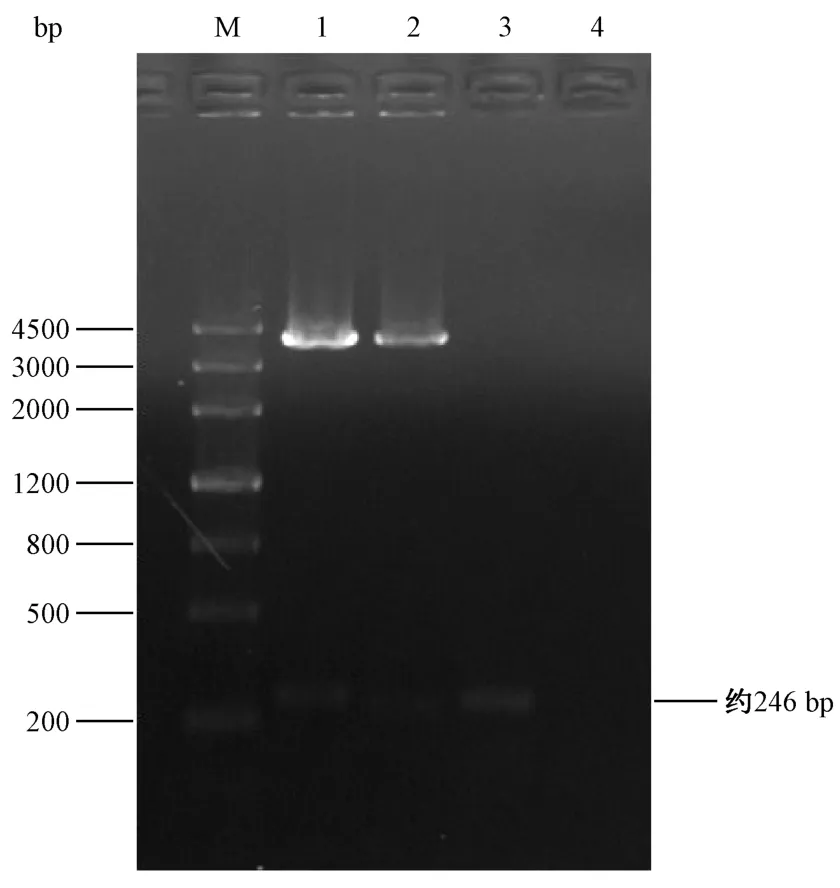
图3 pCS2+-rpl15重组质粒EcoRⅠ、NotⅠ双酶切产物电泳鉴定结果Note.M,DNA markⅢ.1,pCS2+.2,pCS2+-rpl15.3,rpl15 RT-PCR products.4,Blank control.Figure 3 Electrophoresis of double digested product of pCS2+-rpl15 recombinant plasmid by EcoRⅠand NotⅠ
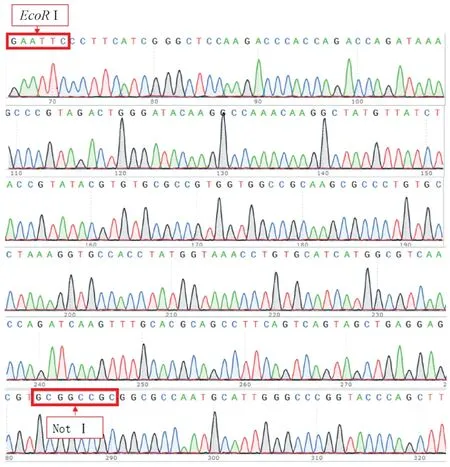
图4 pCS2+-rpl15重组质粒测序结果Figure 4 Gene sequencing analysis of pCS2+-rpl15 recombinant plasmid
2.3 rpl15基因在野生型斑马鱼胚胎发育早期的表达模式
在野生型斑马鱼胚胎发育过程中,在0.75~24 hpf均可见rpl15基因在组织中广泛表达的阳性杂交信号;在24 hpf,rpl15基因在斑马鱼的几乎所有细胞中广泛表达,在眼睛的表达最强;到48 hpf,rpl15在中枢神经系统、咽弓和肝肠中表达最强,在胰腺中的表达也开始显现;72 hpf仍然可见rpl15在后脑中的表达以及胰腺、肝和肠道中的表达(图5)。
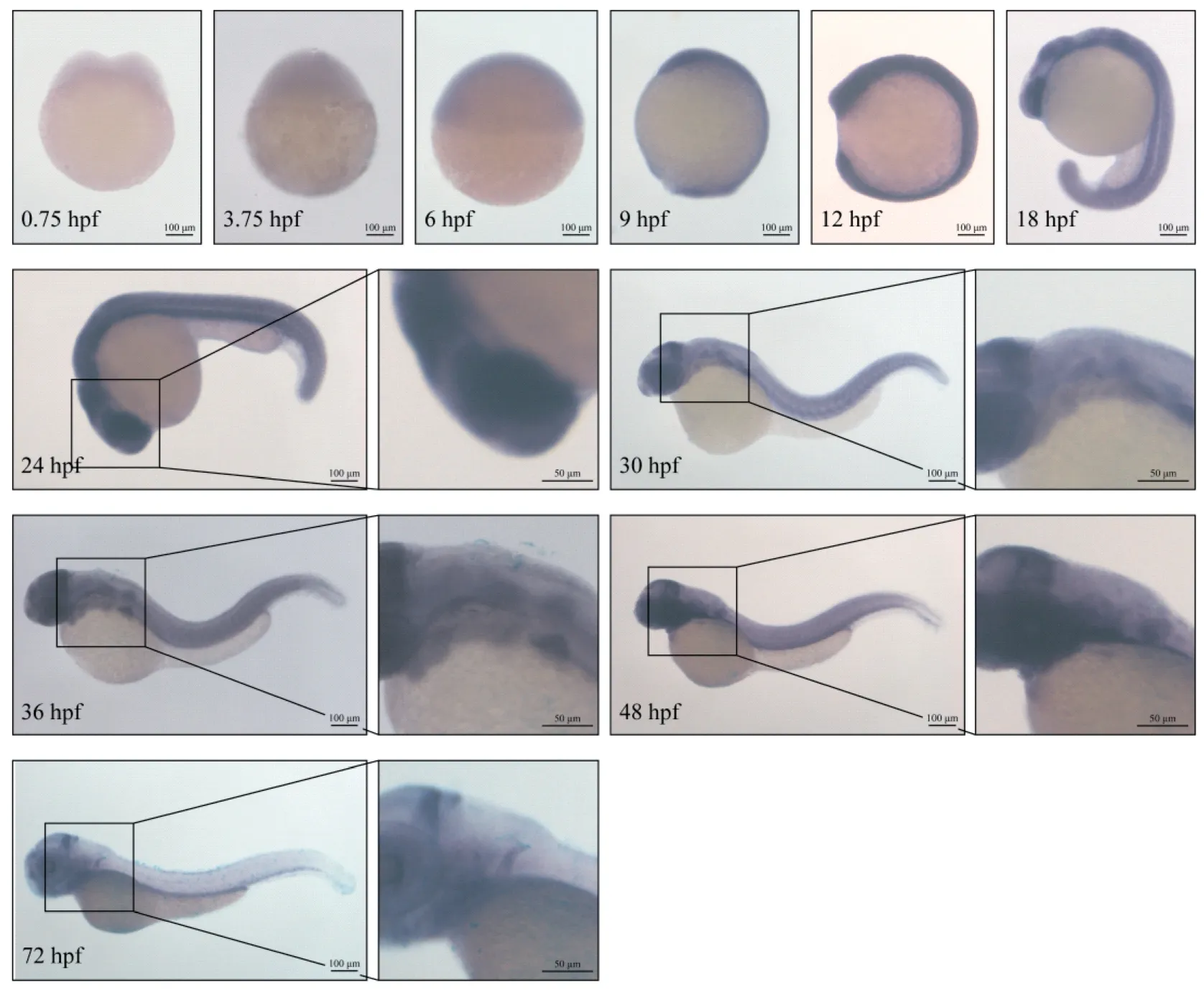
图5 原位杂交技术检测rpl15基因在野生型斑马鱼胚胎发育过程中的表达情况Figure 5 In situ hybridization of rpl15 gene
2.4 不同时相斑马鱼胚胎中Rpl15蛋白表达情况
Western blot结果显示,24 hpf时几乎观察不到Rpl15蛋白质的表达,在24、48、72 hpf,随着时间的增加,Rpl15蛋白质的相对表达量逐渐增多(图6)。
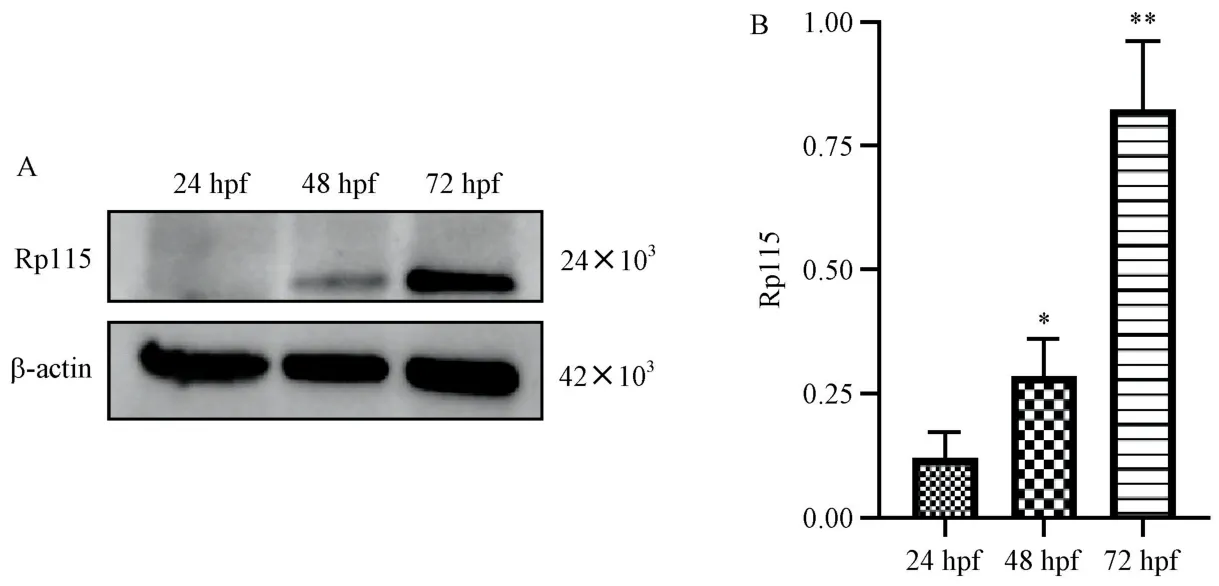
注:A:不同时相胚胎中Rpl15蛋白电泳图;B:不同时相胚胎中Rpl15蛋白表达水平(相对灰度值)。与24 hpf相比,∗P<0.05,∗∗P<0.01。图6 野生型斑马鱼胚胎不同时相的Rpl15蛋白水平的表达情况Note.A,Electrophoresis of Rpl15 protein in embryos in different phases.B,Expression levels of Rpl15 protein in embryos in different phases(relative gray values).Compared with 24 hpf,∗P<0.05,∗∗P<0.01.Figure 6 Rpl15 protein expression in zebrafish embryos at different time points
3 讨论
异常的核糖体生物合成导致的核仁增大是在100多年前的癌细胞中首次观察到的,RP基因的种系突变引起了与癌症相关的核糖体病DBA,DBA是第一个被发现和研究最广泛的核糖体疾病,DBA分子发病机制的第一个重大突破来自发现核糖体蛋白S19基因的突变[2-4]。随后又在DBA中发现了包括RPL15在内的其他20余个核糖体蛋白(RP)基因的突变[14]。虽然在过去的二十年中已经进行了广泛的研究,但由于患者样本的可获得性有限,缺乏合适的动物模型,携带致病RP基因纯合突变的敲除小鼠在发育早期死亡,如RPL5-/-、RPS19-/-的小鼠出现胚胎期致死,杂合突变体没有表现出异常症状[15]等原因,对DBA的发病机制仍然知之甚少,临床上也没有有效的治疗方法。在肿瘤样本中已证实有一些的RP的表达增加,但其意义尚不清楚。如在胃癌、食管癌、结肠癌中均发现RPL15的高表达[5-8]。在乳腺癌患者体内全基因组激活筛选促进远处转移的基因研究中发现,RPL15的高表达增加了多个器官的转移性生长,并选择性增强了其他核糖体蛋白的翻译[16]。在本研究中,斑马鱼Rpl15蛋白和人类的RPL15蛋白的相似度高,提示rpl15基因与人类高度相似及在进化过程中是相对保守的,利用斑马鱼来建立rpl15缺乏的模型是可行的,为深入研究RPL15的功能奠定实验基础。
斑马鱼(Danio rerio)是一种小型淡水鱼,最初起源于印度,是可用于研究人类疾病的脊椎动物发育生物学模式生物中的一种新的有效模式生物[17-19]。与小鼠模型相比,用斑马鱼作为DBA模型具有许多优势,包括胚胎发育快、胚胎透明,个体小易养殖,且在斑马鱼进化过程中,造血调控的基因高度保守,可用于研究造血发育系统。此外,斑马鱼的研究中还有一些疾病建模技术,如使用吗啉代反义寡核苷酸(morpholino,MO)敲低靶基因的表达或使用CRISPR/Cas9系统敲除目标基因来建立疾病模型[20]。本研究采用全胚胎原位杂交及免疫印迹试验分析在野生型斑马鱼胚胎发育过程中不同时期的组织中mRNA和蛋白水平的表达情况,有助于了解斑马鱼胚胎发育过程中该基因的表达情况。
本实验中制备了地高辛标记的rpl15基因反义mRNA探针,通过全胚胎原位杂交了解到rpl15作为核糖体蛋白,主要表达在包括肝、胰腺、肠道等内胚层组织,且在胚胎发育的过程中的脑部、眼睛、体节等组织中也观察到其表达。rpl15的表达在斑马鱼胚胎发育的不同阶段均有发现,这提示rpl15基因在斑马鱼胚胎发育的过程中起着重要的作用。
脊椎动物的造血发育是一个复杂的、多因素协调的过程[21]。24 hpf是斑马鱼原始造血的关键时期,此时斑马鱼的心脏开始跳动[22]。斑马鱼不同发育阶段的Rpl15的蛋白结果表明,24 hpf斑马鱼胚胎中几乎观察不到Rpl15蛋白水平的表达。提示在早期发育过程中Rpl15可能在24 hpf后的斑马鱼胚胎中开始发挥作用,其表达量在胚胎发育过程中随着时间的增加而增多。为本课题组使用MO或CRISPR/Cas9技术建立下调rpl15基因表达的模型提供了实验基础。
综上所述,本研究首先利用生物信息学确定了在斑马鱼的rpl15的高度保守性及利用斑马鱼建立rpl15基因相关的疾病模型是可行的;其次,全胚胎原位杂交技术证实,rpl15基因在野生型斑马鱼胚胎发育过程中广泛表达,几乎所有组织中均能检测到rpl15的表达,尤其是在发育中的胰腺、肝和肠道中,rpl15可能对斑马鱼胚胎的发育至关重要;最后通过免疫印迹证实Rpl15在24 hpf的胚胎中几乎没有表达,表明Rpl15蛋白表达开始于原始造血的关键期之后。本研究提示,可以利用斑马鱼建立以rpl15为靶点的疾病模型,为建立rpl15缺乏的疾病模型建立了实验基础。

