可善挺通过抑制C5a/C5aR1通路对银屑病小鼠皮肤炎症和自噬的调控作用
杨 羽赵菊花黎官印李 达王 洁陈 颖李 燃
(川北医学院第二临床医学院·南充市中心医院,四川 南充 637000)
银屑病是一种具有强遗传易感性和自身免疫性致病特征的慢性炎症性皮肤病[1],对患者的身体健康和生活质量产生显著影响[1-3]。可善挺(司库奇尤单抗注射液,Cosentyx)是临床上治疗中度至严重斑块性银屑病的药物,通过拮抗IL-17治疗银屑病[4]。最近有研究表明C5a/C5aR1通路在咪喹莫特(IMQ)诱导的小鼠银屑病皮损中的重要性[5],提示可以通过调节C5a/C5aR1信号缓解炎症反应,治疗银屑病。但迄今为止,可善挺是否通过C5a/C5aR1通路治疗银屑病尚无报道,因此本试验通过咪喹莫特制造银屑病小鼠模型,探究可善挺通过C5a/C5aR1通路对银屑病小鼠皮肤炎症和自噬的调控作用,为临床上治疗银屑病提供理论依据。
1 材料和方法
1.1 实验动物
27只雄性8周龄BALB/c小鼠,SPF级,体重(25±2)g,购于成都达硕生物有限公司[SCXK(川)2020-030],实验在四川大学华西医院动物实验中心进行[SYXK(川)2018-119],本实验严格按照3R原则进行,并通过了四川大学华西医院实验动物管理和使用委员会(IACUC)审批(IACUC 2020310A)。
1.2 主要试剂与仪器
可善挺®(1 mL:150 mg,司库奇尤单抗注射液,Cosentyx,瑞士诺华公司);咪喹莫特(IMQ)乳膏(181201,四川明欣药业有限责任公司);兔抗LC3(ab48394)、兔抗Beclin(ab62557)、C1qB兔抗(ab92508)、C3兔抗(ab200999)、C5a兔抗(ab202039)、C5aR1兔抗(ab252435)均购自英国Abcam公司;酶标仪(美国,赛默飞);ECL凝胶成像系统(美国,BIO-RAD公司)等。
1.3 实验方法
1.3.1 实验分组
小鼠适应性饲养1周后,将小鼠随机分为3组,每组9只:分别为空白对照组(Blank group)、银屑病模型组(Psoriasis-model group)、可善挺治疗组(Cosentyx-treat group),分组具体处理如下:
空白对照组(Blank group):仅做备皮处理,使小鼠背部暴露出约4 cm×4 cm矩形无毛区域。如备皮过程中不慎划伤小鼠皮肤,则立即使用百多邦软膏外涂于患处避免感染并将受伤小鼠单笼饲养直至伤口痊愈。
银屑病模型组(Psoriasis-model group):备皮,使小鼠背部暴露出约4 cm×4 cm矩形无毛区域,用0.06~0.07 g咪喹莫特乳膏均匀涂抹于小鼠背部无毛区域,厚度约为1~2 mm,充分涂抹以使药物被皮肤吸收,早晚各一次,涂抹7 d。7 d后小鼠皮肤造模区域出现鳞屑、红斑以及脱屑情况,表明造模成功。同时从造模开始的第1、6、13天在银屑病造模部位附近进行皮下注射生理盐水,1 d两次(早晚各一次),每次30 μL/kg,两次则60 μL/kg,避免在银屑病皮损部位进行注射。
可善挺治疗组(Cosentyx-treat group):治疗组造模方式与模型组相同,然后分别从造模开始的第1、6、13天在银屑病造模部位附近进行皮下注射可善挺®(司库奇尤单抗注射液),1 d两次(早晚各一次),每次30 μL/kg,两次则60 μL/kg,避免在银屑病皮损部位进行注射。
分别在造模第2、7、14天均采用脱颈椎法处死,每次3只,用无菌手术剪剪取小鼠背部靶皮损皮肤,并将该皮肤组织平均分为若干份保存于-80℃冰箱中保存备用。
1.3.2 HE染色
将小鼠皮损组织用4%中性甲醛溶液固定,浓度梯度乙醇脱水,二甲苯透明,石蜡包埋,成片,苏木精与伊红染色,在显微镜下观察第14天各组小鼠局部皮损组织的病理学改变拍照并保存。
1.3.3 ELISA检测
将皮损组织匀浆加入ELISA板中,室温孵育,洗板5次后加入酶联亲和物,室温孵育,洗板,加入底物溶液,室温下避光孵育,最后加入终止液终止反应。测定450 nm处吸光度(A)值。用IL-4、IL-8、TNF-α和IL-1β的标准品分别制备梯度浓度的工作液,测定标准曲线,计算第2、7、14天局部皮损组织中促炎因子IL-4、IL-8、TNF-α、IL-1β的分泌情况。
1.3.4 髓过氧化物酶(MPO)活性检测
按照MPO检测试剂盒说明书(中国,南京建成生物有限公司)将皮损组织与试剂二混合成5%匀浆,加入试剂三,37℃水浴15 min,分装成两管,均加入试剂四,然后其中一管加显色剂,另一管加双蒸水作为对照,37℃水浴30 min,加入试剂七,60℃水浴10 min,水浴后立即在460 nm处测其吸光度值。然后对第2、7、14天各组小鼠局部皮损组织中性粒细胞(MPO)的浸润情况进行计算,计算活性值公式如下:

1.3.5 Western blot检测
通过皮损组织组织蛋白提取、BCA法蛋白浓度确定、SAS-PAGE凝胶电泳、转模、蛋白免疫印迹、显色反应等步骤,显色后的蛋白使用Bio-Rad全功能成像系统采集图像,Image-Pro Plus分析光密度,以β-actin为内参,空白对照组目标蛋白质相对含量为1,计算各组蛋白质的相对表达量,以此检测第2、7、14天各组小鼠自噬相关基因Beclin 1和自噬体的经典标记物微管相关蛋白LC3-Ⅱ/LC3-I蛋白在各组小鼠局部皮损组织中的表达量。
1.3.6 免疫组化法检测
将小鼠皮损组织切片后,选用3% H2O2阻断5 min,PBS洗涤,选择加入对应的缓冲液,孵化10 min,洗涤,滴入5% BSA封闭液,室温孵化30 min,滴入抗体进行孵育,洗涤,生物素标记,二抗孵育,洗涤,BAD显色,苏木素复染,在显微镜下观察C5a、C3、C5aR1、C1qB的表达情况,并利用图像分析利用成像自动分析系统Image-ProPlus进行光密度扫描处理,求出各个标本的积分光密度(IOD)与面积;平均光密度(AOD)即为积分光密度与面积的比值,代表各组标本中细胞化学反应强度的变化。免疫组织化学染色图片显示棕黄色为阳性。
1.4 统计学方法
用SPSS 19.0分析软件进行数据处理分析,数据结果均以平均数±标准差(¯x±s)表示,采用单因素方差分析进行组间比较,分析方法为Duncan多重比较方法,P<0.05为差异有显著性。
2 结果
2.1 可善挺减缓银屑病模型小鼠皮肤损伤程度
HE染色结果见图1,空白对照组皮肤组织表皮结构完整清晰,角化层明显,复层扁平上皮层较薄,细胞排列较为整齐紧密;真皮内胶原纤维交错排列,胞质红染、均匀;结缔组织与脂肪层结构清晰可见;皮下肌层肌纤维排列整齐,体积大小均一,细胞核形态正常,核仁多分布四周;未见明显病理变化。而通过咪喹莫特造模后,可见复层扁平上皮层增厚,细胞排列紊乱,表皮外层覆盖一层痂皮;真皮浅层部分胶原纤维坏死,坏死区域内可见少量的单个圆形深染的淋巴细胞浸润,较多长椭圆形的成纤维细胞和长梭形的纤维细胞增生,真皮内出血,可见较多红细胞渗出于纤维组织之间。经可善挺治疗后,皮肤复层扁平上皮层增厚、细胞排列紊乱、真皮浅层部分胶原纤维坏死、真皮浅层部分内淋巴细胞浸润和真皮内出血情况等均有所改善,表明可善挺能明显抑制咪喹莫特诱导的银屑病引起的小鼠局部皮肤损伤。
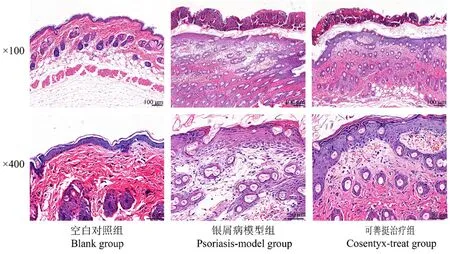
图1 小鼠皮肤HE染色结果Figure 1 HE staining results of mouse skin
2.2 可善挺减轻银屑病模型小鼠皮肤炎症反应
通过对小鼠皮损组织中IL-4、IL-8、TNF-α、IL-1β和MPO的分泌量检测(见图2)发现,银屑病模型组小鼠皮损组织中IL-4、IL-8、TNF-α、IL-1β和MPO分泌量在第2、7、14天均显著高于空白对照组(P<0.05),表明咪喹莫特诱导了小鼠局部皮损组织的炎症。经可善挺治疗后,第2天,与造模组相比,IL-4、IL-8、TNF-α、IL-1β和MPO分泌量均下降(P>0.05),治疗第7天,可善挺治疗组IL-4分泌量显著低于造模组(P<0.05),IL-8、TNF-α、IL-1β和MPO也低于造模组(P>0.05),治疗第14天,可善挺治疗组IL-4、IL-8、TNF-α、IL-1β和MPO分泌量均显著低于造模组(P<0.05),这些结果提示可善挺可以降低皮损组织中促炎因子IL-4、IL-8、TNF-α、IL-1β的分泌和减轻中性粒细胞(MPO)的浸润情况,从而减轻咪喹莫特诱导的银屑病模型小鼠皮肤炎症反应。
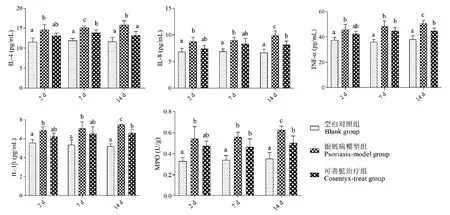
注:组间比较,有字母相同,P>0.05;无字母相同,P<0.05。图2 皮损组织中IL-4、IL-8、TNF-α、IL-1β和MPO的检测结果Note.Comparison between groups,there are letters the same,P>0.05.No letters the same,P<0.05.Figure 2 Results of IL-4,IL-8,TNF-α,IL-1β,and MPO in lesion tissue
2.3 可善挺增强银屑病模型小鼠皮肤组织自噬活性
Beclin 1和LC3-Ⅱ/LC3-I检测结果如图3所示,银屑病模型组小鼠Beclin 1相对蛋白表达量和LC3-Ⅱ/LC3-I比值在第2、7、14天均显著低于空白对照组(P<0.05),提示咪喹莫特诱导的银屑病降低了细胞自噬活性。可善挺治疗第2天,治疗组Beclin 1相对蛋白表达量和LC3-Ⅱ/LC3-I比值均高于模型组,但差异不显著(P>0.05),治疗第7天和治疗第14天,治疗组Beclin 1相对蛋白表达量和LC3-Ⅱ/LC3-I比值显著高于模型组(P<0.05),本实验结果表明可善挺能增强银屑病模型小鼠皮肤组织自噬活性。
2.4 可善挺对银屑病模型小鼠C5a/C5aR1通路的影响
2.4.1 可善挺对银屑病模型小鼠C1qB分子表达的影响
免疫组化法检测小鼠皮损组织C1qB分子表达结果图4所示,结果表明,实验的第2天,第7天和第14天咪喹莫特诱导的银屑病模型组小鼠皮损组织C1qB分子均被广泛活化。在实验的第7天和第14天,与银屑病模型组相比,可善挺治疗组小鼠皮损组织中C1qB分子活化被抑制,其中第7天C1qB分子表达显著降低(P<0.05)。
2.4.2 可善挺对银屑病模型小鼠C3分子表达的影响
免疫组化法检测小鼠皮损组织C3分子表达结果如图5所示,结果表明,实验的第2天,第7天和第14天咪喹莫特诱导的银屑病模型组小鼠皮损组织C3分子均被广泛活化。在实验的第2天和第7天,与银屑病模型组相比,可善挺治疗组小鼠皮损组织C3分子活化被明显抑制(P<0.05),表明可善挺抑制了C3分子的表达。
2.4.3 可善挺对银屑病模型小鼠C5a分子表达的影响
免疫组化法检测小鼠皮损组织C5a分子表达结果如图6所示,结果表明,实验的第2天,第7天和第14天咪喹莫特诱导的银屑病模型组小鼠皮损组织C5aR1分子均被广泛活化。在实验的第2天、第7天和第14天,与银屑病模型组相比,可善挺治疗组小鼠皮损组织C5aR1分子活化被抑制,第7天和第14天C5a分子的表达被显著抑制(P<0.05)。
2.4.4 可善挺对银屑病模型小鼠C5aR1分子表达的影响
免疫组化法检测小鼠皮损组织C5aR1分子表达结果如图7所示,结果表明,实验的第2天,第7天和第14天咪喹莫特诱导的银屑病模型组小鼠皮损组织C5aR1分子均被广泛活化。在实验的第2天和第7天,与银屑病模型组相比,可善挺治疗组小鼠皮损组织C5aR1分子活化被明显抑制(P<0.05),结果与C3分子检测结果一致。
3 讨论
咪喹莫特(IMQ)是银屑病模型常用的诱导剂,符合银屑病模型的多项标准[6-8],并且IMQ造模简单,成本低,因此本实验采用IMQ诱导的小鼠银屑病模型[9]。本实验HE染色结果显示,IMQ诱导的银屑病模型组小鼠局部损伤皮肤出现了复层扁平上皮层增厚,细胞排列紊乱,淋巴细胞浸润,纤维细胞增生等银屑病组织典型病变,表明IMQ诱导的银屑病样小鼠模型建立成功。可善挺治疗组HE染色结果表明,可善挺一定程度上抑制了小鼠皮肤组织复层扁平上皮层增厚,淋巴细胞浸润,纤维细胞增生等现象,提示可善挺减缓了银屑病模型小鼠皮肤损伤程度,MPO检测结果也表明,可善挺降低了银屑病皮损组织中炎性细胞浸润。
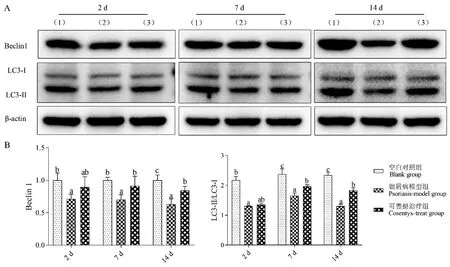
注:A:Western blot结果条带。(1):空白对照组;(2):银屑病模型组;(3):可善挺治疗组;B:Western blot统计结果。组间比较,有字母相同,P>0.05;无字母相同,P<0.05。图3 Western blot检测皮肤组织中Beclin 1蛋白相对表达量和LC3-Ⅱ/LC3-I蛋白表达量比值Note.A,Results of Western blot band.(1),Blank group.(2),Psoriasis-model group.(3),Cosentyx-treatment group.B,Statistics of Western blot.Comparison between groups,there are letters the same,P>0.05.No letters the same,P<0.05.Figure 3 Results of Beclin 1 and LC3-Ⅱ/LC3-I in lesion tissue
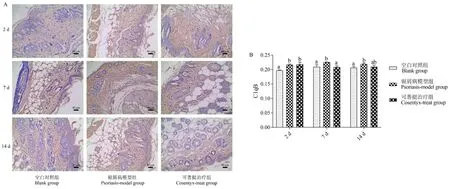
注:组间比较,有字母相同,P>0.05;无字母相同,P<0.05。图4 皮损组织C1qB免疫组化检测结果Note.Comparison between groups,there are letters the same,P>0.05.No letters the same,P<0.05.Figure 4 Immunohistochemical result of C1qB in skin lesions
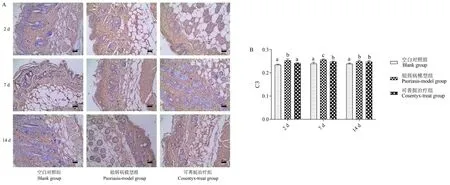
注:组间比较,有字母相同,P>0.05;无字母相同,P<0.05。图5 皮损组织C3免疫组化检测结果Note.Comparison between groups,there are letters the same,P>0.05.No letters the same,P<0.05.Figure 5 Immunohistochemical result of C3 in skin lesions
补体系统作为抵御外来病原体的第一道防线,是先天免疫最重要的分支之一[5]。补体通过经典途径、替代途径和凝集素途径汇集到C3分子水平发挥作用[10]。C1qB是补体经典途径重要分子,通路激活后,补体C3分子活化,然后C3分子通过活化下游C5a/C5aR1通路进而参与疾病的发生[11],此外,补体活化过程产物C3a(C3裂解产物)和C5a也会参与炎症反应[12]。有研究表明补体系统参与了银屑病炎症过程,C5a/C5aR1通路可以调节银屑病小鼠皮损组织中TNF-α,IFN-α/γ,IL-17A,IL-22,IL-23A等促炎因子的表达[5]。而银屑病是一种以Th1、Th2和Th17炎症轴失衡为特征的疾病[13],可善挺是IL-17A拮抗剂[14],研究表明可善挺可以通过拮抗IL-17治疗银屑病[4],但尚无人研究可善挺是否通过C5a/C5aR1信号通路调节银屑病炎症。因此,本研究准备补上这个空白,我们实验证明可善挺可能通过抑制C5a/C5aR1通路,降低IL-4、IL-8、TNF-α、IL-1β炎症因子的表达,提示靶向抑制C5a/C5aR1信号通路可能是一种新的治疗银屑病的方法。
自噬是细胞受到应激时消除受损或有害成分,从而使细胞存活的细胞过程[15-17]。Beclin1(也称为Atg6)是自噬初始阶段双膜自噬体形成所必需的因子[18],主要通过与其他自噬相关蛋白如Bcl-2、Vps34等结合形成巨大的蛋白复合物来促进自噬的启动[19]。LC3与自噬空泡的数量成正比,LC3-I向LC3-Ⅱ转化被认为是自噬活化的标志[20-22]。补体系统与细胞自噬也具有相关性,自噬过程中,C3可以通过C3/ATG16L1通路激活细胞自噬[23]。有研究表明,在糖尿病条件下,C3蛋白维持自噬,防止β细胞死亡[23]。在生理条件下,补体蛋白C3沉积在细菌上,通过直接的C3/ATG16L1相互作用使细菌被靶向自噬,导致自噬依赖的细菌生长受限[24]。在本研究中可善挺抑制了C5a/C5aR1信号通路,但却提高了银屑病皮损组织中的自噬活性,表明C3在银屑病模型中可能不是参与调控银屑病细胞自噬的主要途径,可善挺可能通过其它通路对细胞自噬进行调节。因此,针对可善挺活化银屑病皮损组织细胞自噬的分子机制有待进一步研究。
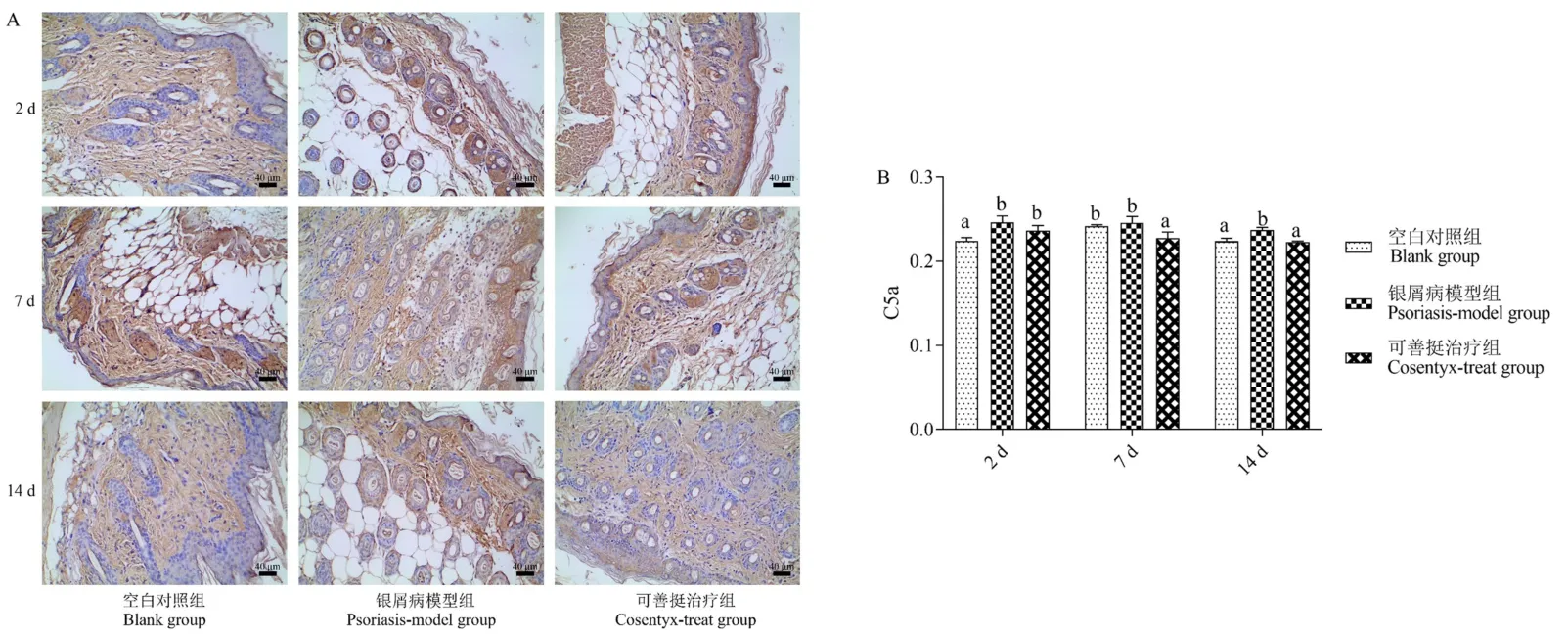
注:组间比较,有字母相同,P>0.05;无字母相同,P<0.05。图6 皮损组织C5a免疫组化检测结果Note.Comparison between groups,there are letters the same,P>0.05.No letters the same,P<0.05.Figure 6 Immunohistochemical result of C5a in skin lesions
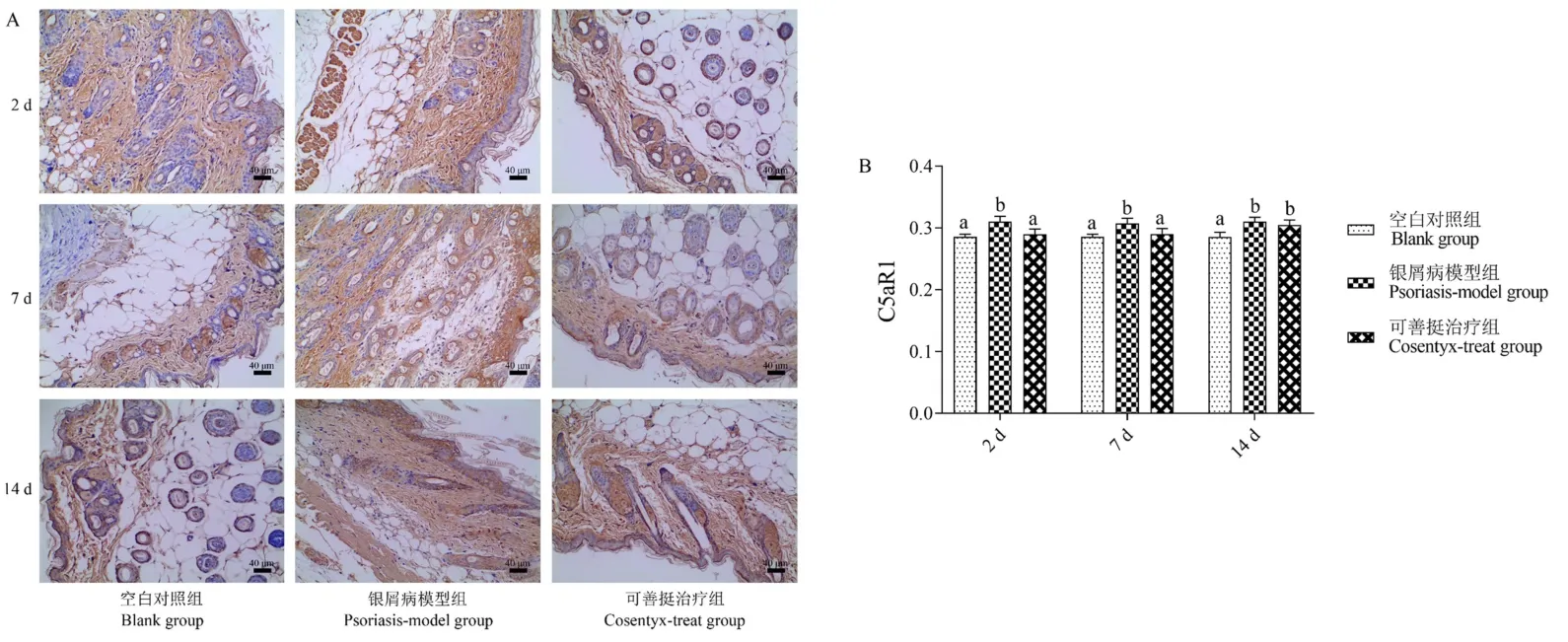
注:组间比较,有字母相同,P>0.05;无字母相同,P<0.05。图7 皮损组织C5aR1免疫组化检测结果Note.Comparison between groups,there are letters the same,P>0.05.No letters the same,P<0.05.Figure 7 Immunohistochemical result of C5aR1 in skin lesions
本研究表明,可善挺增强了银屑病小鼠皮损组织自噬活性,并通过调节C5a/C5aR1信号通路缓解了IMQ诱导的银屑病小鼠皮损组织炎症,为临床上使用可善挺治疗银屑病提供了理论依据。同时也表明靶向抑制C5a/C5aR1信号通路是一种可行的治疗银屑病的方法。此外,可善挺是否通过C5a/C5aR1通路调节银屑病皮损组织细胞自噬效果还需进一步研究。

