磁固相萃取-气相色谱法检测黄瓜中丙溴磷
董融融 林丽云 李琪 叶剑芝 林玲 马会芳 曾绍东 杨春亮


摘 要:復杂样品前处理极大的影响分析结果的准确度和分析过程的时效性,因此建立高效的分离分析方法提高检测的准确性和效率具有重要意义。本研究通过一步水热法,合成了碳包覆四氧化三铁磁性纳米粒子(Fe3O4@C-Magnetic nanoparticles,Fe3O4@C-MNPs),利用透射电子显微镜(transmission electron microscope,TEM)、扫描电子显微镜(scanning electron microscope,SEM)、X射线衍射(X-ray diffraction,XRD)、X射线光电子能谱(X-ray photoelectron spectroscopy,XPS)、傅立叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)、振动样品磁强计(vibrating sample magnetometer,VSM)考察材料的形貌、结构以及磁性能,并以Fe3O4@C-MNPs作为磁性吸附剂,构建磁固相萃取-气相色谱法用于黄瓜中丙溴磷的定量检测,优化了影响磁固相萃取过程农药回收率的主要因素,即磁性吸附材料用量、萃取时间和溶液pH。结果表明:合成的Fe3O4@C-MNPs表面有丰富的官能团,粒径分布均匀,分散性好,具有超顺磁性,对有机磷农药(organophosphorus pesticides,OPs)丙溴磷有较好的吸附富集效果;最优条件下,即Fe3O4@C-MNPs磁性吸附剂用量0.06 g、溶液pH 6、吸附平衡时间10 min、洗脱剂为丙酮时,检测丙溴磷农药的线性范围在0.011~1.0 ?g/mL,检出限为0.0011 mg/kg;使用合成的磁性吸附剂材料Fe3O4@C-MNPs用于磁固相萃取-气相色谱法检测黄瓜实际样品中丙溴磷,回收率在95.0%~101.4%,相对标准偏差(relative standard deviation,RSD)为2.9%~8.5%。该方法有机试剂用量少,吸附剂可重复利用,降低检测成本的同时也更环保,检测效率也得到提高,检测结果准确可靠。
关键词:磁性纳米颗粒;前处理技术;气相色谱;有机磷农药;丙溴磷
Abstract: The pretreatment of complex samples greatly affects the accuracy of the analysis results and the timeliness of the analysis process. Therefore, it is of great significance to establish an efficient separation and analysis method to improve the accuracy and efficiency of detection. In this study, Fe3O4@C-MNPs with rich functional groups on the surface, uniform particle size distribution and good dispersion were successfully synthesized by an improved one-step hydrothermal method. The magnetic nanoparticles which have good adsorption properties for organophosphorus pesticides (OPs) are superparamagnetic. Using Fe3O4@C-MNPs as a magnetic adsorbent, a magnetic solid phase extraction-gas chromatography method was constructed for the quantitative determination of profenofos in cucumber. Transmission electron microscopy (TEM), scanning electron microscopy (SEM), X-ray diffraction (XRD), X-ray photoelectron spectroscopy (XPS), Fourier transform infrared spectroscopy (FTIR) and vibrating sample magnetometer (VSM) were used to observe the morphology, structure and magnetic properties of the materials. The main factors affecting the recovery rate of pesticides in the process of magnetic solid phase extraction (MSPE) were optimized, including the amount of magnetic adsorption materials, extraction time and solution pH. The experimental results showed that Fe3O4@C-MNPs had a good adsorption and enrichment effect. The optimal condition is that the amount of Fe3O4@C-MNPs magnetic adsorbent is 0.06 g, the solution pH is 6, the adsorption equilibrium time is 10 min, and the eluent is acetone. Under the optimal conditions, the linear range of profenofos pesticide detection was 0.011~1.0 ?g/mL, and the detection limit was 0.0011 mg/kg. The synthetic magnetic adsorbent material Fe3O4@C-MNPs was used to detect profenofos in actual cucumber samples by magnetic solid phase extraction-gas chromatography. The recoveries ranged from 95.0% to 101.4%, and the relative standard deviation (RSD) was 2.9%-8.5%. This method uses less organic reagents and the adsorbent can be reused. The method reduces the cost of testing and is more environmentally friendly. The testing efficiency is also improved. In addition, the detection results are accurate and reliable.
Keywords: magnetic nanoparticles; pretreatment technology; gas chromatography; organophosphorus pesticides; profenofos
有机磷农药(organophosphorus pesticides,OPs)因具备良好的预防、控制及根除害虫的能力而广泛应用于农业生产中以提高农作物产量[1]。然而,由于其较长的半衰期,OPs的残留会对农产品、环境和水系统造成严重污染[2]。此外,OPs是一种神经毒素,即使在低浓度下也会阻碍胆碱酯酶的活性并对人体造成健康危害[3]。丙溴磷是目前广泛应用的一种有机磷农药,属三元不对称的非内吸性广谱杀虫剂,有触杀和胃毒作用[4]。它能防治棉花、蔬菜、果树等农作物中的害虫和螨类,对多种作物害虫防治效果都很好,世界卫生组织把它划分为中等毒性农药[5]。关于丙溴磷农药的检测标准如NY/T 761—2008《蔬菜和水果中有机磷、有机氯、拟除虫菊酯和氨基甲酸酯类农药多残留的测定》、GB 23200.116—2019《食品安全國家标准 植物源性食品中90种有机磷类农药及其代谢物残留量的测定 气相色谱法》等对于样品的前处理步骤繁琐耗时,不能很好地满足大批量样品的检测要求,且有毒有害试剂用量较大,对检测人员的健康以及环境都造成一定威胁。因此开发高效、准确、环保的农药检测方法具有很大的研究意义。目前关于农药残留检测前处理方法已报道的技术包括液-液萃取技术[6]、固相萃取技术[7]、固相微萃取技术[8]、QuEChERS技术[9]以及分子印迹聚合物技术[10]等。这些技术也都存在一些样品前处理步骤复杂繁琐、结果重复性及回收率有待提高等问题。为了提高农药检测效率,降低检测成本,复杂样品基质中痕量物质分析就成为了食品中农药残留分析技术的主流,主要以色谱和质谱法进行定性和定量检测。总的来说仪器检测结果比较准确,检测结果可做执法依据,仍是国际上普遍接受的检测方法[11]。
样品的制备是农药残留检测中十分重要的一个环节,它不仅影响后续检测方法的选择也决定了检测结果的可靠性和准确性以及分析的时间和成本,适当的样品预处理还可以有效防止分析仪器的损坏[12]。近年来,磁固相萃取技术(magnetic solid phase extraction,MSPE)被广泛应用于环境、食品、生物、医药等领域样品的分离和富集[13]。该法可避免普通固相萃取技术吸附柱易堵塞以及繁琐的过柱操作等问题,具有操作简单、萃取时间短、有机试剂使用量少等优点[14]。其中Fe3O4基纳米材料由于其特殊的磁性能而备受关注。如姚伟宣等[15]将酸化的多壁碳纳米管与Fe3O4磁性纳米材料结合,合成了复合磁性碳纳米管杂化材料,用于水和蜂蜜样品中六种拟除虫菊酯类农药的定量检测。Chahkandi等[16]利用钾取代羟基磷灰石纳米粒子与Fe3O4磁性纳米材料结合,生成复合磁性纳米材料用于水样和果汁中有机磷类农药的检测。但是这些复合磁性纳米材料的合成条件苛刻,大多需要在超高温或强酸强碱条件下进行,操作步骤繁琐,耗时长且材料回收率不高。而采用一步水热法以葡萄糖为碳源,FeCl3·6H2O为铁源制备碳包覆四氧化三铁复合磁性纳米材料(Fe3O4@C-magnetic nanoparticles,Fe3O4@C- MNPs),该方法操作简便,将Fe3O4磁核的合成与修饰融为一步,大大缩短了材料合成时间。另外经过表面修饰的Fe3O4磁性核壳纳米粒子具有良好的超顺磁性、较大的比表面积和大量暴露的表面活性中心,这些特性使得该材料具有高吸附效率和分离效率。通过外部磁场作用,可以从多组分基质中富集分离丙溴磷农药,再将萃取液送入气相色谱仪进行定量检测。该检测方法准确度高、检测限低、检测范围广、效率高,为检测OPs提供了新的思路。
1 材料与方法
1.1 材料
1.1.1 材料与试剂 甲基异柳磷、喹硫磷、丙溴磷标准品(100 ?g/mL),天津农业部环境质量监督检验中心;葡萄糖(AR)、氨水(AR),广东光华化学厂有限公司;FeCl3·6H2O、NaCl(AR),上海阿拉丁有限公司;乙腈、丙酮、甲醇,均为色谱纯,北京科展生物科技有限公司;实验室用水为超纯水。
1.1.2 仪器与设备 GC-2010 Pro气相色谱仪(日本Shimadzu);GC-MS 5975气相色谱质谱仪(美国Agilent);Tecnai G2 F20场发透射电子显微镜(美国Fei);D8 Rigaku 9000粉末X射线衍射(德国Bruker);赛默飞 K-Alpha X射线光电子能谱(英国Thermo);Mastersizer 3000E马尔文激光粒度仪(英国Malvern);Tensor 27傅立叶转换红外光谱仪(德国Bruker);IKA-MS3 涡旋混合器(中国旦鼎);TOPPER-31750A数控高温电炉(美国Topsoe);台式真空干燥箱(中国森信);Milli-Q Academic 超纯水净化系统(美国Millipore)。
1.2 方法
1.2.1 Fe3O4@C-MNPs的合成 称取1.6 g FeCl3·6H2O、4.0 g葡萄糖、1.0 g聚乙二醇充分溶解于15 mL超纯水中。在800 r/min下搅拌15 min,边搅拌边逐滴加入氨水,然后将混合液转移至50 mL反应釜中密封,在200 ℃下加热反应12 h。反应完成后自然冷却至室温,用钕磁铁分离获得Fe3O4@C-MNPs固体材料。用乙醇和超纯水反复清洗材料,至上清液pH呈中性。将所得固体材料放入真空干燥箱60 ℃烘12 h,经研磨后即得Fe3O4@C-MNPs粉末,密封放于干燥器内保存备用。
1.2.2 Fe3O4@C-MNPs的表征 用扫描电子显微镜(SEM)、透射电子顯微(TEM)、马尔文粒度分析仪、X射线衍射(XRD)、傅里叶变换红外光谱(FTIR)观察了材料的尺寸、形貌和微观结构。利用X射线光电子能谱(XPS)和振动样品磁强计(VSM)表征了材料的元素组成,表面官能团以及磁性强度。采用粉末X射线衍射仪连续扫描记谱对产物物相进行表征,管电压为35 kV,管电流为25 mA,Cu Kα辐射,石墨单色滤波,测量角度范围10°~80°,扫描速度为5°/min。根据测试谱图衍射峰的位置和数目,d值和相对强度与标准JCPDS物相卡片进行对比分析,确定产物物相。采用德国Bruker公司的Tensor 27型号傅里叶变换红外光谱仪(FTIR)记录500~4000 cm?1波段吸收光谱。采用美国Quantum Design公司的PPMS-9综合物性测量系统在常温下,对材料磁性能进行测量。
1.2.3 Fe3O4@C-MNPs吸附性能考察 取100 ?g/mL的丙溴磷农药标准液,用丙酮稀释至4 ?g/mL的溶液,?18 ℃下保存备用。取配制好的2 mL不同浓度(低、中、高)丙溴磷溶液于离心管内,加入30 mg Fe3O4@C-MNPs,振荡吸附5 min,用钕磁铁收集已经吸附了溶液中丙溴磷的Fe3O4@C-MNPs沉淀,此时弃去上清液,取沉淀加入2 mL乙腈,超声洗脱3 min,钕磁铁吸附沉淀5 min,重复3次洗脱步骤,收集洗脱液6 mL。将洗脱液氮吹至近干,1 mL丙酮定容,涡旋30 s后过0.22 μm有机滤膜,转移至进样瓶。AOC-20I+ S自动进样器取1 μL进GC-FPD检测。检测条件:不分流进样,气化室温度为230 ℃,压力128 kPa,色谱柱流量为1.51 mL/min,色谱柱为RTX-1(30 m×0.25 mm×0.25 μm)。升温程序为先升温至100 ℃保持2 min,再以10 ℃/min升至260 ℃保持5 min,平衡时间0.5 min。氢气流量为62.5 mL/min,空气流量为90.0 mL/min。记录对应峰面积,外标法定量。
1.2.4 黄瓜样品待测液的制备及检测 黄瓜样品购于当地超市,用水略微冲洗表面,带皮切块匀浆,准确称取10.0 g样品于50 mL离心管内,加入5~6 g NaCl,20 mL乙腈,振荡提取5 min,100 00 r/min离心5 min。上清液转移至干净离心管内于4 ℃保存备用。
为了确认方法的准确性,采用气相色谱-质谱法对方法回收率进行验证。取部分上述黄瓜样品,分为4份(分别标记为1、2、3、4组),每份100 g,在2、3、4组黄瓜表面喷洒一定剂量的丙溴磷农药(100 ?g/kg),静置12 h后切块匀浆。按上述方法对黄瓜进行处理,收集洗脱液氮吹至近干,1 mL丙酮定容,涡旋后过0.22 μm有机滤膜,转移至进样瓶。取1 μL进行GC-MS检测,分析谱图计算出丙溴磷回收率,与本研究方法进行对比。色谱柱为Rtx-5MS(30.0 m0.25 mm×0.25 μm);升温程序为色谱柱先升温至80 ℃保持2 min,以40 ℃/min升温至200 ℃,再以20 ℃/min升温至280 ℃,保持10 min;进样口温度为230 ℃;不分流进样;流速为36.8 cm/s;进样量为1 μL。离子源为SIM;离子源温度为230 ℃;检测离子(m/z)为339、374、297。
2 结果与分析
2.1 Fe3O4@C-MNPs的合成与表征
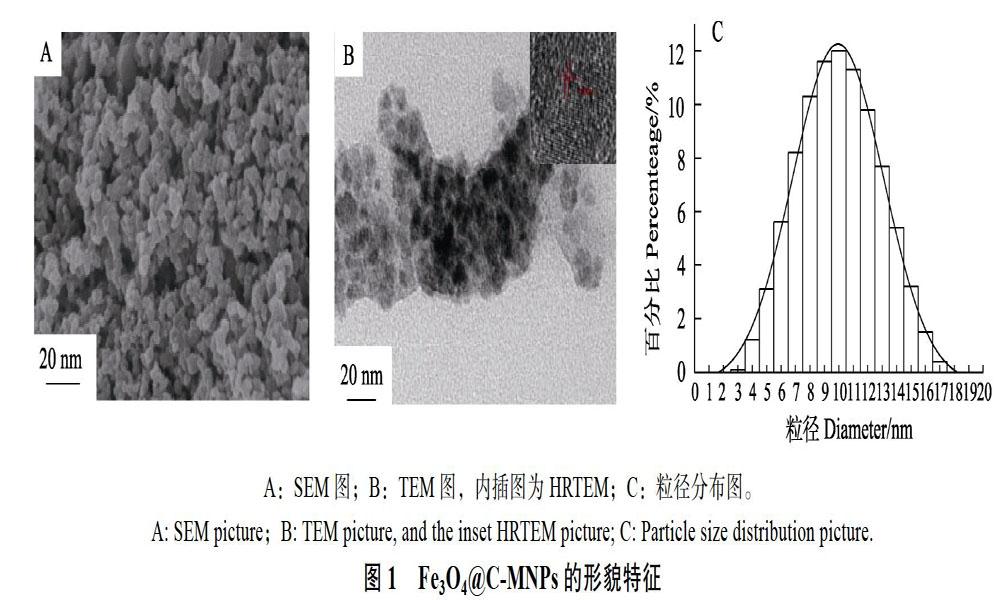
2.1.1 Fe3O4@C-MNPs的合成与结构表征 以FeCl3·6H2O、葡萄糖、聚乙二醇、氨水为原料采用一步水热法在最优条件下合成了Fe3O4@C-MNPs。为了考察所合成材料的形貌,通过SEM、TEM对其进行了表征。如图1A所示,材料呈类似球形的颗粒结构,颗粒尺寸分布较均一。通过TEM(图1B)图可以看到明显的碳包覆层。这也进一步说明成功将碳包覆上Fe3O4-MNPs。图1B中内插图为Fe3O4@C-MNPs的HRTEM图,显示Fe3O4@C-MNPs晶格间距为0.27 nm。图1C为通过DLS表征Fe3O4@C-MNPs 的粒径分布直方图,显示其粒径主要分布在8~ 12 nm范围内,最大粒径分布在10 nm,这与TEM和SEM显示的结果一致。
为了进一步研究Fe3O4@C-MNPs的组成结构,对该材料进行了XPS分析,通过XPS全谱可以看到该材料主要是由C、O、Fe三种元素组成(图2A)。各元素含量分别为C 70.94%、O 23.11%、Fe 5.95%,其中高分辨C 1s谱(图2B)含3个不同结合能峰,分别为283.93、284.8、285.4 eV。高分辨O 1s谱(图2C)含3个不同结合能峰,分别在529.3、529.9、531.5 eV分别为混合氧化物中结合氧、?OOH和?OH峰。高分辨Fe 2p(图2D)在710.2、723.9 eV出现2个特征峰。
2.1.2 Fe3O4@C-MNPs的光谱性能表征 为了进一步验证所合成材料晶体结构与Fe3O4磁性纳米粒子一致,对所制备的Fe3O4磁性纳米颗粒和Fe3O4@C-MNPs进行了X射线衍射分析。如图3A所示,Fe3O4@C-MNPs的XRD图中的衍射峰2θ 等于30.2°、35.6°、43.4°、53.7°、57.6°和62.8°分别对应于Fe3O4的(220)、(311)、(400)、(422)、(511)和(440)晶面,其与立方晶系反尖晶石结构标准卡片(CPDSNo.88-0866,D=6.75 ?)相吻合,衍射谱图中未见杂峰,表明样品里无杂质,且晶型单一说明所合成材料的晶体结构与Fe3O4晶体结构一致[17]。
将同样采用水热法合成的Fe3O4磁性纳米粒子和Fe3O4@C-MNPs 进行红外光谱分析,如图3B为Fe3O4磁性纳米粒子和Fe3O4@C-MNPs 在500~4000 cm?1范围内的吸收峰。红外图谱Fe3O4磁性纳米粒子和Fe3O4@C-MNPs在660 cm?1处都出现的特征峰对应于Fe-O吸收峰[18],在2900~ 3000 cm?1区域比较弱的吸收峰为?OH[21]的伸缩振动峰。Fe3O4@C-MNPs在1601 cm?1和1691 cm?1的吸收峰分别对应于C=O和C=C特征吸收峰[19-21],而Fe3O4磁性纳米粒子在此处吸收峰较弱,由此可以看出通过水热法成功地合成了Fe3O4@C-MNPs。
2.1.3 Fe3O4@C-MNPs的磁性能表征 图4为Fe3O4磁性纳米粒子和Fe3O4@C-MNPs在室温下的磁滞回线图。由图4可以看出,在最大磁场强度20000 Oe的外加磁场下,二者的矫顽力与剩磁率均接近零,由此可知,制备的Fe3O4磁性纳米粒子和Fe3O4@C-MNPs粒子均为超顺磁性。Fe3O4磁性纳米粒子的饱和磁化强度为74.71 emu/g,而经过表面修饰的Fe3O4@C-MNPs由于表面被非磁性的碳层包覆,饱和磁化强度减小为26.51 emu/g,但对于普通磁场仍保持了足够的磁响应。据文献报道,材料飽和磁化强度大于16.3 emu/g即可用于固液分离,因此制备的Fe3O4@C-MNPs颗粒可以用于复杂样品中残留农药的富集分离[22]。
2.2 丙溴磷的检测
为了验证Fe3O4@C-MNPs材料对丙溴磷的吸附效果,按低、中、高原则配制了4个不同浓度(标记为1、2、3、4组)的丙溴磷标准溶液,分别加入30 mg,Fe3O4@C-MNPs材料按1.2.3的方法进行处理,计算回收率,每个浓度做3组平行,结果如表1所示。丙溴磷吸附实验结果表明,Fe3O4@C-MNPs材料对于农药丙溴磷具有一定的吸附性。因此后续实验对材料吸附丙溴磷的磁固相萃取过程进行了优化,以期获得更高的农药回收率。
2.3 丙溴磷检测中磁固相萃取条件的优化
2.3.1 优化Fe3O4@C-MNPs的用量 本研究是利用Fe3O4@C-MNPs对于丙溴磷具有良好的吸附能力从而将其从复杂基质中富集分离出来,因此Fe3O4@C-MNPs的添加量将极大的影响检测结果。为了考察Fe3O4@C-MNPs的最佳用量,在室温下控制丙溴磷的浓度及其他条件不变,改变材料的添加量(20、30、40、50、60、70 mg)设计6组吸附实验,每组平行3次,最终结果以丙溴磷回收率作为指标。结果如图5A,丙溴磷的回收率随着Fe3O4@C-MNPs的添加量呈先增大后平稳的走势。在材料添加量为0.06 g时达到最大回收率,回收率为87.33%~90.35%。该回收率在标准范围内,说明该材料对丙溴磷吸附性良好,可以进行后续的优化实验。
2.3.2 优化吸附时间 在磁固相萃取中,为了使目标农药在磁性材料与样品溶液之间达到平衡,在MSPE过程中需要足够的吸附时间,时间过短农药不能完全被吸附剂吸附,农药回收率偏低,时间过长则不能有效地提高检测效率造成浪费。因此MSPE过程中吸附时间也是一个至关重要的影响因素。为了研究吸附时间在5~30 min内,丙溴磷回收率的变化,设计了吸附时间(5、10、15、20、25、30 min)6个实验组,每组平行3次。如图5B,当吸附时间为10 min时,丙溴磷回收率达到最大值,表明此时达到了吸附平衡。在10~30 min内,萃取回收率无明显变化。因此为了获取更高的准确度,缩短检测时间,在后续实验中选取10 min为吸附平衡时间。
2.3.3 优化溶液pH 样品的pH在磁固相萃取过程中能够影响农药的萃取效率,因为pH可以决定目标分析物在溶液中的状态。为了找到最优萃取条件,用HCl和NaOH来调节pH,设计了pH 3~12(3、6、9和12)4组实验,每组平行3次,对比丙溴磷的回收率。如图6A,在pH为6时,丙溴磷回收率最高为90.30%~96.51%。因此后续实验取pH为6进行。
2.3.4 优化洗脱剂种类 洗脱剂的极性会影响所吸附农药的洗脱效率,因此洗脱液的种类是影响 MSPE过程的重要因素。本研究对四种有机溶剂进行了实验,即丙酮(ACE),乙腈(ACN),甲醇(MA),乙腈∶甲醇(3∶1)。这些溶剂的解析效率如图6B所示。丙溴磷属于中极性有机磷农药,实验中3种溶剂极性大小为:乙腈>甲醇>丙酮。结果显示,在4种溶剂中,丙溴磷均有较好的回收率,平均回收率均大于90.0%,无显著性差异,因此后续实验中4种洗脱溶剂均可选择。为了缩短氮吹时间,故选择挥发性较好的丙酮为后续洗脱溶剂。
2.4 线性方程及检出限
在最优条件下,改变溶液中丙溴磷的浓度,按本研究建立的方法对不同浓度丙溴磷溶液进行检测。以溶液中丙溴磷浓度为横坐标,丙溴磷峰面积为纵坐标建立线性方程。如图7所示,当丙溴磷溶液浓度在0.011~1.0 ?g/mL范围内时,溶液丙溴磷浓度与丙溴磷峰面积呈良好线性关系,其线性回归方程为:Y=982685.92402X-41246.59884,相关系数R2为0.9982,检出限为0.0011 mg/kg。
2.5 实际样品中丙溴磷的检测
为了考察本研究所建立的方法在复杂基质样品中进行检测的可行性,实验对黄瓜样品进行了检测分析。在所制得的黄瓜样品中加入低、中、高不同浓度的丙溴磷标准溶液进行加标回收率实验。按方法1.2.4对加标黄瓜样品进行前处理,提取液中加入Fe3O4@C-MNPs粉末,在最优条件下进行磁固相萃取过程,萃取液进GC-FPD检测,每个浓度平行3组。结果如表2所示,丙溴磷加标回收率在95.0%~101.4%,RSD值在2.9%~ 8.5%。目前应用较广泛的QuEChERS方法有机磷农药回收率一般也只在80%以上,其中丙溴磷回收率在83.3%~96.1%,与之对比说明本方法的回收率较好,可用于实际样品的检测[23-24]。
为了验证所建立方法的准确性,采用气相色谱-质谱法对方法进行回收率考察。取部分上述黄瓜样品,在表面喷洒100 ?g/kg的丙溴磷,常温放置12 h后切块匀浆,按方法1.2.3进行处理,做3组平行样分析谱图,计算该样品回收率,结果如图8所示。气相色谱-质谱中检测离子(m/z)339为定量离子,374和297为定性离子,丙溴磷的出峰时间在8.75 min左右。试剂空白组在8.55~ 8.70 min的高峰为试剂丙酮,9.00 min之后的峰为杂质峰(图8A);未喷洒农药黄瓜样品组(基质空白组)中未检测出农药丙溴磷(图8B);用黄瓜提取液配制的丙溴磷标准液组(基质标准组)能够得到很好的丙溴磷农药峰型(图8C)。图8D为喷洒100 ?g/kg丙溴磷的黄瓜样品组(加标样品组),结果如表3所示。
式中,X为丙溴磷的含量,单位为mg/kg;A为丙溴磷的色谱峰面积;Cs为标准工作液中丙溴磷的浓度,单位为?g/mL;V1为定容体积,V3为提取液体积,V2为分取液体积单位mL;As為标准工作液中丙溴磷色谱峰面积;m为样品质量单位为g。
可以看出通过以上实验计算喷洒于黄瓜表面的丙溴磷农药浓度为91.60 ?g/kg,回收率为91.60%,RSD<1.8%,符合回收率标准,说明所建立方法的准确性好。
3 讨论
本研究中Fe3O4@C-MNPs为近圆形颗粒,Fe3O4@C-MNPs的晶格间距为0.27 nm,这与的Fe3O4的(220)面内晶格间距接近,说明在反应化过程中形成了Fe3O4颗粒。Fe3O4@C-MNPs的XPS表征说明其表面微观组成含Fe、O、C元素,表明在合成过程中成功将,碳材料复合到Fe3O4@C- MNPs中,这有利于进一步改善材料吸附性能。高分辨C 1s谱三个不同结合能的峰中,284.8 eV的峰为sp2碳(C-C/C=C)源于Fe3O4@C-MNPs的石墨结构,285.4 eV的峰为sp3碳(C-OR),283.93 eV的峰为(C-H)。高分辨O 1s谱的3个不同结合能峰分别在529.3、529.9、531.5 eV,分别为混合氧化物中结合氧、(C=O/-COOH/-C- OH),说明该Fe3O4@C-MNPs具有较多的含氧基团。另外,高分辨的Fe 2p谱中出现在710.5 eV和723.9 eV的2个特征峰,表明Fe元素以Fe3O4的形式存在[25]。推测关于Fe3O4@C-MNPs吸附OPs的原理为,Fe3O4@C-MNPs呈类球形结构且表面含有丰富的官能团,这使得其在水性基质中能很好地分散,这就增加了材料与目标分析物的接触面积,使得材料上的一些官能团与目标分析物结合,通过外部磁场对Fe3O4@C-MNPs的磁化作用,将目标分析物从复杂基质中分离出来。然而这种识别结合是不稳定的,通常可能为静电作用或范德华力,因此当加入强极性有机溶剂作为洗脱剂时,由于有机磷农药为有机相,根据相似相容原理这种识别结合就会被分离,目标分析物会被很快从Fe3O4@C-MNPs吸附剂上洗脱下来。
本研究通过一步水热法合成了对OPs具有良好吸附性能的超顺磁性纳米材料Fe3O4@C-MNPs。将该材料用于黄瓜中丙溴磷的萃取分离气相色谱定量检测,丙溴磷加标回收率在95.0%~101.4%,RSD值在2.9%~8.5%,检出限为0.0011 mg/kg,远低NY/T 761—2008中对于丙溴磷的检出限0.04 mg/kg,说明方法灵敏度好。
另外该材料在有机溶剂中经过洗脱烘干后可回收重复使用,有机试剂用量小,节约检测成本。本研究拓宽了复合碳纳米磁性材料在食品检测方面的应用,为食品中OPs的分析检测方法提供了新的平台。
参考文献
Wang J, Zhang J, Wang J, et al. Fluorescent peptide probes for organophosphorus pesticides detection[J]. Journal of Hazardous Materials, 2020, 389(5): 122074.
Sharma R K, Bala R, Kumar M, et al. Ultrasensitive aptamer biosensor for malathion detection based on cationic polymer and gold nanoparticles[J]. Biosensors & Bioelectronics: The International Journal for the Professional Involved with Research, Technology and Applications of Biosensers and Related Devices, 2016, 85(15): 445-449.
Thakkar J B, Gupta S, Prabha C R. Acetylcholine esterase enzyme doped multiwalled carbon nanotubes for the detection of organophosphorus pesticide using cyclic voltammetry[J]. International Journal of Biological Macromolecules, 2019, 137(15): 895-903.
韩曦莹. 气相色谱法测定陈皮中丙溴磷的残留量[J]. 食品安全质量检测学报, 2020, 11(10): 3301-3305.
LI Z X, Zhang Y H, Zhao Q Y, et al. Occurrence, temporal variation, quality and safety assessment of pesticide residues on citrus fruits in China[J]. Chemosphere, 2020, 258(13): 127381.
Pourreza N, Rastegarzadeh S, Larki A, et al. Determination of fungicide carbendazim in water and soil samples using dispersive liquid-liquid microextraction and microvolume UV-vis spectrophotometry[J]. Talanta, 2015, 134(1): 24-29.
张 权, 周贻兵, 林 野, 等. 固相萃取-气相色谱/质谱法测定蔬菜中77种农药残留[J]. 分析科学学报, 2018, 34(5): 699-704.
Rodrigues F D M, Mesquita P R R, Oliveira L S D, et al. Development of a headspace solid-phase microextraction/gas chromatography-mass spectrometry method for determination of organophosphorus pesticide residues in cow milk[J]. Microchemical Journal, 2011, 98(1): 56-61.
Anastassiades M, Lehotay S J, Stajnbaher D, et al. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and "dispersive solid-phase extraction" for the determination of pesticide residues in produce[J]. Journal of AOAC International, 2003, 86(2): 412-431.
Paulina G A, Héctor M P C, Audrey C, et al. Selective solid-phase extraction of organophosphorus pesticides and their oxon-derivatives from water samples using molecularly imprinted polymer followed by high-performance liquid chromatography with UV detection[J]. Journal of Chromatography A, 2020, 1626(8): 461346.
庄乾浩. 蔬菜中有机磷农药残留检测样品前处理方法研究[D]. 烟台: 烟台大学, 2014.
Zhang Y, Li G, Wu D, et al. Recent advances in emerging nanomaterials based food sample pretreatment methods for food safety screening[J]. Trac Trends in Analytical Chemistry, 2019, 121(12): 115669.
Li N, Jiang H L, Wang X L, et al. Recent advances in graphene-based magnetic composites for magnetic solid-phase extraction[J]. Trac Trends in Analytical Chemistry, 2018, 102(5): 60-74.
Dong R R, Yang C L, Lin L Y. Synthesis of Fe3O4-based magnetic nanocomposites and application in pesticide residue detection[C]. IOP Conference Series: Earth and Environmental Science, 2019, 358: 1-7.
姚偉宣, 应剑波, 张素玲, 等. Fe3O4纳米粒子修饰多壁碳纳米管的制备及在水和蜂蜜样品中痕量菊酯类农药分析中的应用[J]. 色谱, 2015, 33(4): 342-347.
Chahkandi M, Amiri A, Arami S R S. Extraction and preconcentration of organophosphorus pesticides from water samples and fruit juices utilizing hydroxyapatite/Fe3O4 nanocomposite[J]. Microchemical Journal, 2019, 144(1): 261-269.
黄 倩, 何 蔓, 陈贝贝, 等. 磁固相萃取-气相色谱-火焰光度检测联用测定果汁中的有机磷农药[J]. 色谱, 2014, 32(10): 1131-1137.
陈乃鹏. 傅里叶变换红外光谱对酒的鉴定综述[J]. 当代化工研究, 2019, 631(6): 22-24.
黄水波, 张朝晖, 周必武, 等. 磁性碳纳米管表面新型镉离子印迹聚合物制备及其对大米中的镉离子富集[J]. 应用化学, 2015, 32(11): 1299-1306.
焦玉荣, 张建宏, 弓 莹, 等. 核壳Fe3O4@NiSiO3磁性微纳米材料的合成及其吸附性能研究与表征[J]. 功能材料, 2019, 50(12): 12137-12141.
Zhao J, Meng Z, Zhao Z, et al. Ultrasound-assisted deep eutectic solvent as green and efficient media combined with functionalized magnetic multi-walled carbon nanotubes as solid-phase extraction to determine pesticide residues in food products[J]. Food Chemistry, 2020, 310(4): 125863.
Ma Z, Guan Y, Liu H. Synthesis and characterization of micron-sized monodisperse superparamagnetic polymer particles with amino groups[J]. Journal of Polymer science Part A Polymer Chemistry, 2005, 43(15): 3433-3439.
何 攀, 陳渠玲, 李枣枣, 等. 气相色谱法测定大米中7种有机磷农药[J]. 食品安全质量检测学报, 2019, 10(24): 8432-8435.
李杨梅, 杨 敏, 谭 伟, 等. 多壁碳纳米管固相萃取-气相色谱法检测蔬菜中毒死蜱、丙溴磷和三唑磷农药残留[J]. 食品工业科技, 2014, 35(019): 316-320.
Duan J J, Chen S, Dai S, et al. Shape control of Mn3O4 nanoparticles on nitrogen-doped graphene for enhanced oxygen reduction activity[J]. Advanced Function Materials, 2014, 24(14): 2072-2078.
责任编辑:崔丽虹

