LcMYB1激活荔枝花色苷生物合成关键基因LcDFR和LcUFGT1的启动子区域分析
赖彪 王琪 罗刚军 杜丽娜 王惠聪


摘 要:花色苷含量是荔枝果实呈现鲜红色的重要次生代谢产物,前人研究结果表明,LcMYB1通过调控关键基因的表达而影响荔枝果皮中花色苷的积累,其中LcDFR和LcUFGT1是荔枝果皮花色苷生物合成的关键基因,但是LcMYB1如何影响基因的表达,是否与结构基因启动子结合以及具体结合区段目前还不清楚。本研究通过克隆和分析LcDFR和LcUFGT1的启动子区域并对其进行分段处理,利用双荧光素酶和酵母单杂交实验,探究LcMYB1与LcDFR和LcUFGT1的启动子的结合区域。结果表明,LcDFR起始密码子上游1927 bp和LcUFGT1起始密码子上游1584 bp的启动子上分别有3个可能的MYB结合位点;双荧光素酶和酵母单杂交实验均显示LcMYB1可以结合LcDFR基因起始密码子上游904 bp到1425 bp包含有1个MYB-CORE元件的区域,LcMYB1与LcUFGT1基因启动子结合的区域是起始密码到上游610 bp,此区域包含有2个MYB-CORE元件。研究结果进一步证实了LcMYB1通过与基因LcDFR和LcUFGT1启动子结合发挥调控作用,并缩小了结合位点的范围。
关键词:LcMYB1;花色苷;LcDFR;LcUFGT1;启动子
Abstract: The accumulation of anthocyanins is one of the most important factors in determining the pericarp coloration of litchi. LcDFR (dihydroflavonol 4-reductase) and LcUFGT1 (UDP-glucose: flavonoid 3-O-glucosyltransferase) are two crucial enzymes in the anthocyanin biosynthesis pathway of litchi pericarp, and the activities and gene expressions directly affect litchi fruit coloration. Previous study showed that the expressions of LcDFR and LcUFGT1 were regulated by the LcMYB1 transcription factor. However, how LcMYB1 regulates the expression of the target genes, whether LcMYB1 binds to their promoter, which cis-element in the promoter is the binding site of LcMYB1 remain to be uncovered. In this study, the promoters of LcDFR (1927 bp) and LcUFGT1 (1584 bp) were cloned and analyzed respectively. Six candidate MYB binding sites and some other cis-elements such as light responsive elements and hormone related elements were predicted. The promoters of the two genes were then fragmented and ligated to pGreen-0800-luc plasmid to drive the expression of luciferase (LUC). Dual luciferase assay indicated that LcMYB1 could activate 904 bp to 1425 bp region of LcDFR promoter and 610 bp upstream of LcUFGT1 gene, which contain 1 and 2 candidate MYB-CORE sites, respectively. The interaction was also confirmed by the yeast one hybrid assay. These results suggested that LcMYB1 regulated the biosynthesis of anthocyanins by directly targeting the promoters of key structural genes and the binding region was narrowed down.
Keywords: LcMYB1; anthocyanins; LcDFR; LcUFGT1; promoter
荔枝(Litchi chinensis Sonn.)屬于无患子科荔枝属果树,是我国南方的特色水果之一,广受消费者喜爱。果实颜色是果品的重要外观品质指标,研究发现,随着荔枝果实逐渐成熟,荔枝果皮中叶绿素慢慢褪去,而花色苷不断合成从而呈现出鲜红色[1]。花色苷生物合成途径是类黄酮代谢途径的一个分支,参与花色苷生物合成的结构基因包括:查尔酮合成酶(Chalcone synthase, CHS)、查尔酮异构酶(Chalcone isomerase, CHI)、黄烷酮3-羟化酶(Flavanone 3-hydroxylase, F3H)、黄烷酮3′-羟化酶(Flavonoid 3′-hydroxylase, F3′H)、二氢黄酮醇4-还原酶(Dihydroflavonol 4-reductase, DFR)、花青素合成酶(Anthocyanidin synthase, ANS)和类黄酮糖基转移酶(UDP-glucose: flavonoid 3-O-glucosyltransferase, UFGT)[2-4]。
本课题组前期研究发现,荔枝果皮花色苷含量与大部分花色苷生物代谢相关酶活性正相关,特别是类黄酮糖基转移酶UFGT[1]。近年来,参与荔枝果皮花色苷生物合成的关键结构基因已经被克隆,表达分析结果显示结构基因LcDFR和LcUFGT1的表达与花色苷含量成显著正相关关系,异源和同源转化实验均证实LcUFGT1在荔枝花色苷生物合成过程中起关键的作用[5-7]。
自20多年前Paz-Ares等从玉米中发现MYB转录因子ZmC1基因以来,大量调控花色苷合成的关键MYB转录因子从各种草本植物和果实中得以分离鉴定[8-9]。研究发现,荔枝花色苷生物合成关键转录因子LcMYB1的表达水平与荔枝不同颜色品种果皮、不同组织和不同发育阶段果皮中花色苷含量成正相关,转LcMYB1烟草的花瓣和叶片中合成大量花色苷,同时烟草内源关键基因NtDFR、NtANS和NtUFGT的表达也大幅度提高[10]。然而,LcMYB1如何调控结构基因的表达以及转录激活结构基因启动子的具体结合区域尚待研究。
本研究利用基因组信息克隆了荔枝果皮花色苷生物合成的2个关键基因LcDFR和LcUFGT1的启动子序列,进一步通过生物信息学手段预测了启动子区域的MYB结合位点和其他重要的顺式作用元件,并通过启动子5′ 端删减结合双荧光素酶和酵母单杂交的方法缩小了LcMYB1激活2个启动子的范围,为进一步探索LcMYB1结合启动子的具体顺式作用元件奠定基础。
1 材料与方法
1.1 材料
1.1.1 植物材料 ‘妃子笑荔枝采自华南农业大学园艺学院教学实习基地,本氏烟草(Nicotiana benthamiana)种植于人工气候箱(22 ℃)。
1.1.2 菌株与载体 大肠杆菌(Escherichia coli)感受态细胞DH5α,购自宝日医生物技术(北京)有限公司公司;根癌农杆菌(Agrobacterium tumefaciens)菌株GV3101和植物瞬时表达载体pEAQ-MYB1由本实验室保存,pGreen-0800-luc由Roger P. Hellens教授(The New Zealand Institute of Plant and Food Research)饋赠;植物DNA提取试剂盒、胶回收试剂盒和质粒小提试剂盒,购自宝日医生物技术有限公司。
1.2 方法
1.2.1 DNA提取 取幼嫩的‘妃子笑叶片为材料,用DNA提取试剂盒提取荔枝叶片基因组DNA,具体方法参见说明书。
1.2.2 启动子的克隆及生物信息分析 根据荔枝基因组信息(http://litchidb.genomics.cn/page/ species/index.jsp),设计了特异引物DFRp-F和DFRp-R扩增LcDFR启动子,UFGTp-F和UFGTp-R扩增LcUFGT1启动子,引物序列见表1。用高保真酶PrimeSTAR? Max DNA Polymerase(Takara)以DNA为模板扩增LcDFR和LcUFGT1基因的启动子。扩增的DNA片段利用Infusion技术(Takara)分别与用Nru I和Xho I双酶切线性化的pGreen-0800-luc连接。测序后,将得到的序列信息在软件PlantPAN2.0(http://plantpan2.itps. ncku.edu.tw/)和PlantCARE(http://bioinformatics. psb.ugent.be/webtools/plantcare/html/)上分析启动子上可能的顺式作用元件。
1.2.3 不同删减启动子片段扩增及双荧光素酶载体构建 为了研究LcMYB1能否与结构基因启动子结合及其具体的结合区域,对LcDFR和LcUFGT1启动子进行了逐步删减处理,如图1所示。利用表1中的引物序列DFRp-F+DFRp-R、DFRp-F2+DFRp-R、DFRp-F3+DFRp-R、DFRp-F4+ DFRp-R分别扩增LcDFR基因上游1927、1425、904、433 bp到起始密码ATG的启动子的序列,得到4个启动子片段,分别为DFRp、DFRp1、DFRp2、DFRp3。同理,利用UFGTp- F+UFGTp-R、UFGTp-F2+UFGTp-R和UFGTp-F3+ UFGTp-R分别扩增了LcUFGT基因上游1580、1093、610 bp到起始密码的启动子序列,得到了3个启动子片段UFGTp、UFGTp1、UFGTp2(图1)。将得到的这些片段利用In-fusion技术分别于pGreen-0800- luc连接。将经测序正确后的载体利用热激法转化根癌农杆菌菌株GV3101备用。
1.2.4 双荧光素酶实验 转录因子激活结构基因启动子的能力通过测定萤火虫荧光素酶(firefly luciferase, LUC)检测,用CaMV:35S驱动的海肾荧光素酶(renilla luciferase, REN)作为对照。用生长4~6周健康的本氏烟草叶片用于瞬时表达转录因子和启动子驱动的萤火虫荧光素酶。挑选根癌农杆菌在10 mL YEP中培养过夜,离心收集菌体,用注射缓冲液MAA[10 mmol/L MES(2-[N-morpholino]ethanesulfonic acid)pH 5.6,10 mmol/L MgCl2,100 mol/L Acetosyringone]悬浮菌液至OD600为1.0左右。用注射器注射含有双荧光报告载体和瞬时表达载体pEAQ-LcMYB1的根癌农杆菌于烟草叶背面,并标记好注射范围,同时注射含pEAQ-HT的根癌农杆菌作为对照,瞬时表达和酶活力测定方法参见文献[11]。
1.2.5 酵母单杂交实验 酵母单杂交实验采用Clonteh公司的试剂盒Matchmaker? Gold Yeast One-Hybrid System(Clontech)进行。LcDFR基因上游904 bp至1425 bp区域的序列经LcDFRpro-F和LcDFRpro-R扩增后,用In-fusion技术将启动子片段连接到用Kpn I和Xho I酶切线性化的pAbAi载体上。同理,LcUFGT1基因上游610 bp至ATG区域的序列经LcUFGTpro-F和LcUFGTpro-R扩增后连接到pAbAi载体上,引物序列见表1。将LcMYB1全长经Nde I和BamH I酶切位点连接到pGADT7(AD)载体上。构建好的LcMYB1-AD重组质粒分别经PEG/LiAC介导转入LcDFRpro和LcUFGTpro的酵母感受态细胞,涂布于SD/-Leu/AbA平板。30 ℃培养3~5 d,观察酵母生长情况。
2 结果与分析
2.1 LcDFR启动子的克隆及顺式作用元件分析
基于荔枝基因组信息,利用特异引物经过PCR扩增测序得到长度为1927 bp 的LcDFR启动子序列信息。将扩增测序的启动子序列分别在PlantPAN 2.0和PlantCARE数据库中进行搜索发现了大量的MYB可能结合位点。如表2所示,LcDFR启动子上存在3个MYB-CORE位点(CNGTTR)。此外,还发现LcDFR基因上游688 bp处有1个防御与胁迫响应元件(TC-rich repeats),在上游463 bp处有1个温度响应元件(LTR),上游1110 bp处有1个赤霉素响应元件,还有大量的光响应元件(表2)。
2.2 LcUFGT启动子的克隆及顺式作用元件分析
基于荔枝基因组信息,利用特异引物经过PCR扩增获得LcUFGT1启动子序列并测序,得到的启动子序列长度为1584 bp。分析发现LcUFGT1启动子上有3个MYB-CORE位点。另外还发现了一些与环境与激素响应元件,比如光响应元件(AE-box,ATCT-motif,Box 4,Box I,CATT-motif,G-box,I-box等),温度响应元件(LTR),赤霉素响应元件(P-box),茉莉酸响应元件(CGTCA-motif),水杨酸响应元件(TCA- element)等,具体的位置和序列信息见表3。
2.3 LcMYB1结合LcDFR和LcUFGT1启动子区域的分析
本研究采用双荧光报告基因的检测方法研究LcMYB1转录因子和LcDFR与LcUFGT1启动子片段的结合区域。如图1所示,当LcDFR启动子从5′ 端开始减少到929 bp时,LcMYB1激活这段启动子的活力下降约70%,说明删减的这段区域(上游904 bp至1425 bp)内含有LcMYB1结合的重要顺式作用元件。进一步分析这段序列内的顺式作用元件,发现该段内含有1个MYB-CORE元件。当LcUFGT1启动子删减到上游610 bp时,启动子仍然保持着与1584 bp相同的活力。推测在LcUFGT1启动子的最后一段610 bp内含有LcMYB1重要顺式作用元件,分析发现该段内含有2个MYB-CORE元件,分别位于上游363 bp和上游85 bp处。
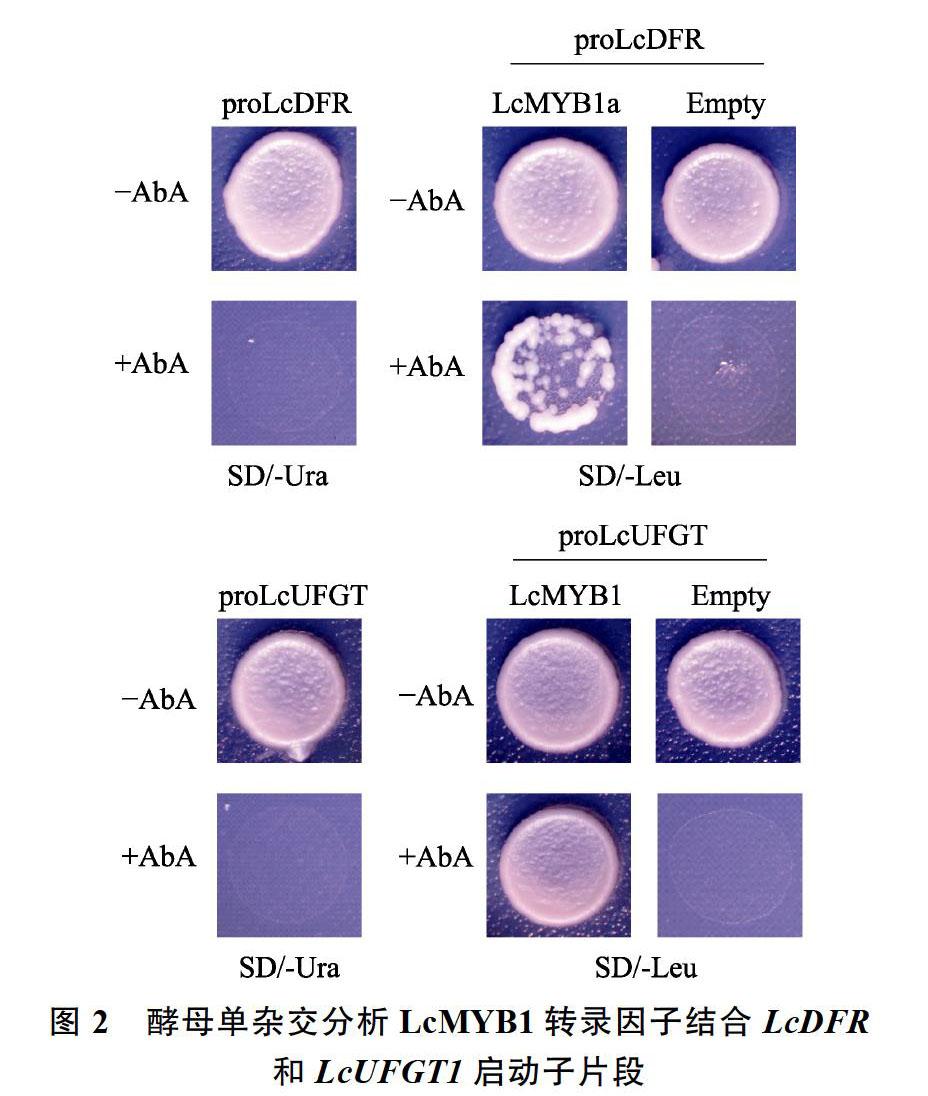
2.4 利用酵母单杂交验证LcMYB1结合LcDFR和LcUFGT1启动子的区域
将通过双荧光素酶实验验证的部分启动子序列LcDFR(上游904 bp至1425 bp)和LcUFGT(上游610 bp至ATG)连接到pAbAi质粒上得到proLcDER-AbAi和proLcUFGT-AbAi重组质粒,将这2个质粒分别转入Y1H Gold细胞中在不含有AbA的SD/-Ura上固体培养基上生长正常,说明2个启动子均已成功转入到酵母细胞中。当培养基中添加30 mmol/L AbA时,含有proLcDER- AbAi的酵母不能正常生长;当培养基中添加125 mmol/L AbA时,含有proLcUFGT-AbAi的酵母不能正常生长;说明一定浓度的AbA可以抑制启动子的本底活性。进一步将pGADT7-LcMYB1质粒分别转入含有proLcDER-AbAi和proLcUFGT- AbAi的酵母细胞后在不含AbA的SD/-Leu培养基上均能正常生长,说明pGADT7-LcMYB1质粒已经成功转入,且在含有AbA的SD/-Leu培养基上也能正常生长,说明LcMYB1编码的蛋白可以与上述的LcDFR和LcUFGT1启动子片段结合(图2)。
3 讨論
在植物的转录调控过程中,启动子上的顺式作用元件起着非常重要作用,反式作用因子通过与顺式作用元件结合调控基因的转录,从而影响特定的基因的时空表达特性及响应外界信号。植物花色苷生物合成是次生代谢途径中研究最为深入的途径之一,转录因子MYB-bHLH-WD40蛋白复合体通过与花色苷生物合成结构基因启动子结合调控其转录[12-14]。在烟草中,NtAn2(R2R3- MYB)能与bHLH转录因子形成复合体调控花色苷生物合成结构基因NtCHS和NtDFR的启动子,从而调控花色苷的积累[15-16]。矮牵牛中,PhJAF13(bHLH转录因子)和PhAN2(MYB转录因子)互作可以结合到PhDFR基因的启动子上[17]。在亚洲百合中,LhMYB12和LhMYB6能分别与LhbHLH2相互作用激活结构基因LhDFR,LhCHSa和LhCHSb的表达[18]。MdMYB1是光调控苹果果皮花色苷积累的关键转录因子,其可以激活花色苷生物合成结构基因MdDFR和MdUFGT的表达,杨梅的MrMYB1和AtbHLH共同表达时可以促进拟南芥AtDFR的启动子活性增加,MrMYB1与MrbHLH1相互作用可以调控杨梅果实中花色苷生物合成途径中的大多数结构基因[19-21]。上述的研究结果说明,MYB转录因子通过结合到结构基因启动子并激活其转录,决定花色苷是否积累和积累多少。在荔枝中,LcMYB1的表达水平与不同组织、不同荔枝品种果皮、同一品种不同发育阶段果皮中花色苷含量正相关,同时关键结构基因LcDFR和LcUFGT的表达模式与LcMYB1一致,这说明LcDFR和LcUFGT可能是LcMYB1的下游靶基因[5, 7, 10]。
MYB转录因子一般结合在启动子的两类顺式作用元件MYB-CORE elements (CNGTTR,也称MBS)和AC-rich elements([A/C]CC[A/T]A [A/C])[9]。LcDFR和LcUFGT1是荔枝花色苷生物合成的关键结构基因[5, 7]。它们的启动子序列包括有大量的顺式作用元件,其中LcDFR和LcUFGT1启动子上分别含有1和3个MYB-CORE元件。本研究通过启动子5′ 端删减的方法,确定了LcMYB1激活LcDFR基因起始密码上游929 bp到1449 bp的启动子區域,该区段仅包含1个MYB- CORE,LcUFGT1基因起始密码到上游617 bp的区域,该区段包含2个MYB-CORE。进一步利用酵母单杂交实验也验证了LcMYB1可以结合到LcDFR和LcUFGT1启动子的这部分片段上。在葡萄中,通过酵母单杂交实验发现VvMYBA1也可以结合到VvDFR和VvUFGT启动子上,但是具体的区段并没有进一步分析[22]。本论文利用双荧光素酶和酵母单杂实验证明了LcMYB1通过结合到LcDFR和LcUFGT1的启动子激活基因表达,从而发挥调控花色苷生物合成的作用,并且利用截短启动子序列的手段缩小了LcMYB1结合到启动子上的区域范围,为进一步的精确定位LcMYB1结合的顺式作用元件奠定良好的基础。
分析还发现在LcDFR和LcUFGT启动子上还发现了大量的光响应元件,前期研究发现套袋遮光抑制荔枝果皮花色苷积累,同时LcDFR和LcUFGT的转录也显著受抑制,这有可能和它们启动子上的光响应元件有一定的关系[5, 23]。此外,在LcDFR和LcUFGT启动子上还发现了一些胁迫响应和激素响应元件,是否这些元件也参与调控转录还需要进一步研究。
参考文献
王惠聪, 黄旭明, 胡桂兵, 等. 荔枝果皮花青苷合成与相关酶的关系研究[J]. 中国农业科学, 2004, 37(12): 2028-2032.
Springob K, Nakajima J, Yamazaki M, et al. Recent advances in the biosynthesis and accumulation of anthocyanins[J]. Natural Product Reports, 2003, 20(3): 288-303.
Winkel-Shirley B. Flavonoid biosynthesis. A colorful model for genetics, biochemistry, cell biology, and biotechnology[J]. Plant Physiology, 2001, 126(2): 485-493.
葛翠莲, 黄春辉, 徐小彪. 果实花青素生物合成研究进展[J]. 园艺学报. 2012, 39(9): 1655-1664.
Wei Y Z, Hu F C, Hu G B, et al. Differential expression of anthocyanin biosynthetic genes in relation to anthocyanin accumulation in the pericarp of Litchi chinensis Sonn[J]. PLoS One, 2011, 6(4): e19455.
Zhao Z C, Hu G B, Hu F C, et al. The UDP glucose: flavonoid-3-O-glucosyltransferase (UFGT) gene regulates anthocyanin biosynthesis in litchi (Litchi chinesis Sonn.) during fruit coloration[J]. Molecular Biology Reports, 2012, 39(6): 6409-6415.
Li X J, Zhang J Q, Wu Z C, et al. Functional characterization of a glucosyltransferase gene, LcUFGT1, involved in the formation of cyanidin glucoside in the pericarp of Litchi chinensis[J]. Physiologia Plantarum, 2015,156(2):139-149.
Paz-Ares J, Ghosal D, Wienand U, et al. The regulatory c1 locus of Zea mays encodes a protein with homology to myb proto-oncogene products and with structural similarities to transcriptional activators[J]. The EMBO Journal, 1987, 6(12): 3553-3558.
Xu W, Dubos C, Lepiniec L. Transcriptional control of flavonoid biosynthesis by MYB-bHLH-WDR complexes[J]. Trends in Plant Science, 2015, 20(3): 176-185.
Lai B, Li X J, Hu B, et al. LcMYB1 is a key determinant of differential anthocyanin accumulation among genotypes, tissues, developmental phases and ABA and light stimuli in Litchi chinensis[J]. PLoS One, 2014, 9(1): e86293.
Hellens R P, Allan A C, Friel E N, et al. Transient expression vectors for functional genomics, quantification of promoter activity and RNA silencing in plants[J]. Plant Methods, 2005, 1: 13.
Allan A C, Hellens R P, Laing W A. MYB transcription factors that colour our fruit[J]. Trends in Plant Science, 2008, 13(3): 99-102.
Hichri I, Barrieu F, Bogs J, et al. Recent advances in the transcriptional regulation of the flavonoid biosynthetic pathway[J]. Journal of Experimental Botany, 2011, 62(8): 2465- 2483.
王 華, 李茂福, 杨 媛, 等. 果实花青素生物合成分子机制研究进展[J]. 植物生理学报, 2015, 51(1): 29-43.
Pattanaik S, Kong Q, Zaitlin D, et al. Isolation and functional characterization of a floral tissue-specific R2R3 MYB regulator from tobacco[J]. Planta, 2010, 231(5): 1061-1076.
Bai Y, Pattanaik S, Patra B, et al. Flavonoid-related basic helix-loop-helix regulators, NtAn1a and NtAn1b, of tobacco have originated from two ancestors and are functionally active[J]. Planta. 2011, 234(2): 363-375.
Quattrocchio F, Wing J F, van der Woude K, et al. Analysis of bHLH and MYB domain proteins: species-specific regulatory differences are caused by divergent evolution of target anthocyanin genes[J]. Plant Journal, 1998, 13(4): 475-488.
Yamagishi M. Oriental hybrid lily Sorbonne homologue of LhMYB12 regulates anthocyanin biosynthesis in flower tepals and tepal spots[J]. Molecular Breeding, 2011, 28(3): 381-389.
Liu X F, Yin X R, Allan A C, et al. The role of MrbHLH1 and MrMYB1 in regulating anthocyanin biosynthetic genes in tobacco and Chinese bayberry (Myrica rubra) during anthocyanin biosynthesis[J]. Plant Cell, Tissue and Organ Culture, 2013, 115(3): 285-298.
Niu S S, Xu C J, Zhang W S, et al. Coordinated regulation of anthocyanin biosynthesis in Chinese bayberry (Myrica rubra) fruit by a R2R3 MYB transcription factor[J]. Planta, 2010, 231(4): 887-899.
Takos A M, Jaffe F W, Jacob S R, et al. Light-induced expression of a MYB gene regulates anthocyanin biosynthesis in red apples[J]. Plant Physiology, 2006, 142(3): 1216-1232.
牛铁泉, 董燕梅, 刘海霞, 等. 葡萄果实MYBA1与UFGT、DFR的作用机制[J]. 中国农业科学, 2018, 51(12): 2368-2377.
魏永赞, 胡福初, 郑雪文, 等. 光照对荔枝果实着色和花色素苷生物合成影响的分子机制研究[J]. 园艺学报, 2017, 44(07): 1363-1370.
责任编辑:崔丽虹

