水产品致敏蛋白的研究进展
方瑶雁,赵莘芷,徐大伦,杨文鸽
(宁波大学食品与药学学院,浙江省动物蛋白食品精深加工技术重点实验室,浙江宁波 315211)
食物过敏是机体暴露于某种食品后可重复发生的有害健康的特定免疫反应,其典型症状表现为皮肤、呼吸道和胃肠道的紊乱以及心血管异常,严重时可导致危及生命的低血容量性休克[1]。根据其免疫反应特点,食物过敏分为免疫球蛋白E(Immunoglobulin E, IgE)和非IgE 介导或这两种混合型,其中主要以IgE 介导的超敏反应为主,其发病机制如图1 所示,主要分为2 个阶段:在初始敏化阶段,食物中的致敏原被胃肠道消化吸收,经抗原递呈细胞摄取后呈递给T 细胞,激活后分化的Th2 型细胞产生白细胞介素IL-4、IL-13 等细胞因子,激活B 细胞分泌产生抗原特异性的IgE 抗体,并与肥大细胞上的高亲和力IgE 受体结合;在激发效应阶段,相同的抗原再次进入体内激活该反应,肥大细胞结合的IgE 被抗原交联,导致肥大细胞活化,并迅速释放各种新合成的介质,进一步诱发过敏炎症反应。IgE 介导的食物过敏反应程度可从轻微的局部症状到严重的全身性反应,临床表现为荨麻疹、呼吸困难、呕吐、腹痛、心血管衰竭等[2]。至今已经发现170 多种致敏食物,其中90%以上属于八大类食物,分别是牛奶、鸡蛋、鱼、甲壳类动物、花生、大豆、小麦和坚果[3]。食物过敏的发生率与年龄密切相关。大部分儿童随着年龄增长,出现对牛奶、大豆、鸡蛋以及小麦的耐受,但对水产品、花生、坚果等的过敏却持续存在[4]。导致机体发生过敏的抗原简称为致敏原,它们大多数是具有酸性等电点的糖蛋白,且分子量一般在10~80 kDa[5]。由于食物配料的多样化及组成的复杂性,加上食物生产、流通和消费模式的改变,使其更容易引起过敏反应,这给食品过敏的预防带来很大困难。对于食物过敏患者来说,避免进食相关的致敏原是预防过敏最安全有效的措施,但这使过敏患者不能随心享受各种食品,同时有可能造成营养成分失衡。因此,只有降低或消除致敏原的致敏性,才能有效防止食物过敏。
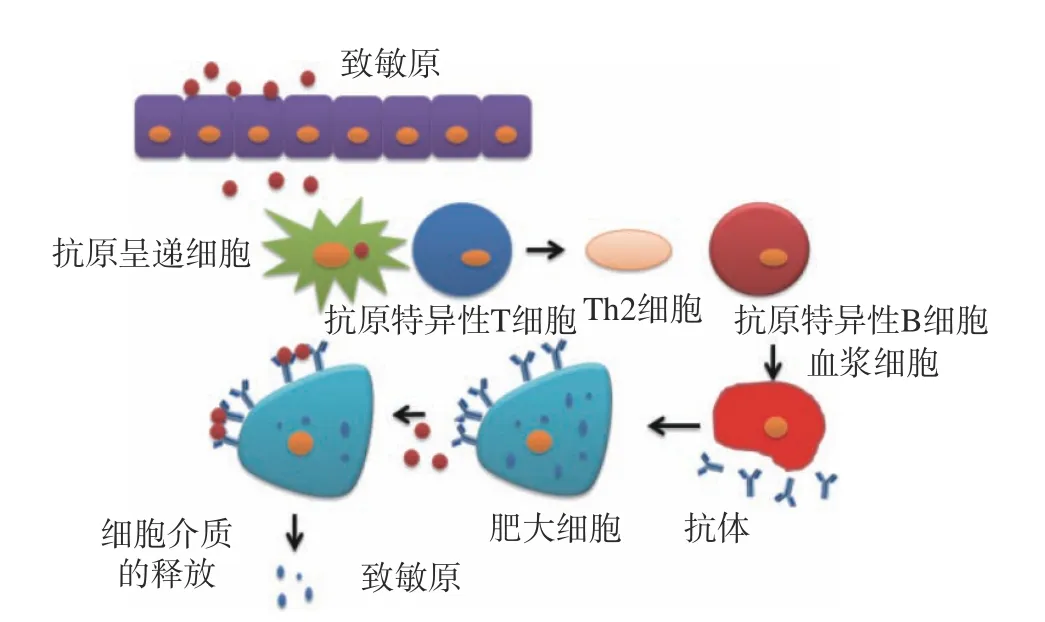
图1 IgE 介导的致敏蛋白免疫发病机制Fig.1 Immunopathogenesis of IgE-mediated sensitization protein
水产品营养丰富、味道鲜美,近年来消费人群不断壮大,因而由此产生的水产品过敏事件也逐渐增多,消减水产品的致敏性迫在眉睫。目前,许多水产品致敏原的结构特征已被确定,有关水产品致敏蛋白的鉴定、检测及其脱敏技术的研究报道也越来越多,这些工作对水产品过敏的预防和控制意义重大。鉴此,本文主要阐述了水产品致敏蛋白的主要种类、抗原表位、检测方法及其脱敏技术,旨在为深入研究水产品致敏原、开发低致敏或无致敏性水产品提供指导,最终保障水产品消费者的健康。
1 水产品致敏蛋白的主要种类
鱼类、甲壳类和软体动物是主要的水产品致敏类食品。水产品中的致敏蛋白,主要分为钙结合蛋白和原肌球蛋白两大类[6],此外还有精氨酸激酶、肌球蛋白轻链、血蓝蛋白、胶原蛋白、磷酸丙糖异构酶等其他类致敏蛋白[7]。
1.1 钙结合蛋白
钙结合蛋白(Calcium-binding proteins, CBP)具有典型的螺旋-环-螺旋结构域(EF hand domain,EF 手型结构域),该结构域是由氨基酸残基形成的钙结合循环和2 个相邻的α-螺旋组成的保守区域[8]。CBP 能在特定区域结合Ca2+,参与细胞间信号的运输,调节细胞内外Ca2+的浓度[9]。CBP 主要包括小清蛋白和肌质钙结合蛋白。
1.1.1 小清蛋白 小清蛋白(Parvalbumin, PV)是一种存在于鳕鱼、鲑鱼和鲤鱼等鱼类肌肉组织中的小型钙结合蛋白,是鱼类的主要致敏蛋白[10−11],最早由Aas 等[12]从鳕鱼中发现并取名为 Gad c 1。PV 的分子量通常为10~13 kDa,等电点介于4.1~5.2 之间[13],具有易溶于水、耐高温及不容易变性等特点。PV 包含三个典型的EF 手型结构域,它们对钙离子具有高亲和力,其中两个能够结合Ca2+,这使得PV 在调节肌肉的收缩和放松、钙缓冲和信号转导中起着非常重要的作用[14]。来自鳕鱼、鲑鱼和鲤鱼等的小清蛋白被证明是导致70%~100%的鱼类和鱼制品过敏反应的原因[15]。PV 有两种类型分别为:α-PV 和β-PV,但绝大多数的致敏性PV 属于β-PV,这种致敏蛋白在不同种类的鱼类中高度保守,并能导致过敏的交叉反应。有研究表明,某些PV 易受热变性,说明这些鱼的PV 可能具有构象表位,在热处理后会失去抗体反应活性[15]。Kubota 等[16]对太平洋鲭鱼的小清蛋白致敏性进行了研究,发现当鱼肉组织被加热到140 ℃时,小清蛋白的IgE 反应活性降低。近年来,学者也开始着手研究重组小清蛋白,如Sun 等[17]采用梯度硫酸铵分级法从日本牙鲆中提取了小清蛋白,然后通过克隆表达,在大肠杆菌中产生高度纯化的重组小清蛋白,为进一步分析小清蛋白的结构与致敏性的关系提供了重要的基础。
1.1.2 肌质钙结合蛋白 肌质钙结合蛋白(Sarcoplasmic calcium binding protein, SCP)存在于甲壳类动物肌浆蛋白中,是甲壳类动物的致敏蛋白之一。SCP 有四个EF 手型结构域(螺旋-环-螺旋),其中两个或三个EF 手型结构域分别包含一个Ca2+结合位点[18]。SCP的相对分子质量约为20 kDa,等电点为5.0。SCP 存在多态性,分别为:SCP-I、SCP-II 和SCP-III。Chen等[19]用柱层析法纯化小龙虾SCP,然后使用甲壳类过敏患者血清比较SCP 多态性,发现相较于SCP-I和SCP-III,SCP-II 具有较弱的IgE 结合活性。
1.2 原肌球蛋白
原肌球蛋白(Tropomyosin, TM)存在于无脊椎动物肌肉和非肌肉细胞中,是甲壳类动物的主要致敏蛋白,尤其是虾的主要热稳定性致敏原。TM 是由两个相同的α-螺旋结构相互交织形成的同型二聚体,主要功能是促进肌钙蛋白和肌动蛋白在横纹肌细胞中的相互作用,调节肌肉收缩[20]。TM 是相对分子质量约为34~38 kDa 的酸性糖蛋白,甲壳类动物TM的氨基酸序列同源性较高,相互之间具有很高的交叉反应[8]。有学者研究发现19 例患者中有10 例对鳕鱼和长鳍金枪鱼原肌球蛋白的具有IgE 反应[21]。近年来,国内外学者对TM 纯化方法进行了改进,减少了复杂、耗时的层析步骤。Chinnappan 等[22]利用硫酸铵沉淀法从黑虎对虾和牡蛎中纯化了原肌球蛋白;傅玲琳[23]等用硫酸铵沉淀、结合等电点、加热的方法纯化了南美白对虾原肌球蛋白,并用喹啉酸法测定其质量浓度最高可达43 μg/μL。
1.3 新型致敏蛋白
随着对水产品致敏性研究的不断深入,致敏蛋白的发现也越来越多。精氨酸激酶(Arginine kinase,AK)是无脊椎动物中一种重要的磷酸转移酶,能可逆催化精氨酸磷酸化反应,在ATP 的贮藏和利用、细胞能量代谢中发挥重要作用。AK 的结构主要由一个N 端的球形结构域和一个C 端结构域组成,且在2 个结构域中有2 个高度保守的环,N 端结构域全部由α-螺旋组成,而C 端结构域则是由7 个α-螺旋包绕8 个反平行的β-折叠组成。在虾、蟹、贝类等水产品中,AK 也是一种重要的蛋白过敏原,分子量约为40 kDa,等电点在6.0~6.5 之间[24−26]。研究发现AK的热稳定较差,热处理和酸碱处理均可降低AK 的致敏性[27]。由此可以认为,热加工可以降低水产品因精氨酸激酶所引起的致敏性。
肌球蛋白轻链(Myosin light chain, MLC)是组成肌球蛋白大分子复合物的一部分,也是一种较新型的过敏原,相对分子质量约为18~20 kDa[13]。MLC分为约18 kDa 的基本轻链(MLC1)和约20 kDa 的调节性轻链(MLC2),等电点约为4.67,含有两个Ca2+结合位点的结构域。Ayuso 等[28]从凡纳滨对虾中鉴定并克隆了MLC,并证实其具有致敏性,同时发现仅在煮熟的斑节对虾虾肉粗提物中检测到MLC2的IgE 结合活性,而加热后凡纳滨对虾MLC2 的IgE结合活性降低,认为不同种类的虾肉MLC2 的热稳定性存在差异。
血蓝蛋白(Hemocyanin)是甲壳类动物血淋巴中的一种氧转运蛋白,占血淋巴总蛋白含量的75%~95%[25]。在自然状态下,血蓝蛋白往往由单个亚基组成的六聚体或多聚体,分子量约为60~80 kDa,等电点为5.27,是一种具有IgE 结合活性的高分子量致敏蛋白。近年来在无脊椎动物中多有发现,如锯缘青蟹中分子量为14.3 kDa 的血蓝蛋白亚基和克氏原螯虾中分子量分别为68、72、76、82、84、88 kDa 等六聚体的血蓝蛋白,均可被甲壳类过敏患者血清特异性识别,并且是一类具有热稳定性的糖蛋白[29]。
胶原蛋白(Collagen)是一种含大量甘氨酸、脯氨酸和羟脯氨酸的纤维型蛋白质,分子量约300 kDa,难溶于水,在水中仅出现膨胀状态,溶于稀酸。胶原蛋白具有三股螺旋结构,这种独特的结构赋予胶原蛋白支持和保护的功能。根据结构的不同,胶原蛋白大约可以分成20 类,动物体内主要存在的I 型胶原蛋白是由2 条α1 亚基与1 条α2 亚基组成的三股螺旋结构[30]。Hamada 等[31]首次发现金枪鱼胶原蛋白具有免疫结合活性,提出鱼I 型胶原蛋白可能是一种新型过敏原,随后发现鲤鱼、日本鳗鲡、虹鳟鱼等胶原蛋白也具有致敏性,并认为日本50%左右的鱼过敏患者对I 型胶原蛋白过敏。目前对鱼胶原蛋白的研究主要集中在制备及其功能开发方面,其致敏性的研究相对较少。
磷酸丙糖异构酶(Triosephosphate isomerase,TIM)是糖酵解过程中的重要酶类,催化磷酸二羟丙酮和3-磷酸甘油醛之间的可逆转化。TIM 是由249个氨基酸组成、分子量约为28 kDa 的糖蛋白,主要以α-螺旋和不规则折叠为主,天然状态下以稳定的二聚体形式存在[8]。近年来,有研究发现鲭鱼、克氏原螯虾、拟穴青蟹等TIM 能够与血清IgE 结合,因此被认为是一种新型过敏原[32],并发现拟穴青蟹TIM不耐热、不耐酸碱,耐受胰蛋白酶消化但不耐受胃蛋白酶消化。
2 水产品致敏蛋白的抗原表位
过敏原的致敏性往往取决于它所包含的抗原表位。致敏蛋白的抗原表位通常由5~17 个氨基酸残基组成,氨基酸残基种类、数目及其构型决定了抗原的特异性。对致敏蛋白抗原表位的预测及定位,不但有助于进一步研究不同物种间抗原的交叉反应性,还对低过敏产品的开发和食品过敏的免疫诊断提供依据。目前,致敏蛋白抗原表位分析的主要方法有生物信息学预测、重叠肽库技术、对苯二酚交换质量串联分析、定点突变基因工程和噬菌体展示技术。
Elsayed 等[33]通过重叠肽库技术鉴定出鳕鱼小清蛋白的胰蛋白酶降解片段残基33~44、残基65~74 和残基88~96 具有免疫活性。Zhang 等[34]对西伯利亚淡水对虾原肌球蛋白(Exo m 1)的抗原结合表位进行了定位,发现Exo m1 的氨基酸序列与其它虾的原肌球蛋白具有高度的相似性,但不完全一致,它们分别是表位43~59、85~105、131~164、187~201和243~280。按与细胞结合类型,表位可分为B 细胞表位和T 细胞表位。按结构类型,表位可分为线性表位和构象表位。一般情况下,线性表位存在于T 细胞表位和部分B 细胞表位,构象表位仅存在于B 细胞表位[8]。基于重叠肽库技术,表位21~40 被鉴定为日本鲭小清蛋白Sco J 1 的主要线性表位区[35]。华希玮等[36]采用生物信息学预测法,对日本沼虾原肌球蛋白的表位进行预测,认为其可能的B 细胞线性表位有21~34 RADTLEQQNKEANN、37~52 EKTEEEIRTTQKKMQQ、71~77 LEEKEKA、99~107 LERSEERLN、119~125 AADESER、134~140 SLSDEER、158~164 ADRKYDE、177~186 ERAEERAETG、210~223 SEEKANQREEAYKE、262~268 NEKEKYK,可能的T 细胞表位有82~95 EGEVAALNRRIQLL、 105~117 RLNTATTKLAEAS、 165~177 VARKLAMVEADLE、195~208 EELRVVGNNLKSLE、222~235 EQIKTLTNKLKAA。抗原表位是抗原分子中决定其特异性的化学基团,是与人体产生的抗体发生特异性结合的免疫活性区。对抗原表位的系统认识是揭示致敏蛋白在水产品致敏反应中作用的关键,也是消除食品致敏性的结构基础。目前,对水产品致敏蛋白抗原表位的研究主要集中在常见的致敏原,对新型致敏原抗原表位的研究较少,关于构象表位的研究也大多局限于通过生物信息学软件的预测。
3 水产品致敏蛋白的检测方法
对水产品过敏患者来说,即使是摄入含微量致敏原的水产品,也往往会产生严重的过敏反应。为保障过敏患者的健康,已有许多国家强制性要求对食物标签中的致敏原进行规范标识[37]。目前,国内外已经开发了多种水产品致敏原检测技术,虽然这些检测及量化致敏原的技术各有优缺点,但对规范标注食物致敏原标签、食物过敏风险评估及风险管理均具有十分重要的意义。因此,对水产品致敏原进行精准、高效的定量检测显得尤其重要。根据检测目标物的不同,可分为以致敏蛋白为基础的酶联免疫吸附法、质谱法、生物传感器法及以致敏蛋白DNA 为基础的聚合酶链式反应(polymerase chain reaction,PCR)。
3.1 酶联免疫吸附技术
酶联免疫吸附法(enzyme-linked immunosorbent assay, ELISA)是检测食品致敏原的金标准,也是应用最广泛的定量分析方法。它具有操作简便、灵敏度高、标准化及自动化高等特点,适用于一种或多种致敏原的检测,主要包括竞争ELISA 法和夹心ELISA法。如Cai 等[38]使用单克隆抗体(B2-E1)与银鲤鱼过敏原小清蛋白竞争,该竞争ELISA 法对小清蛋白的检测限为0.04 mg /kg;Zhang 等[39]采用特异性单克隆抗体CE7B2,建立夹心ELISA 法测定日本对虾过敏原原肌球蛋白,检测限达0.09 ng/mL;Yu 等[40]利用夹心ELISA 法对两种来自不同物种的原肌球蛋白特异性多克隆抗体进行配对,检测限为 6.8 ng/ mL,可有效检测可疑食物来源中的原肌球蛋白。目前,市场上已有检测小清蛋白和甲壳类蛋白的ELISA 试剂盒,其检出限分别为1 mg /kg 和2 mg /kg,这些试剂盒可以在30 min 内实现定性或半定量检测。ELISA检测也存在一些缺陷,如加热、加压等食品加工处理会影响致敏蛋白抗原表位的结构,从而导致抗体结合位点的转移或减少,此外特异性抗血清、特异性单克隆抗体较难获得,一定程度上也限制了ELISA 在检测致敏蛋白中的应用。
3.2 质谱法
近年来,质谱技术在蛋白质组学领域取得了重大的飞跃,包括食品致敏原的鉴定、表征和测定,特别是液相色谱-质谱联用技术(LC-MS)已被用于食品致敏原的定量分析,其主要流程是从食品中提取的致敏蛋白经还原、烷基化、酶解成多肽,然后通过液相色谱分离以及质谱鉴定,最后定量分析其蛋白表位构象[41]。Korte 等[42]建立了多反应监测的质谱分析方法,用于检测复杂食物基质中虾和龙虾的致敏蛋白,检测限可降至0.1%;Stella 等[43]通过液相色谱-高分辨率串联质谱从四种致敏原中选择标记肽,建立了一种能够同时检测牛奶、鸡蛋、甲壳类动物和大豆致敏蛋白的定量方法;Sun 等[44]开发了一种用液相色谱-串联质谱联用多反应监测定量食物基质中鱼类主要致敏原小清蛋白的方法,其中比目鱼的β-小清蛋白的检测限达到0.10 mg/g,这种基于蛋白质组学的高精密度检测方法,对食品中小清蛋白含量的测定提供了技术支持。LC-MS 法具有特异性强、灵敏度高、高通量等优点,特别适用于加工过程中对构象蛋白表位不敏感的水产品过敏原的定量。但与免疫分析法和基于核酸检测的方法相比,LC-MS 法成本更高、耗时更长、技术更复杂。
3.3 生物传感器技术
生物传感器是快速检测水产品致敏原的新型方法之一,它利用固定在芯片表面的传感器,将致敏蛋白与分子识别元件之间的特异性反应转化为与致敏蛋白浓度成正比的可测量的光、电信号。分子识别元件可以是蛋白、细胞、DNA 等生物大分子。Chinnappan 等[22]开发的用于检测虾主要致敏原原肌球蛋白的适配体生物传感器,检测限为2 nmol/L;Wang 等[45]研制了一种基于纳米金聚合物手性组装的贝类原肌球蛋白检测及定量的生物传感器,检测限为21 pg/mL,定量限为70 pg/mL;Zhou 等[46]通过表面等离子体共振传感器与金纹生物芯片,检测和定量贝类中的原肌球蛋白,其检测限和定量限分别为1.0、2.5 mg/mL。生物传感器检测法具有微型化、高灵敏度、低成本、自动化程度高等优点,但对样品预处理的要求很高,一定程度上限制了它的广泛应用。
3.4 实时荧光定量PCR
PCR 技术可对食品中经基因修饰的成分进行检测,即利用已知致敏蛋白的基因序列对致敏原进行检测。目前水产品致敏蛋白检测中应用较多的是实时荧光定量PCR,通过实时监测目标蛋白特异性核酸片段扩增过程中产生的荧光信号的积累情况,对目标蛋白进行分析,荧光的产生主要依靠核酸结合染料或荧光探针。Fernandes 等[47]开发了一种实时PCR 定量方法检测调味酱中甲壳类动物的潜在致敏原,该方法在0.0001%~50%的范围内表现出了高性能的定量分析,并通过校准曲线参数得到了有效的盲混合验证。Fernandes 等[48]又设计出了两种实时PCR 用于检测调味酱中鱼类致敏成分,一种基于EvaGreen染料,一种基于TaqMan 探针,两种方法都具有较强的灵敏性,能使鱼的DNA 检测限达到0.01 pg,且基于TaqMan 探针比基于EvaGreen 染料的相对灵敏度高,范围广。Eischeid 等[49]建立了一种实时PCR分别检测猪肉饺子、通心粉、沙拉中的蟹类过敏原,该方法利用了群特异性引物和探针对多种蟹类进行了检测,其检测范围在0.1~105 ppm 之间。与传统的PCR 技术相比,实时荧光定量PCR 具有高灵敏度、检测快速、特异性强等优点,同时可用于复杂食品基质中致敏原的检测。但于其它检测方法相比,由于PCR 不是对致敏原进行直接检测,所以检测结果并不能评价食物真正的致敏性。
总体来说,由于食品成分复杂、多样,又要克服致敏原检测预处理繁琐、样品中被测物含量低等问题,未来水产品致敏蛋白的检测将会朝着样品用量少、分离效率高、分析速度快、经济、高灵敏、环保的方向发展,以期实现水产食品中潜在微量致敏原的检测。
4 水产品致敏蛋白的消减技术
虽然大多数过敏原及其抗原决定簇在一定程度上可以耐受各种形式的食品加工方法,但许多研究表明,特定的处理和加工仍然会影响水产品致敏蛋白的活性。这些特定的方法包括物理(热处理、辐照、超高压)、化学(糖基化修饰)、生物(酶解)等方法,它们主要通过引起蛋白质大分子的空间结构和理化性质的改变,破坏、掩盖和修饰蛋白质的致敏表位,导致蛋白变性、聚集或凝胶化,从而影响其致敏性。
4.1 物理法
通过物理方法如热、电、磁和机械能来加工食品,能在一定程度上改变致敏性蛋白质的高级结构,从而影响食品的致敏性,该类方法具有作用时间短、毒副作用小等优点,常见的方法包括热处理、辐照、超高压等。
4.1.1 热处理 热处理是食品加工中常见的方式,一般来说,其模式有湿热(煮沸、高压蒸汽)和干热(微波、超声波)两种。热处理可以破坏蛋白质的三维结构,降低致敏蛋白与人IgE 的结合活性,从而降低或消除其致敏性。Ozawa 等[50]对虾仁块进行121 °C,20 min 煮沸处理,发现虾原肌球蛋白免疫活性降低。但值得注意的是,热处理也可能使致敏蛋白产生新的表位或使掩藏的表位暴露,从而使致敏蛋白的致敏性增加。如Fang 等[51]对牡蛎主要过敏原Cra g1(原肌球蛋白)进行了煮沸和焙烤(180 °C)处理,发现加热后的Cra g1 比不加热的会产生更高的IgE 反应活性,原因可能是加热导致蛋白聚合物生成和变性。Kamath 等[52]研究了加热对贝壳原肌球蛋白的影响,发现热处理后 IgE 结合能力增加,致敏性增强。可见,热处理对致敏原的免疫活性影响不同,这主要与热处理的时间、温度、加热方式、致敏原种类有关。此外,许多致敏原都有很强的耐热性,热处理对这些热稳定性强的致敏原的免疫原性影响不显著,而且长时间的加热还会对食物品质造成不利的影响。
4.1.2 辐照 食品辐照技术是利用电离辐射源60Co或137Cs 产生的g-射线、机械源产生的X 射线或电子束对食品进行电离辐射的过程[53]。辐照对蛋白质会产生复杂的作用,主要通过诱导蛋白分子间脱氨、脱羧、氨基酸氧化、断裂或二硫键形成,以及蛋白质分子中肽链的降解或交联来改变蛋白质分子的高级结构及其聚集方式[54],从而影响致敏蛋白的致敏性。Muanghorn 等[55]以60Co为辐照源,对罗氏沼虾进行处理,发现在10 kGy 和15 kGy 辐照剂量下,原肌球蛋白条带密度明显降低;官爱艳等[56]采用电子束辐照处理中华管鞭虾虾仁及提取的原肌球蛋白,发现辐照处理能引起原肌球蛋白分子中的α-螺旋含量降低,改变原肌球蛋白构象,从而降低虾仁及原肌球蛋白的免疫原性;Li 等[57]研究发现电子束辐照能引发鱼类小清蛋白羰基化,降低大菱鲆鱼肉的致敏性,且在10 kGy 与人血清的IgE 结合特性下降最明显。较高的辐照剂量在降低过敏原致敏性的同时也会对食品的品质造成一定程度的破坏,也有研究者采用辐照协同加热处理法,如牟慧[58]采用蛋白免疫印迹和间接ELISA 法,通过探究原肌球蛋白表位,发现辐照与加热协同作用时,脱敏效果较单独辐照或加热处理更明显,达到了可以利用较低辐照剂量消减食品致敏性的效果。因此,在保持食品品质的同时,通过合适的辐照剂量改变致敏蛋白的分子构象,破坏其免疫原性和致敏性,从而降低食品致敏性。
4.1.3 超高压 超高压又称高静压,一般介质为水或油脂,通过室温在一定时间内对密封在容器中的样品持续施加100~1000 MPa 的压力[59]。作为一种非热加工技术,超高压被认为是一种新的脱敏处理方法。Jin 等[60]发现在200~600 MPa 超高压的作用下,新鲜鱿鱼原肌球蛋白的α-螺旋含量降低,600 MPa 时约有53%的α-螺旋转变为β-转角和无规卷曲,同时结合体外消化,发现600 MPa 和400 MPa 组鱿鱼原肌球蛋白的致敏性比200 MPa 组低,原因在于超高压导致致敏蛋白化学键断裂,抗原表位被破坏;柳澜昱[61]用超高压处理南美白对虾虾仁,通过测定虾仁蛋白溶出量和过敏原消减程度,发现压力低于300 MPa时虾仁致敏性的消减主要与其蛋白溶出相关,而高于300 MPa 时致敏性的消减则与致敏蛋白变性有关。可见,超高压可以通过破坏蛋白质的化学键,改变蛋白质的空间结构,导致致敏蛋白变性或失活,同时还能影响蛋白质的溶出,最终达到消减食品致敏性的效果。但由于超高压设备的限制,利用超高压消减食品过敏原及其致敏性仍难以实现产业化应用。
4.2 化学法
通过化学手段影响蛋白质分子中的酰胺键、氨基、羧基、羟基、巯基等基团,能够改变蛋白质的静电荷、疏水基团及其空间结构,从而影响致敏蛋白的致敏性,其中糖基化修饰(包括美拉德反应)是常见的消减致敏性的一种化学法。如蔺海鑫等[62]发现当与核糖的糖基化反应达到4 h 后,能够有效改变菲律宾蛤仔原肌球蛋白的结构,从而降低其免疫活性;Zhao 等[63]研究了美拉德反应对鱼主要过敏原小清蛋白结构和免疫特性的影响,采用重组银鲤的小清蛋白,用葡萄糖在60 °C 下培养72 h,发现重组银鲤小清蛋白的IgG和IgE 结合特性均减弱;Song 等[64]研究了美拉德反应对虾原肌球蛋白构象及与IgE 结合能力的影响,认为丙二醛诱导的原肌球蛋白构象变化可显著影响原肌球蛋白的致敏性。糖基化消减致敏性的程度主要取决于过敏原和所用还原糖的种类,另外许多致敏蛋白属于分子量为10~80 kDa 的糖蛋白,其糖基结构在抗原决定簇的形成中起着重要作用[8],因此通过降低致敏蛋白分子中糖链的数量、改造糖链的结构等也是减少糖蛋白免疫原性的一个手段,有关这方面的研究仍需进一步深入。
4.3 生物法
随着近几年食品生物技术的发展,越来越多的生物技术也用于食物致敏蛋白的消减。酶解法是一种应用广泛的降低水产品致敏性的生物变性方法,尤其对致敏蛋白线性表位的消除有着很大的作用。酶解可以通过改变致敏原表位的三级结构,或通过断裂酰胺键,破坏致敏蛋白的空间结构和构象,从而降低致敏蛋白的免疫活性。酶解通常在中性pH 和40~60°C 条件下进行,相对于酸碱水解,酶解反应较温和,还可以对作用位点进行定向选择。如张弛[65]用碱性蛋白酶、胃蛋白酶等7 种酶水解虾过敏原,结果表明碱性蛋白酶处理对虾过敏原致敏性的降低最为显著;Zhang 等[66]通过酸和蛋白酶处理,分析对重组牡蛎原肌球蛋白(Cra g1)构象和IgE 结合能力的影响,也发现酸和酶结合处理能更有效降低原肌球蛋白的致敏性。虽然有大量研究证明酶解可降低致敏性,但酶处理对食品品质影响较大,同时大多会产生苦味肽而不利于食品的风味。因此,选择合适的酶以及酶解条件,对开发低致敏性水产品十分重要。
5 总结与展望
随着水产品消费人群的增加和对过敏性疾病的重视,水产品过敏原的研究越来越深入,但仍存在较多的问题,还需要进一步研究和应用。目前,有关水产品过敏原的致敏性还没有标准的评价体系,现有技术虽然可应用于评估水产品过敏原的致敏性,但仍有一些劣势,未来可以正确应用动物模型,结合其他评价方法,有效地检测和评价水产品的致敏性。对于水产品过敏的免疫发病机制,从细胞和分子水平上阐明基因和环境因素如何改变正常的口服耐受过程,从而产生水产品特异性Th2 反应,这方面的研究还需要进一步深入。此外,尽管目前有多种方法用于消减过敏原的致敏性,但在实际应用中仍有一定的局限性,一方面水产品加工对其过敏原的影响具有不确定性,不易测量和控制,消减食品过敏原致敏性仍主要停留在研究阶段,实际生产中由于对食品感官、营养及其加工品质等的影响较大而限制了化学法及生物法消减食品过敏原的应用;由于超高压和辐照设备的限制,这些物理法消减食品过敏原及其致敏性仍未实现产业化应用。如何结合多种加工手段达到消除过敏原,同时又能最大限度保留水产品的风味和营养品质等问题将是未来全面了解水产品过敏原以及开发高质量低致敏性水产品的热门研究方向。

