香菇多糖生物合成代谢相关酶的研究
刘晓翠,田 瑾,周芷苒,王晓敏
(西华大学食品与生物工程学院,四川 成都 6 100039)
香菇,一种药食同源的真菌[1]。现代研究表明香菇中含有多种活性成分,能提高人体免疫力、防癌抗癌、降血压及降血脂等[2]。香菇多糖是香菇主要的活性成分之一[3],其主要成分是葡聚糖,还含有少量的甘露糖、岩藻糖、木糖等[4]。香菇多糖生物活性多样,对于提高机体免疫力、抗肿瘤、抗感染、抗衰老等都能起到良好的作用[5−6]。在医药领域,香菇多糖制成的免疫调节剂和其他抗肿瘤药物相比,毒性小、选择性好、可作用于某一特定免疫环节,可开发成香菇多糖注射液、香菇多糖胶囊用于治疗疾病[7]。它作为免疫辅助能与化疗药剂联用,来减轻药物毒性,增加治疗效果[8]。
现在关于微生物多糖合成代谢的研究较少,大多集中于多糖结构、活性药理及生产等方面。由于香菇属真菌遗传物质的复杂性,有关在酶和基因水平上研究调控多糖生物合成代谢对多糖含量的影响的相关研究尚未见报道。有研究[9−10]表明,不同微生物细胞体系中活性多糖的合成代谢基本途径是相似的。虽然不同多糖在结构上各有差异,但大都是由常见的单糖重复单元组成,表明真菌多糖的生物合成途径,特别是前体物合成途径基本相同[11]。另外有研究[12−14]表明,多糖合成核苷酸糖的最基本的合成途径为:当碳源为葡萄糖时,在葡萄糖激酶的作用下葡萄糖转化为葡萄糖-6-磷酸,然后在α-磷酸葡糖变位酶的作用下转化为葡萄糖-1-磷酸,再合成 UDP-葡萄糖、UDP-葡糖醛酸、UDP-半乳糖和dDTP-鼠李糖等,发酵培养基中碳源种类不同和产生的多糖组成不同,所涉及的合成关键酶也有所不同,但主要包括葡萄糖激酶、α-磷酸葡糖变位酶、UDP-葡萄糖焦磷酸化酶、UDP-半乳糖-4 差向异构酶、磷酸葡糖异构酶。目前,关于控制香菇多糖生物合成代谢相关酶的研究较少,更未见其关键控制酶的报道。
本文以液体深层发酵香菇菌丝体,在不同的发酵条件下综合分析多糖合成各相关酶的活性与香菇多糖含量的相关性,确定胞内多糖合成的关键酶,为今后进一步对该关键酶的特性、表达调控及其与香菇多糖合成的分子机制研究奠定基础,也将为香菇多糖含量的提高提供生物技术新途径,为香菇及其高附加值加工产品的开发生产奠定基础。
1 材料与方法
1.1 材料与仪器
液体种子培养基:马铃薯20%,葡萄糖2%,KH2PO40.1%,MgSO4·7H2O 0.1%,VB10.01%,pH自然[15]。
发酵基础培养基:葡萄糖4%,蛋白胨1%,磷酸二氢钾0.05%,硫酸镁0.05%(都是质量分数)。
细胞提取缓冲溶液(20 mmol/L 的磷酸钾盐缓冲溶液):50 mmol/L NaCl、10 mmol/L MgCl2和1 mmol/L 二硫苏糖醇,pH 6.5[16]。主要试剂见表1,主要设备见表2。

表1 主要试剂一览表
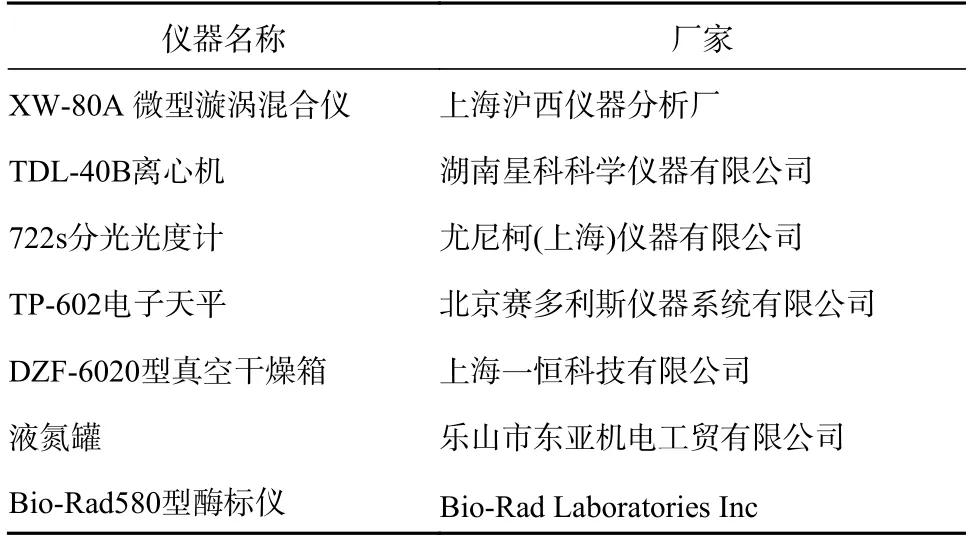
表2 主要设备一览表
1.2 实验方法
1.2.1 多糖的提取及测定
1.2.1.1 菌丝体培养
菌株活化流程参考刘晓翠等[17]的方法,如图1所示。

图1 菌种活化流程图
种子液培养流程参考乜娟娟[18]的方法,如图2所示。

图2 种子液培养流程图
基础液培养流程如图3 所示。

图3 基础液培养流程图
1.2.1.2 粗多糖提取
分别取液体深层发酵所生产的香菇菌丝体粉末等量,放入样品瓶中,加入20 倍的水,混匀,80℃热水浴提取2 h。布氏漏斗抽滤,取滤液,滤渣反复提取2 次,合并滤液,60 ℃减压浓缩后加4 倍体积的95%乙醇4 ℃沉淀过夜;4 000 r·min−1离心10 min 后,收集沉淀[19]。冷冻干燥,得香菇多糖。
1.2.1.3 多糖含量测定
采用苯酚-硫酸法测定多糖含量,浓硫酸与多糖反应释放出单糖,单糖再脱水成糠醛或羟甲基糠醛,糠醛衍生物能与苯酚合成橙黄色化合物,并能使用分光光度计进行测定,此橙黄色化合物在490 nm 处有最大吸收峰[20]。
标准曲线绘制:精密量取已恒重的无水葡萄糖,配置成1 mg·mL−1的葡萄糖标准液,再分别量取葡萄糖标准液0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9 mL 加入试管中,试管中不足1 mL 的补加蒸馏水到1 mL,各试管中分别添加1 mL 6%苯酚溶液,混和均匀后迅速加入5.0 mL 浓硫酸摇匀,静置10 min,在沸水浴中加热显色15 min,取出自然冷却至室温,用紫外分光光度计在490 nm 处测定其吸光值,横坐标为葡萄糖质量浓度(mg/mL),纵坐标为测定出的吸光值(OD 值),绘制成标准曲线,经回归处理得出线性回归方程[21]。
样品中总糖含量测定:样品 → 精确称取 → 配成浓度为0.1 mg·mL−1溶液 → 分光光度计在490 nm 测定样品吸光度OD 值 → 根据标准曲线计算其总糖含量。
1.2.2 酶的提取
取发酵菌液,过滤(或者4 ℃,2 500 r·min−1离心5 min),菌体用预冷的细胞提取缓冲溶液洗涤过滤2 次,置于预冷的研钵中,液氮研磨3 次,用1.5 mL 离心管称取菌体,每100 mg 菌体粉加入1 mL细胞提取液,涡旋震荡120 s 后,4 ℃,10 000 r·min−1,离心10 min,上清液为细胞提取物,取30 μL 测相关酶的活性,空白为煮沸的上清液。蛋白浓度采用考马斯亮蓝法测定[22]。
1.2.3 酶活性的检测
酶活力定义即1 mg 蛋白中的酶在1 min 内转化成1 nmol NAD(P)H 为一个单位,故将酶活力单位定为nmol NAD(P)H/(mg protein)/min。而NADP的变化可在340 nm(ε340=6.22 M−1cm−1)波长处测定其吸光度的改变来反映[23]。反应温度为30 ℃,总反应体系为 250 μL,酶提取物添加量30 μL。酶活计算公式为:

式中:A1为吸光度起始读数;A2为吸光度终读数;V1为反应液总体积(mL);V2为加入样品体积(mL);m为样品稀释倍数;t为反应时间(min);ρ为样品蛋白质质量浓度(mg/mL);6.22 为NADPH 摩尔吸光系数。
具体相关酶的测定方法如下:
1)葡萄糖激酶(GK):100 mmol/L Tris-HCl(pH 7.5)缓冲液,0.2 mmol/L NADP+,5 mmol/L ATP,5 mmol/L MgCl2,0.2 U 葡萄糖-6-磷酸脱氢酶。该反应通过最后添加酶提取液开始;
2)磷酸葡萄糖变位酶(PGM):50 mmol/L 三乙醇胺缓冲液(pH 7.2),5 mmol/L MgCl2,0.4 mmol/L NADP+,50 μmol/L 葡萄糖-1,6-二磷酸,4 U 葡萄糖-6-磷酸脱氢酶,1.4 mmol/L D-葡萄糖-1-磷酸二钠盐,酶提取液。该反应通过最后添加D-葡萄糖-1-磷酸二钠盐开始;
3)UDP-磷酸葡萄糖焦磷酸化酶(UGP):50 mmol/L Tris-HCl(pH 7.8)缓冲液,14 mmol/L MgCl2,0.3 mmol/L NADP+,0.1 mmol/L UDP-葡萄糖,2.1 U 磷酸葡萄糖变位酶,4 U 葡萄糖-6-磷酸脱氢酶,4 mmol/L 无机焦磷酸,酶提取液。该反应通过最后添加无机焦磷酸盐开始;
4)磷酸葡萄糖异构酶(PGI):50 mmol/L 磷酸钾缓冲(pH 6.8),5 mmol/L MgCl2,0.4 mmol/L NADP+,4 U 葡萄糖-6-磷酸脱氢酶,5 mmol/L D-果糖-6-磷酸,酶提取液。该反应以添加D-果糖-6-磷酸开始;
5)UDP-葡萄糖脱氢酶(UGD):100 mmol/L Tris-HCl(pH 7.5)缓冲液,1 mmol/L MgCl2,1 mmol/L NADP+,5 mmol/L UDP-葡萄糖,1 mmol/L二硫苏糖醇。该反应通过最后添加酶提取液开始。
1.2.4 单因素实验
1)不同碳源种类下酶活性及多糖含量检测。在基础培养基的基础上,分别改用蔗糖、淀粉、乳糖和白砂糖代替葡萄糖作为不同的碳源,其他成分及含量保持不变。250 mL 的三角瓶中配置培养基100 mL,灭菌,接种后置于150 r·min−1的恒温摇床中25 ℃培养5 d。考察不同碳源种类对香菇菌丝体多糖含量及与多糖合成相关的5 种酶活性的影响。
2)不同氮源种类下酶活性及多糖含量检测。在基础培养基的基础上,分别改用酵母浸粉、尿素、牛肉膏和NaNO3代替蛋白胨作为不同的氮源,其他成分及含量保持不变。250 mL 的三角瓶中配置培养基100 mL,灭菌,接种后置于150 r·min−1的恒温摇床中25 ℃培养5 d。考察不同氮源种类对香菇菌丝体多糖含量及与多糖合成相关的5 种酶活性的影响。
3)不同pH 值下酶活性及多糖含量检测。在5 个250 mL 三角瓶中各配置100 mL 基础培养基,用pH 计和1%氢氧化钠溶液将各培养基的pH 值分别调节为5.0、5.5、6.0、6.5、7.0,其他成分及含量保持不变。灭菌,接种后置于150 r·min−1的恒温摇床中25 ℃培养5 d。考察不同初始pH 值对香菇菌丝体多糖含量及与多糖合成相关的5 种酶活性的影响。
4)不同温度下酶活性及多糖含量检测。在5 个250 mL 三角瓶中各配置100 mL 基础培养基,置于18、20、22、25、28 ℃下培养。灭菌,接种后置于150 r·min−1的恒温摇床中发酵5 d,测定香菇菌丝体多糖含量及多糖合成相关的5 种酶活性与不同培养温度的影响。
1.2.5 正交实验
在单因素实验的基础上进行正交实验,以确定香菇多糖量与多糖合成相关5 种酶活性的影响。正交实验因素与水平见表3。

表3 正交实验因素与水平
1.3 数据统计与分析
使用正交设计助手对正交试验进行设计,利用Excel 软件对数据进行计算整理,SPSS 软件对结果进行显著性的分析,Origin 软件绘图,“平均值±标准差”来表示试验结果数据。
2 结果与分析
2.1 单因素实验结果及分析
2.1.1 不同碳源培养条件下相关酶的活性及多糖含量结果分析
由图4 可知,以葡萄糖为碳源时,香菇多糖含量最多。且实验观察发现以葡萄糖为碳源时,香菇菌丝体生长量最多,菌丝浓密,颜色呈乳白色,菌丝质量相较于其他4 种碳源的培养基更好,这可能是葡萄糖比其他4 种碳源更易被香菇菌丝体吸收利用,更适合生长繁殖,其次是可溶性淀粉和蔗糖作为碳源时,香菇多糖含量和香菇菌丝体生长量较多。王琼[24]在研究中发现使用高浓度葡萄糖(大于20 g/L)能促进灵芝M 型球菌的形成,并且多糖的产量达到2 g/L。

图4 不同碳源条件下生成多糖的质量浓度
由图5 发现,显示5 种酶在不同碳源发酵条件下的活性差异显著,总的来说,GK 的相对活性最高,与其他4 种酶活性相差极显著,PGM 活性次之,UGP、PGM 和 PGI 的活性较低。结合两图发现,GK 活性越高,其余4 种酶活性越低,GK 活性与其他4 种酶活性相差越大,多糖含量越高。依据香菇多糖含量以及菌丝体生长量的多少,选择葡萄糖、可溶性淀粉、蔗糖这3 原料作为正交实验验碳源的3 个水平。

图5 不同碳源条件下5 种酶的酶活力
2.1.2 不同氮源培养条件下相关酶的活性及多糖含量结果分析
实验过程中,添加无机氮源尿素和NaNO3代替蛋白胨发现香菇菌丝体不能生长,说明无机氮源不能被香菇菌丝体利用,不能作为其氮源的来源。
由表4 可知,以牛肉膏为氮源时,香菇多糖含量最多。且实验观察发现以牛肉膏为氮源时,香菇菌丝体生长量最多,菌丝浓密,颜色呈淡黄色,菌丝质量相较于其他氮源的培养基更好。以蛋白胨作为氮源时,香菇多糖含量和香菇菌丝体生长量较多。以酵母浸粉为氮源时,香菇多糖含量和香菇菌丝体生长量最少。

表4 不同氮源条件下生成多糖的质量浓度
由图6 可知,显示5 种酶在不同氮源发酵条件下的活性差异显著,总的来说,GK 的相对活性最高,与其他4 种酶活性相差极显著,PGM 次之,UGP、PGM 和 PGI 活性较低,5 种酶的活性大致随多糖含量的增加而升高。结合图表发现,GK 活性越高,GK 活性与其他4 种酶活性相差越大,多糖含量越高。冀英萍[25]研究发现蛹虫草菌多糖的最佳氮源发酵条件是4%的牛肉膏,其蛹虫草菌多糖含量和PGM 的总活力都有提高。
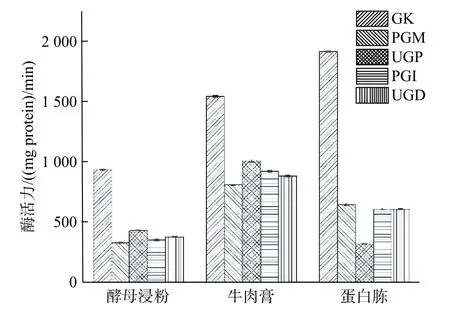
图6 不同氮源条件下5 种酶的酶活力
2.1.3 不同初始pH 值培养条件下相关酶的活性及多糖质量浓度结果分析
由图7 可知,pH 为5 和5.5 时,多糖质量浓度相差不大;当pH 为6 时,多糖质量浓度最低;当pH 为6.5 时,GK 相对活性比pH 为6 时的GK 活性高,香菇多糖质量浓度也比pH 为6 时高;当pH 为7 时,多糖质量浓度最高。王杰等[26]发现pH 在5.0~7.0 范围内,香菇菌丝体生物量和胞多糖质量浓度随着pH 值的升高而增加。
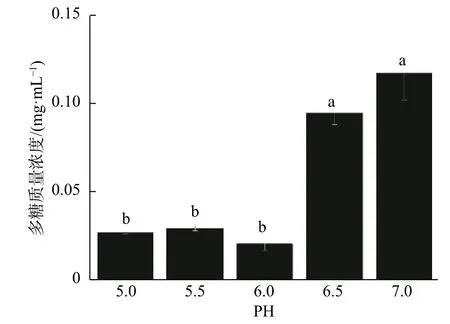
图7 不同pH 条件下生成的多糖质量浓度
由图8 发现,显示5 种酶在不同pH 发酵条件下的活性差异显著,总的来说,GK 的相对活性最高,与其他4 种酶活性相差极显著,PGM 活性次之,UGP、PGM 和 PGI 活性较低。结合两图发现,GK 活性越高,GK 活性与其他4 种酶活性相差越大,多糖质量浓度越高。当pH 为6.5 时,GK 相对活性比pH 为6 时的GK 活性高,香菇多糖质量浓度也比pH 为6 时高,但pH 为6 时的其他酶(PGM,UGP,PGI,UGD)相对活性比要比其余的pH 都要高。Lin 等[27]研究发现灵芝胞外多糖合成酶(PGM,PGI)在pH 值为6 时能保持较高的水平。
图8 不同pH 条件下5 种酶的酶活力
2.1.4 不同温度培养条件下相关酶的活性及多糖含量结果分析
由图9 发现,当温度为18、20、22 ℃时,多糖质量浓度呈增大趋势,但变化不大,香菇菌丝体生长量较多;当温度为25 ℃时,多糖质量浓度最高,香菇菌丝体生长量最多;温度为28 ℃时,多糖质量浓度最低,香菇菌丝体含量最少。
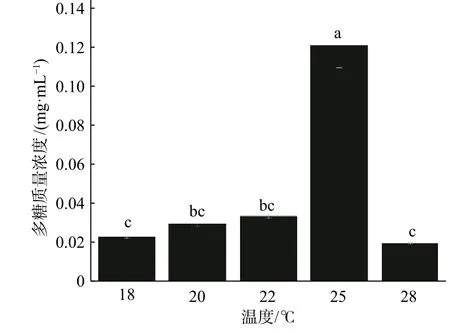
图9 不同温度条件下生成的多糖质量浓度
由图10 发现,5 种酶在不同温度发酵条件下的活性差异显著,总的来说,GK 的相对活性最高,与其他4 种酶活性相差极显著,PGM 活性次之,UGP、PGM 和 PGI 活性较低,5 种酶活性大致随多糖质量浓度增加而升高。结合2 图发现,GK 活性越高,GK 活性与其他4 种酶活性相差越大,多糖质量浓度越高。乔莲逵[28]研究发现随着温度的升高,灵芝胞外多糖各相关合成酶的比酶活呈先增大后减小的趋势。
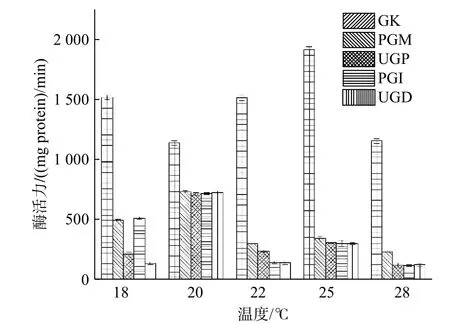
图10 不同温度条件下5 种酶的酶活力
2.2 正交实验数据分析
由表5 可知,4 个因素中对多糖含量具有显著影响的是碳源种类,因此在香菇菌丝体培养过程中要选取最佳碳源以提高多糖含量。根据表6 的直观分析,可以得出以多糖含量为指标时,影响香菇多糖含量的主次因素为A(碳源种类)>B(氮源种类)>D(温度)>C(pH),在最佳条件下进行验证实验,测得香菇多糖含量为0.1147 mg/mL,高于正交实验中的最大值。
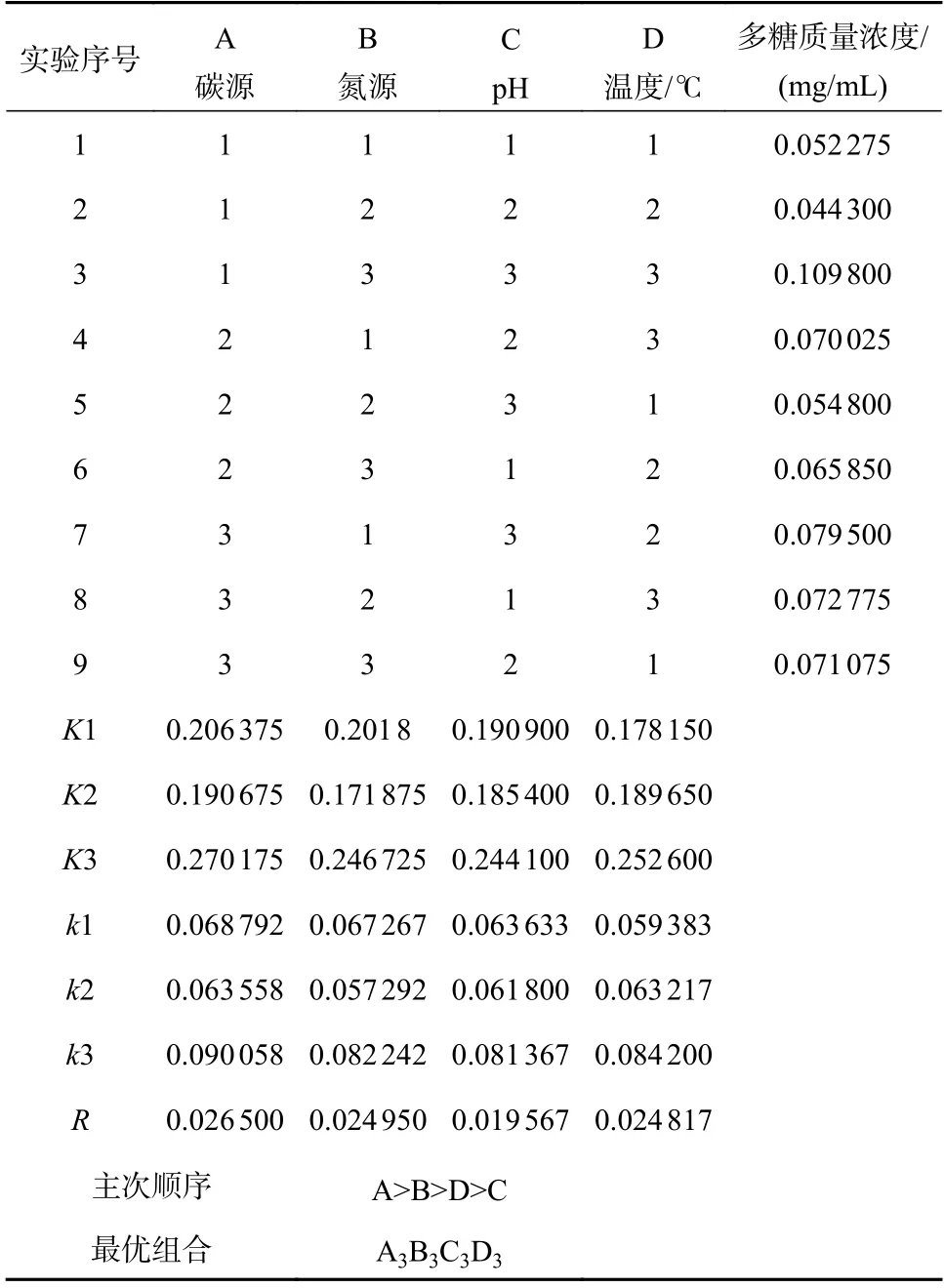
表5 正交实验分析表

表6 方差分析
3 结论
通过单因素实验,优化了碳源、氮源、pH、温度4 个条件,比较在不同发酵条件下得到的香菇多糖的质量浓度,最终得到的最佳液体发酵条件是最适发酵时间为5 d,最适碳源和氮源为40 g·L−1葡萄糖,10 g·L−1牛肉膏,最适pH 和培养温度为7 和25 ℃。同时分析了香菇多糖和合成相关的酶的活性之间的关系,发现在不同发酵条件下培养香菇菌丝体的胞内葡萄糖激酶(GK)、磷酸葡萄糖变位酶(PGM)、UDP 葡萄糖焦磷酸化酶(UGP)和磷酸葡萄糖异构酶(PGI)活性随着多糖含量的增加而升高,表明这5 种酶与香菇多糖的生物合成有关,其中GK 活性最高,PGM 活性次之,这2 种酶与香菇多糖的生物合成相关性最大,说明GK 和PGM 是控制香菇菌丝体多糖合成的关键酶。

