NaOH溶液沉淀及分步沉淀常见金属离子的实验探究
杜钦芝 陶佳 陈时洪 张明晓

摘要:应用自主研制的MXLab21先进数字化实验系统探究NaOH溶液滴定常见金属离子Fe3+、 Fe2+、 Mg2+、 Cu2+及Al3+的氢氧化物沉淀的pH曲线(pH-V关系曲线)。探究了单一金属离子氢氧化物沉淀的pH曲线,对实验所得的沉淀pH范围与理论计算结果进行比较,发现仅有Fe2+的实验结果与理论计算结果明显不同。探究Fe3+、 Fe2+与Mg2+两两混合和三种离子混合时的氢氧化物沉淀的pH曲线,发现其混合离子均能实现分步沉淀。分析各离子生成氢氧化物沉淀及分步沉淀时的pH范围、消耗NaOH溶液用量的异同,并对实验的异常现象进行解释。这些常见金属离子与NaOH溶液反应生成沉淀及分步沉淀的动态pH-V曲线,对中学化学教学具有一定的参考价值。
关键词:氢氧化钠溶液滴定; 分步沉淀金属离子; 数字化实验; 实验探究
文章编号:1005-6629(2021)08-0079-07
中图分类号:G633.8
文献标识码:B
1 问题的提出
1.1 高中化学教学中金属离子氢氧化物沉淀教学的重要性及存在的问题
沉淀溶解平衡在生产、科研和环保等领域具有广泛应用,是中学化学教学的重点,也是高考的重要考点。在众多的难溶电解质中,常见金属离子如Fe3+、 Fe2+、 Mg2+、 Cu2+及Al3+的氢氧化物是中学化学教学的重要知识点。pH将直接影响金属离子氢氧化物沉淀的生成与溶解,但目前教材中关于利用调节pH的方法分离或除去混合金属离子中某一种或几种金属离子还较少涉及,也几乎未设计相关实验来验证或探究金属离子生成氢氧化物沉淀过程中的pH变化情况。因此,建立常见金属离子用NaOH沉淀及分步沉淀的动态pH-V关系曲线,能很好解决上述教学的不足,帮助学生加深对金属离子氢氧化物沉淀这一知识点的理解。
1.2 金属离子沉淀pH曲线的数字化实验研究现状及其不足
自2003年钱扬义教授开拓了我国的化学数字化实验教学以来[1],经广大高校学者和中学一线教师的努力,化学数字化实验研究已取得较多成果,但关于pH对常见金属离子氢氧化物沉淀生成与溶解的影响规律及混合金属离子用NaOH分步沉淀的相关研究却很少。目前仅有钱扬义课题组[2]对单一Fe2+和Fe3+及其二者的混合离子与NaOH溶液反应的pH曲线进行了研究。而中学化学教学对常见金属离子氢氧化物沉淀的要求远超出Fe(OH)2和Fe(OH)3的范畴,因此,探究数字化实验在更多金属离子的氢氧化物沉淀体系中的应用具有重要的意义。
2 实验设计
2.1 实验原理
以Mn+指代金属离子,其难溶氢氧化物在水溶液中的沉淀溶解平衡可表示为:
沉淀溶解平衡对应的平衡常数称为溶度积常数(符号Ksp,简称溶度积),其等于Mn+和OH-的浓度幂的乘积,即
比较离子积(Q)与Ksp的大小,可判定沉淀的生成或溶解。利用Q=Ksp,代入Mn+的初始浓度和c(Mn+)=1.0×10-5mol/L,可分别计算出Mn+沉淀开始和沉淀完全时的pH范围,即沉淀的pH范围。
通過理论计算结合实验测定探讨Fe3+、 Fe2+、 Mg2+、 Cu2+、 Al3+用NaOH溶液沉淀及分步沉淀的现象,建立对应的沉淀pH曲线,为中学金属离子氢氧化物沉淀教学提供参考。
2.2 实验仪器及药品
2.2.1 自制的数字化实验系统
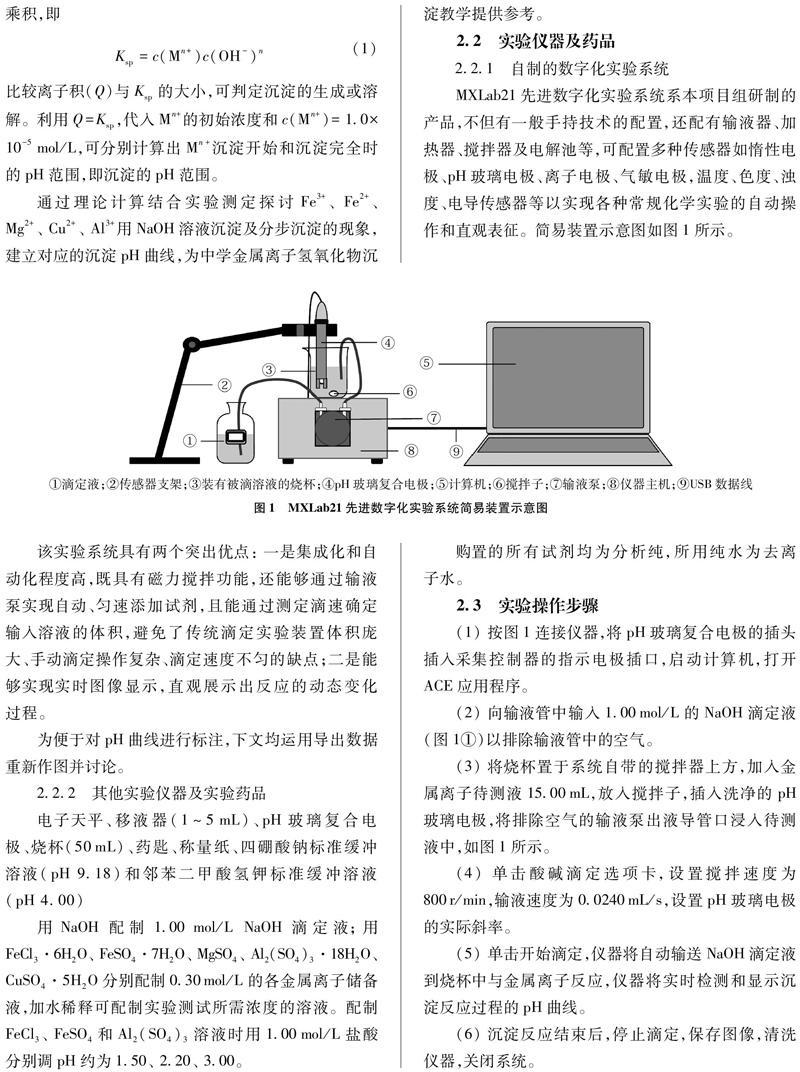
MXLab21先进数字化实验系统系本项目组研制的产品,不但有一般手持技术的配置,还配有输液器、加热器、搅拌器及电解池等,可配置多种传感器如惰性电极、pH玻璃电极、离子电极、气敏电极,温度、色度、浊度、电导传感器等以实现各种常规化学实验的自动操作和直观表征。简易装置示意图如图1所示。
该实验系统具有两个突出优点:一是集成化和自动化程度高,既具有磁力搅拌功能,还能够通过输液泵实现自动、匀速添加试剂,且能通过测定滴速确定输入溶液的体积,避免了传统滴定实验装置体积庞大、手动滴定操作复杂、滴定速度不匀的缺点;二是能够实现实时图像显示,直观展示出反应的动态变化过程。
为便于对pH曲线进行标注,下文均运用导出数据重新作图并讨论。
2.2.2 其他实验仪器及实验药品
电子天平、移液器(1~5mL)、pH玻璃复合电极、烧杯(50mL)、药匙、称量纸、四硼酸钠标准缓冲溶液(pH 9.18)和邻苯二甲酸氢钾标准缓冲溶液(pH 4.00)
用NaOH配制1.00mol/L NaOH滴定液;用FeCl3·6H2O、 FeSO4·7H2O、 MgSO4、 Al2(SO4)3·18H2O、 CuSO4·5H2O分别配制0.30mol/L的各金属离子储备液,加水稀释可配制实验测试所需浓度的溶液。配制FeCl3、 FeSO4和Al2(SO4)3溶液时用1.00mol/L盐酸分别调pH约为1.50、 2.20、 3.00。
购置的所有试剂均为分析纯,所用纯水为去离子水。
2.3 实验操作步骤
(1) 按图1连接仪器,将pH玻璃复合电极的插头插入采集控制器的指示电极插口,启动计算机,打开ACE应用程序。
(2) 向输液管中输入1.00mol/L的NaOH滴定液(图1①)以排除输液管中的空气。
(3) 将烧杯置于系统自带的搅拌器上方,加入金属离子待测液15.00mL,放入搅拌子,插入洗净的pH玻璃电极,将排除空气的输液泵出液导管口浸入待测液中,如图1所示。
(4) 单击酸碱滴定选项卡,设置搅拌速度为800r/min,输液速度为0.0240mL/s,设置pH玻璃电极的实际斜率。
(5) 单击开始滴定,仪器将自动输送NaOH滴定液到烧杯中与金属离子反应,仪器将实时检测和显示沉淀反应过程的pH曲线。
(6) 沉淀反应结束后,停止滴定,保存图像,清洗仪器,关闭系统。
3 实验结果及数据分析
3.1 金属离子溶液最佳反应浓度探究
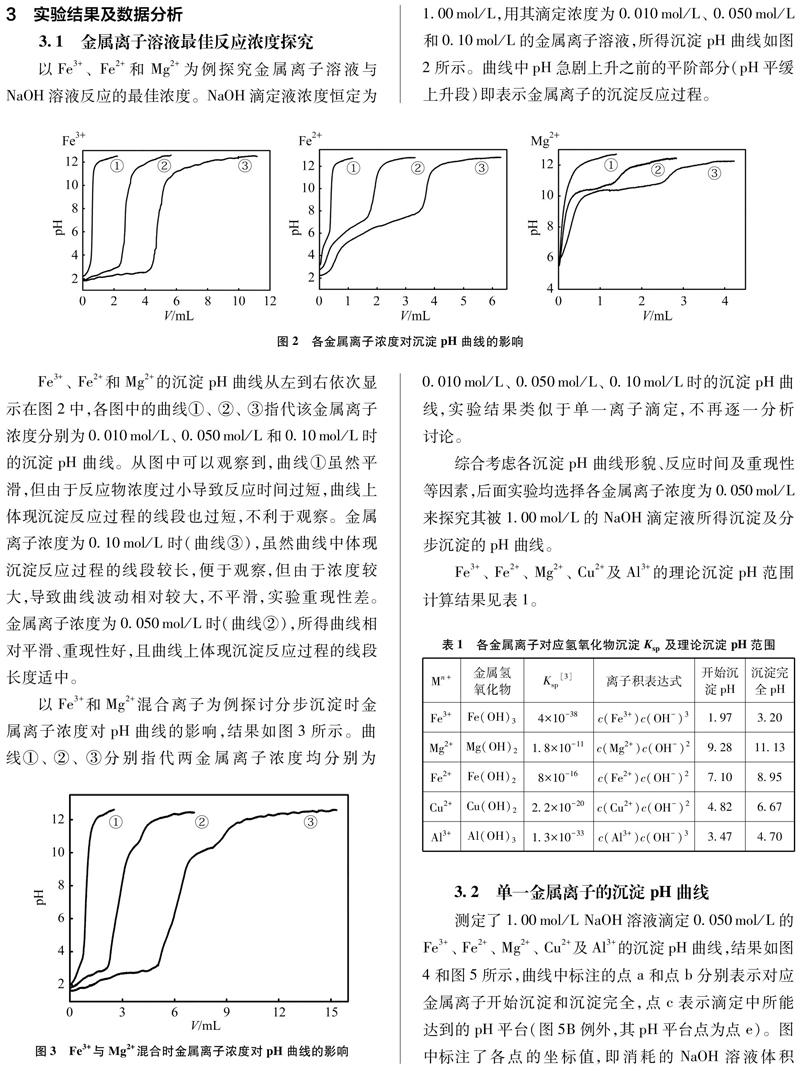
以Fe3+、 Fe2+和Mg2+为例探究金属离子溶液与NaOH溶液反应的最佳浓度。NaOH滴定液浓度恒定为1.00mol/L,用其滴定浓度为0.010mol/L、 0.050mol/L和0.10mol/L的金属离子溶液,所得沉淀pH曲线如图2所示。曲线中pH急剧上升之前的平阶部分(pH平缓上升段)即表示金属离子的沉淀反应过程。
Fe3+、 Fe2+和Mg2+的沉淀pH曲线从左到右依次显示在图2中,各图中的曲线①、 ②、 ③指代该金属离子浓度分别为0.010mol/L、 0.050mol/L和0.10mol/L时的沉淀pH曲线。从图中可以观察到,曲线①虽然平滑,但由于反应物浓度过小导致反应时间过短,曲线上体现沉淀反应过程的线段也过短,不利于观察。金属离子浓度为0.10mol/L时(曲线③),虽然曲线中体现沉淀反应过程的线段较长,便于观察,但由于浓度较大,导致曲线波动相对较大,不平滑,实验重现性差。金属离子浓度为0.050mol/L时(曲线②),所得曲线相对平滑、重现性好,且曲线上体现沉淀反应过程的线段长度适中。
以Fe3+和Mg2+混合离子为例探讨分步沉淀时金属离子浓度对pH曲线的影响,结果如图3所示。曲线①、 ②、 ③分别指代两金属离子浓度均分别为0.010mol/L、 0.050mol/L、 0.10mol/L时的沉淀pH曲线,实验结果类似于单一离子滴定,不再逐一分析讨论。
综合考虑各沉淀pH曲线形貌、反应时间及重现性等因素,后面实验均选择各金属离子浓度为0.050mol/L来探究其被1.00mol/L的NaOH滴定液所得沉淀及分步沉淀的pH曲线。
Fe3+、 Fe2+、 Mg2+、 Cu2+及Al3+的理论沉淀pH范围计算结果见表1。
3.2 单一金属离子的沉淀pH曲线
测定了1.00mol/L NaOH溶液滴定0.050mol/L的Fe3+、 Fe2+、 Mg2+、 Cu2+及Al3+的沉淀pH曲线,结果如图4和图5所示,曲线中标注的点a和点b分别表示对应金属离子开始沉淀和沉淀完全,点c表示滴定中所能达到的pH平台(图5B例外,其pH平台点为点e)。图中标注了各点的坐标值,即消耗的NaOH溶液体积(mL)和对应的pH。
3.2.1 Fe3+的沉淀
随着NaOH溶液的滴入,很快就观察到Fe3+溶液由浅黄色逐渐转变为红褐色,表明Fe(OH)3胶体生成,随着滴定的继续,胶体聚集变成红褐色沉淀。Fe3+的沉淀pH曲线如图4A所示。借助系统软件,读取曲线的平阶部分即pH平缓上升段(ab段)的pH,得到Fe3+沉淀的实际pH范围为1.91~3.20,与表1中的理论沉淀pH范围吻合。待Fe3+沉淀完全(b点)之后,随NaOH溶液的滴入,pH急剧上升后趋于平缓,直到达c点,此时pH约12.52,消耗NaOH溶液体积为5.12mL。
图4B为Fe3+沉淀反应部分的放大图像,能清晰地观察到Fe3+沉淀反应部分呈现出三个具有一定规律的平阶段,可能源于Fe3+與OH-的分步反应。
3.2.2 Fe2+的沉淀
Fe2+与OH-反应的pH曲线见图4C。随着滴定的进行,pH迅速上升。达a点后,开始生成白色絮状Fe(OH)2沉淀,沉淀迅速变为墨绿色,反应停止后在烧杯壁上会观察到少量红褐色沉淀,这是因为Fe(OH)2被空气中O2氧化为Fe(OH)3的缘故。读取曲线中pH平缓上升段(ab段)的pH,得到Fe2+沉淀的实际pH范围为4.91~7.56。Fe2+开始沉淀的实际pH比理论值明显更低,原因分析如下:在搅拌条件下,水中溶氧相对较多,滴加NaOH溶液的瞬间,搅拌扩散不均匀导致OH-局部浓度过高,生成Fe(OH)2,其还未经历沉淀溶解平衡就被氧化为Fe3(OH)8(即铁的混合价态氢氧化物)沉淀,导致开始沉淀的pH显著提前。开始沉淀的pH提前也就导致了Fe2+沉淀完全的pH提前,在钱扬义的研究中也有此现象出现[4]。Fe2+沉淀完全(b点)之后,随NaOH溶液的滴入,pH急剧上升后趋于平缓,平台点(c点)对应的坐标值已经标注在图中。
3.2.3 Mg2+的沉淀
Mg2+与OH-反应的沉淀pH曲线(图4D)与Fe2+的类似,反应过程不再讨论。沉淀曲线显示Mg2+沉淀的实际pH范围为10.07~11.11(ab段),与表1中的理论沉淀pH范围基本吻合。
3.2.4 Cu2+的沉淀
Cu2+与OH-反应的沉淀pH曲线(见图5A)与Fe2+的类似。沉淀曲线显示Cu2+沉淀的实际pH范围为4.60~6.30(ab段),与表1中的理论沉淀pH范围吻合。
Cu(OH)2会被高浓度NaOH溶液溶解,其溶解反应的离子方程式及平衡常数如下:
将[Cu(OH)4]2-浓度为1.0×10-5mol/L和0.050mol/L代入式(3)得Cu(OH)2开始溶解到溶解完全的理论pH范围为12.08~13.92。浓度为1.00mol/L NaOH滴定液难以使反应液pH达到沉淀溶解完全所需的13.92,故不能观察到明显的溶解曲线段。事实上,反应结束后,观察到烧杯中仍有大量Cu(OH)2沉淀未溶解,但溶液已由无色变为蓝色,表明部分沉淀溶解,生成Cu(OH)2-4。
3.2.5 Al3+的沉淀
Al3+与OH-反应的沉淀pH曲线如图5B所示。a点后,观察到乳白色Al(OH)3胶体生成,随滴定的进行,胶体将逐渐聚沉为白色沉淀。沉淀曲线显示Al3+沉淀的实际pH范围为3.72~4.51,与理论沉淀pH范围吻合。沉淀完全(b点)之后,随NaOH溶液的滴入,pH急剧上升达到c点(pH 9.98),此时观察到白色沉淀开始溶解,cd段揭示了Al(OH)3的酸性,即与NaOH反应的性质,反应的离子方程式及平衡常数如下:
将[Al(OH)4]-浓度为1.0×10-5mol/L和0.050mol/L代入式(5)可计算得Al(OH)3沉淀溶解开始到溶解完全的理论pH范围为8.85~12.55,而滴定曲线对应的实验结果为9.98~11.03,两者有差异,可能源于Al(OH)3的强吸附性能。
Al3+沉淀反应的放大图像(见图5C)也呈现出多个具有一定规律的平阶段,可能源于Al3+与OH-明显的分步反应。
3.3 混合金属离子的沉淀pH曲线
基于Cu(OH)2和Al(OH)3与NaOH反应的这一性质,在此仅讨论Fe3+、 Fe2+及Mg2+两两混合和三种离子混合时的分步沉淀pH曲线。各离子浓度均为0.050mol/L,NaOH滴定液浓度为1.00mol/L。
3.3.1 Mg2+与Fe3+混合溶液的沉淀pH曲线
NaOH溶液滴定Mg2+与Fe3+混合离子的pH曲线如图6A所示。整个滴定过程中pH的变化趋势与单一离子滴定时的情况类似,在此不再详述。曲线中pH平缓上升的两段,即ab段和cd段,分别为Fe3+和Mg2+沉淀反应的曲线段。从沉淀pH曲线上读取Fe3+和Mg2+沉淀的pH范围,分别为1.88~3.25和9.64~10.74。此pH范围与单独滴定结果基本相符,表明Mg2+与Fe3+共存时,控制适宜pH可实现分步沉淀。
实验中观察到的异常现象为:pH升至4.00左右,即理论上Fe3+已沉淀完全而Mg2+还未开始沉淀时,所得沉淀的颜色为砖红色,而非单一Fe(OH)3的红褐色。比较图6A和图4D中Mg2+沉淀反应所消耗的NaOH溶液的体积,发现Mg2+分步沉淀中消耗NaOH溶液體积(0.63mL)明显小于单一Mg2+沉淀时消耗的体积(1.02mL)。可能的原因是:随着NaOH溶液的滴入,Fe3+生成Fe(OH)3胶体,其表面吸附Mg2+,导致胶体表面Mg2+浓度局部过浓,在未达到其初始沉淀pH前便有部分生成了白色Mg(OH)2沉淀。红褐色掺杂少量白色沉淀时便呈现出砖红色。由于Mg2+被Fe(OH)3胶体强烈吸附,也导致Mg2+分步沉淀中消耗的NaOH溶液体积减少。
3.3.2 Mg2+与Fe2+混合溶液的沉淀pH曲线
NaOH溶液滴定Mg2+与Fe2+混合离子的pH曲线如图6B所示。整个滴定过程中pH的变化趋势与单一离子滴定时的情况类似。与单一离子的滴定相比较,实验中未观察到异常的宏观现象。图中的ab段与cd段分别为Fe2+、 Mg2+的沉淀反应段,对应的pH范围与单一金属离子沉淀的pH范围基本吻合,所消耗NaOH溶液体积也基本一致。表明Mg2+与Fe2+共存,可以调节pH实现分步沉淀,先沉淀Fe2+,再沉淀Mg2+,且相互之间不干扰。
3.3.3 Fe3+与Fe2+混合溶液的沉淀pH曲线
NaOH溶液滴定Fe3+和Fe2+混合离子的沉淀pH曲线如图6C所示。曲线中ab段与cd段分别为Fe3+、 Fe2+的沉淀反应段,对应的pH范围与单一金属离子沉淀的pH范围基本吻合,所消耗NaOH溶液体积也基本一致。表明Fe3+、 Fe2+共存,可以调节pH实现分步沉淀。
3.3.4 Mg2+、 Fe3+、 Fe2+混合溶液的沉淀pH曲线
NaOH溶液滴定Fe3+、 Fe2+与Mg2+混合离子的pH曲线如图7所示。与单一离子及两种离子混合的滴定相比较,实验中未观察到异常的宏观现象。图7中的ab、 cd与ef段分别为Fe3+、 Fe2+与Mg2+的沉淀反应段,对应的pH范围分别为1.93~3.33、 4.64~6.30和10.07~10.91,与单一离子及两种离子混合滴定的沉淀pH范围基本吻合,所消耗NaOH溶液体积也基本一致。表明三者共存时,控制适宜pH可实现分步沉淀。
3.4 四重表征及化学学科核心素养的发展
金属离子沉淀的pH曲线可将传统实验的三重表征:宏观现象、微观本质、化学符号,转化为四重表征:宏观现象、微观本质、化学符号和曲线变化,使学生对于金属离子沉淀的过程和本质的理解更加透彻。同时,金属离子沉淀过程的数字化实验探究对于化学学科核心素养的发展也起到了重要作用。本实验所得的沉淀pH曲线,建立了沉淀这一宏观现象与微观离子反应之间的联系,分析不同阶段pH变化趋势有助于理解金属离子与OH-反应的微观本质,对于培养学生“宏观辨识与微观探析”的素养有很大帮助。不是任何浓度的OH-都能使金属离子沉淀,而必须待其浓度达到一定值,即离子积大于溶度积Ksp时,平衡才会向生成沉淀的方向移动,这个过程对于“变化观念与平衡思想”素养的提升有促进作用。混合金属离子用NaOH溶液分步沉淀的动态pH-V曲线的建立,需要学生收集证据、分析推理,最后形成科学认知,对于提高学生“证据推理与模型认知”的素养也有很大帮助。实验测定过程中对于异常现象及数据的分析和处理,让学生懂得了尊重实验事实的重要性,对于树立学生严谨的科学态度和优秀的实验品质有重要的价值。
4 实验结论
(1) 单一Fe3+、 Mg2+、 Cu2+、 Al3+沉淀时,其实际沉淀pH范围与理论值基本符合,但Fe2+的实验结果与理论值有显著差异,且五种离子沉淀的平台值基本一致,约为pH 12.50。
(2) Fe3+、 Fe2+与Mg2+两两或三种离子混合时,均能调节适宜pH,实现分步沉淀,即达到中学化学教学中通过调节pH实现金属离子分离的目的。且分步沉淀时,各离子的沉淀pH范围与单一离子沉淀时的结果基本符合。
(3) Fe3+、 Fe2+与Mg2+两两或三种离子混合时的分步沉淀,除了Fe3+与Mg2+共存时,因Fe(OH)3强烈吸附Mg2+导致Mg2+分步沉淀消耗NaOH体积明显低于单一Mg2+沉淀时消耗的体积外,其余各离子分步沉淀消耗的NaOH溶液量均与单一离子滴定结果基本符合。
(4) Fe3+和Al3+与OH-反应时的分步反应导致沉淀反应曲线有多个平阶段。
参考文献:
[1]钱扬义,陈健斌,吴宗志,王任跃,徐锦洪. 利用掌上实验室(Lab in Hand)进行溶解氧的探究[J]. 化学教育,2003,24(11):41~43.
[2][4]温美凤,钱扬义. 硫酸亚铁及氯化铁与硫酸亚铁混合溶液与氢氧化钠溶液反应的沉淀pH曲线的测定及分析[J]. 化学教育(中英文),2018,39(3):69~75.
[3]武汉大学主编,分析化学[M]. 北京:高等教育出版社,2006.
[5][6]李梦龙,蒲雪梅主编,分析化学数据速查手册[M]. 北京:化学工业出版社,2009.

